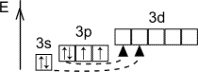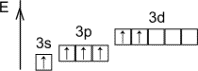- •Соединения железа
- •Оксид хрома Cr2о3[(амфотерный) Получение
- •Свойства
- •Положение элементов-неметаллов в Периодической системе химических элементов д.И. Менделеева
- •1.5. Химические свойства неметаллов
- •Взаимодействие с металлами:
- •Взаимодействие с другими неметаллами:
- •Получение кислорода.
- •7) Сера растворяется в концентрированном растворе сульфита натрия:
- •Применение
- •Серная кислота
- •Оксиды серы
- •Химические свойства
- •Химические свойства Образование ковалентной связи по донорно-акцепторному механизму.
- •Получение
- •Химические свойства
- •Химические свойства
- •Химические свойства
- •Химические свойства
- •Специфические свойства азотной кислоты Сильный окислитель
- •II. Соединения углерода
- •IV. Кислородные соединения углерода.
- •Угольная кислота и её соли
- •Свойства карбонатов
- •Классифиция химических реакции
- •I. По числу и составу исходных и образующихся веществ:
- •2)По изменениям степеней окисления элементов
- •5.По наличию границы раздела фаз
- •6. По признаку участия катализаторов
- •Химическое равновесие
- •Смещение химического равновесия
- •«Электролиз растворов и расплавов солей»
- •Примеры:
- •1.1. Катион стоит в ряду до н, кислотный остаток содержит кислород о:
- •1.2. Катион стоит в ряду до н, кислотный остаток беcкислородный:
- •3.1. Катион стоит в ряду после н, кислотный остаток содержит кислород о:
- •3.2. Катион стоит в ряду после н, кислотный остаток беcкислородный:
- •Соединения меди(I)[править | править вики-текст]
- •Соединения меди(II)[править | править вики-текст]
Получение кислорода.
В промышленности кислород получают из жидкого воздуха.
Кислород можно получить и при разложении воды в специальном устройстве – электролизёре.

В лаборатории используют пероксид водорода (Н2О2). Эта реакция идёт в присутствии катализатора – оксида марганца IV
![]()
в лаборатории ещё используют реакцию разложения перманганата калия – KMnO4 – «марганцовки».

В лабораторных условиях кислород выделяется кислород при нагревании бертолетовой соли (хлората калия)
2KClO3 = 2KCl + 3O2↑ Катализатор - оксид марганца (MnO2).
кислород существует в виде двух аллотропных модификаций –O2 и О3.
Вещество |
Агрегатное состояние при |
Цвет |
Запах |
Температура плавления, 0С |
Температура кипения, 0С |
Кислород О2 |
Газ |
Бесцветный, |
Без запаха |
- 218,2 |
- 182,8 |
Озон О3 |
Газ |
Бесцветный, |
Резкий, характерный запах |
- 251 |
- 112 |
Химические свойства
Кислород не взаимодействует с галогенами, благородными газами, золотом и платиной.
Кислород энергично реагирует с металлами. Например, в реакции с литием, образуется оксид лития, в реакции с медью – оксид меди (II).
4Li + O2 = 2Li2O 2Cu + O2 = 2CuO
Кислород реагирует с неметаллами.
S + O2 = SO2 4P + 5O2 = 2P2O5
Почти все реакции с кислородом экзотермические (то есть сопровождаются выделением теплоты). Исключение составляет реакция азота с кислородом, которая является эндотермической.
N2 + O2 ↔ 2NO – Q
Кислород сложные вещества.
CH4 + 2O2 = CO2↑ + 2H2O 2H2S + 3O2 = 2SO2↑ + 2H2O
СЕРА n=16 1s22s22p63s23p4
Физические свойства
Твердое кристаллическое вещество желтого цвета, нерастворима в воде, водой не смачивается (плавает на поверхности)
Аллотропия
1) ромбическая - S8
Наиболее устойчивая модификация.

2) моноклинная - темно-желтые иглы
Устойчивая при температуре более 96С; при обычных условиях превращается в ромбическую.
3) пластическая - коричневая резиноподобная (аморфная) масса
![]()
Неустойчива, при затвердевании превращается в ромбическую.
Строение атома S
|
1s22p22p63s23p4 |
|
о |
|
|
|
+2, -2 |
II |
|
+4 |
IV |
|
+6 |
VI |
Получение
Неполное окисление сероводорода (при недостатке кислорода).
2H2S + O2 2S + 2H2O 2H2S + SO2 3S + 2H2O
Химические свойства
Окислительные свойства серы (S0 + 2ē S-2)
1) Сера реагирует со щелочными металлами без нагревания: 2Na + S Na2S
c остальными металлами (кроме Au, Pt) - при повышенной t:
2Al + 3S –t Al2S3 Zn + S –t ZnS
2) С некоторыми неметаллами сера образует бинарные соединения:
H2 + S H2S 2P + 3S P2S3 C + 2S CS2
3) c кислородом:S + O2 –t= S+4O2
4) c галогенами (кроме йода):S + Cl2 S+2Cl2
5) c кислотами - окислителями:
S + 2H2SO4(конц) 3S+4O2 + 2H2O
S + 6HNO3(конц) H2S+6O4 + 6NO2 + 2H2O
6)Реакции диспропорционирования:
3S + 6KOH = K2SO3 + 2K2S + 3H2O