В
обычных условиях С1- С4 – газы
С5- С15 – жидкие С16 –
твёрдые
Температуры
плавления и кипения алканов, их
плотности увеличиваются в гомологическом
ряду с ростом молекулярной массы. Все
алканы легче воды, в ней не растворимы,
однако растворимы в неполярных
растворителях (например, в бензоле) и
сами являются хорошими растворителями.
Название
|
Формула
|
Метан
|
СН4
|
Этан
|
С2Н6
|
Пропан
|
С3Н8
|
Бутан
|
С4Н10
|
Пентан
|
C5H12
|
Гексан
|
С6Н14
|
Изомерия
Структурная — изомерия
углеродного скелета
Химические
свойства алканов
1.
Реакции замещения.
а) Галогенирование
при действии света - hν или
нагревании (стадийно – замещение
атомов водорода на галоген носит
последовательный цепной характер.
Реакция Н. Н. Семёнова )
В
реакции образуются вещества
галогеналканы Сn H2n+1Г (Г -
это галогены F, Cl, Br,
CH4 + Cl2 hν → CH3Cl + HCl (1
стадия) ;
хлорметан
CH3Cl + Cl2 hν → CH2Cl2 + HCl (2
стадия);
дихлорметан
СH2Cl2 + Cl2 hν → CHCl3 + HCl (3
стадия);
трихлорметан
CHCl3 + Cl2 hν → CCl4 + HCl (4
стадия).
тетрахлорметан
Электронная
плотность связи С – Cl смещена
к более электроотрицательному хлору,
в результате на
углерода
ближайщего к заместителю:
CH3 –
CH2 – Cl + Cl2 hν → CH3 –
CHCl2 + HCl
хлорэтан
1,1 -дихлорэтан.
Внимание!
В
реакциях замещения алканов легче
всего замещаются атомы водорода у
третичных атомов углерода, затем у
вторичных и, в последнюю очередь, у
первичных.

б)
Нитрование (реакция М.И. Коновалова,
он провёл её впервые в 1888 г)
CH4 +
HNO3(раствор) t˚С → CH3NO2 + H2O
нитрометан
RNO2 или Сn H2n+1 NO2 (нитроалкан)
2.
Реакции отщепления (дегидрирование)
а) CnH2n+2 t˚С, Ni или Pd → CnH2n + H2
б)
При нагревании до 1500 С происходит
образование ацетилена и водорода:
2CH4 1500°С →
C2H2 + 3H2
3.
Реакции перегруппировки (изомеризация)
н-алкан
AlCl3, t°С → изоалкан
4.
Реакции горения (горят светлым не
коптящим пламенем)
CnH2n+2 + O2 t°С → nCO2 +
(n+1)H2O
Помните! Смесь
метана с воздухом и кислородом
взрывоопасна
5.
Реакции разложения
а) Крекинг при
температуре 700-1000°С разрываются (-С-С-)
связи:
C10H22 t°С →
C5H12 + C5H10
б) Пиролиз при
температуре 1000°С разрываются все
связи,
СH4 1000°С → C +
2H2
в) Конверсия метана
с образованием синтез – газа
(СО + Н2)
CH4 + H2O 800˚C, Ni →
СО + 3Н2
Циклоалканы
СnH2n
Sp3-гибридизация
Углеводороды с замкнутыми цепями
(циклами). По своим свойствам они
напоминают обычные предельные
углеводороды алканы (парафины),
отсюда и произошло их название –
циклоалканы (циклопарафины, нафтены).
Общая формула гомологического ряда
циклоалканов CnH2n.
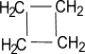
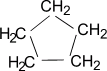
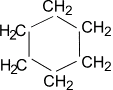
Представителями этого ряда соединений
являются циклопропан, циклобутан,
циклопентан, циклогексан.

|
|
|
|
Циклопропан
|
Циклобутан
|
Циклопентан
|
Циклогексан
|
Циклоалканы
имеют более высокие температуры
плавления, кипения и большую плотность,
чем соответствующие алканы. При
одинаковом составе температура
кипения циклопарафина тем выше, чем
больше размер цикла. Циклоалканы в
воде практически не растворимы,
однако растворимы в органических
растворителях.
Изомерия
циклоалканов
Для
циклоалканов характерны как
структурная, так и пространственная
изомерия.
Структурная
изомеpия
1.
Изомерия углеродного скелета:
а) кольца

б) боковых
цепей

2.
Изомерия положения заместителей в
кольце:
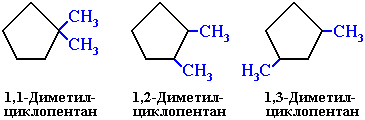
3.
Межклассовая изомерия с алкенами:

Пространственная
изомерия
1. Цис-транс-изомерия,
обусловленная различным взаимным
расположением в пространстве
заместителей относительно плоскости
цикла. В цис-изомерах заместители
находятся по одну сторону от плоскости
кольца, в транс-изомерах – по
разные анимация:

2. Оптическая изомерия
некоторых ди- (и более) замещенных
циклов. Например,транс-1,2-диметилциклопропан
может существовать в виде двух
оптических изомеров, относящихся
друг к другу как предмет и его
зеркальное изображение анимация:

Химические
свойства
Химические
свойства циклопарафинов зависят от
числа атомов углерода, составляющих
цикл. Низшие циклоалканы (циклопропан
и циклобутан) ведут себя как
ненасыщенные углеводороды, они
способны вступать в реакции
присоединения. Циклоалканы с большим
количеством углеродных атомов в
цикле ведут себя как алканы, для них
характерны реакции замещения.
Реакции
горения:
CnH2n +
3n/2O2 - t → nCO2 +
nH2O
+Q
Малые циклы (n=3,4)
|
Реакции
присоединения –
сходство с алкенами.
1)
Галогенирование:
C3H6 + Br2 → C3H6Br2
(1,3-дибромпропан )
циклопропан
2)
Гидрирование:
C4H8 + H2 - t,Ni или Pt → C4H10
( бутан )
циклобутан
3)
Гидрогалогенирование (по правилу
Марковникова):
C3H6 +
HI → CH3-CH2-CH2I
(
1- йодпропан )
|
Обычные циклы (n=5-7)
|
Реакции
замещения –
сходство с алканами.
1)
Галогенирование:
C6H12 + Br2 - t → C6H11Br + HBr
бромциклогексан
Реакции
отщепления – дегидрирования
циклогексана (р. Зелинского-Казанского):
C6H12 - t=300˚С
,Pt,Pd→ C6H6 +
3H2
бензол
|
Получение
циклоалканов
В промышленности
|
1) Из нефти
(пяти- и шестичленных)
Циклоалканы
содержатся в значительных количествах
в нефтях некоторых месторождений
(отсюда произошло одно из их названий
- нафтены). При переработке
нефти выделяют главным образом
циклоалканы С5 - С7.
2) Из
ароматических углеводородов –
каталитическое гидрирование:
C6H6 +
H2 -t,p,Ni→ C6H12

|
В лаборатории
|
Из
дигалогенпроизводных алканов
(внутримолекулярная реакция
Вюрца):
Br-CH2-CH2-CH2-Br
+ Mg - t → MgBr2 +
C3H6
Cl-CH2-CH2-CH2-CH2-Cl
+ 2Na → 2NaCl + C4H8

|
|
Алкены
СnH2n+2 Sp2-гибридизация,
двойная связь
Первые
три представителя гомологического
ряда алкенов (этилен, пропилен и
бутилен) — газы, начиная с C5H10(амилен,
или пентен-1) — жидкости, а с С18Н36 —
твердые вещества Алкены плохо
растворимы в воде (однако лучше, чем
соответствующие алканы), но хорошо
— в органических растворителях.
Этилен
(этен)
|
С2Н4
газ
|
|
|
Пропилен
(пропен)
|
С3Н6
газ
|
|
|
Химические
свойства алкенов
Для
алкенов наиболее типичными являются
реакции присоединения. В реакциях
присоединения двойная связь выступает
как донор электронов, поэтому для
алкенов характерны реакции
электрофильного присоединения.
Реакции
присоединения
1.
Гидрирование
CnH2n +
H2 t,
Ni →
CnH2n+2
2.
Галогенирование :
CnH2n + Г2 → СnH2nГ2
 Это
качественная реакция алкенов –
бромная вода Br2 (бурая жидкость)
обесцвечивается.
Это
качественная реакция алкенов –
бромная вода Br2 (бурая жидкость)
обесцвечивается.
3.
Гидрогалогенирование* с галогенводородами)

4.
Гидратация* (присоединение молекул
воды):

CH2=CH2 + H2O → CH3-CH2-OH
(этанол – этиловый спирт)
*
Присоединение галогенводородов и
воды к несимметричным алкенам
происходит поправилу Марковникова
В.В.
Присоединение
водорода происходит к наиболее
гидрированному атому углерода при
двойной углерод-углеродной связи.
5.
Реакции полимеризации:
nCH2=CH2 → (-CH2-CH2-)

1)Реакции
окисления
CnH2n +
3n/2O2 t, p, kat → nCO2 + nH2O + Q (пламя
ярко светящее)

реакция
алкенов, розовый раствор марганцовки
обесцвечивается. (пункт3)

Влияние
среды на характер продуктов реакций
окисления
1) Окисление
в кислой среде при нагревании
идёт до:
а)
карбоновых кислот;
б)
кетонов (если атом углерода при
двойной связи содержит два заместителя);
в)
углекислого газа (если двойная связь
на конце молекулы, то образуется
муравьиная кислота, которая легко
окисляется до CO2):
а)
5CH3-CH=CH-CH3 + 8KMnO4 + 12H2SO4 → 10CH3COOH
+ 8MnSO4 +4K2SO4 + 12H2O

в)
CH3 – CH2 – CH = CH2 + 2KMnO4 +
3H2SO4 → CH3CH2COOH + CO2 + 2MnSO4 + K2SO4 +
4H2O
2) Окисление
в нейтральной или слабощелочной
среде на холоде (см. выше п.3)
Изомерия
алкенов 2 вида:
1.Структурная
— изомерия положения двойной
связи и изомерия углеродного
скелета
Межклассовая
— алкены изомерны циклоакланам.
Пространственная
цис- транс изомерия
|
Алкины
 Sp3-гибридизация
Sp3-гибридизация
Для атомов
тройной связи характерна Sp-гибридизация,
тройная связь — это комбинация одной σ-
и двух Π-связей: молекулы линейные
окончание-ин

Изомерия
2 вида:Структурная — изомерия
положения тройной связи и изомерия
углеродного скелета
Межклассовая
— алкины изомерны акладиенам.
Химические
свойства алкинов:
1.
Тройная связь, как и двойная,
все присоединяет, разрывается, образует
двойную связь, если реагент дан в
избытке, то реакция может идти до
образования одинарной связи:
галогенирование,гидрогалогенирование,гидрирование:

2.
Гидратация — взаимодействие с водой
— реакция Кучерова:

3.
Качественные реакции алкинов: Ацетилениды
серебра и меди (I) легко образуются и
выпадают в осадок при пропускании
ацетилена через аммиачный раствор
оксида серебра или хлорида меди
(I). Эта реакция служит для обнаружения
алкинов с тройной связью на конце
цепи:

4.
Реакции
окисления: Алкины окисляются
перманганатом калия. При этом раствор
перманганата калия обесцвечивается,
что служит указанием на наличие тройной
связи. При окислении происходит
расщепление тройной связи и образуются
карбоновые кислоты, перманганат
восстанавливается до Mn(2+) — в кислой
среде, MnO2 — в щелочной:С4H6 + [O] →
2CH3COOH
5.
Реакции горения: СnH2n-2
+ (3n-1)\2
O2
→ nCO2
+ (n-1)
H2O
уравнение в общем виде.
Получение
алкинов: Из неорганических соединений:
CaC2 + H2O → 2Ca(OH)2 + C2H2
дегидрогалогенирование:
СH3-СHBr2 +2KOH (этанол, t) →C2H2 + 2KBr + 2H2O
Алкадиены
Sp2-гибридизация
Алкадиены
— в молекуле две двойные связи
В
зависимости от взаимного расположения
двойных связей различают три вида
диенов:
• алкадиены с
кумулированным расположением двойных
связей СН2=С=СН2
•
алкадиены с сопряженными двойными
связями CH2=CH—CH=CH2
•
алкадиены с изолированными двойными
связями CH2=CH—CH2—CH=CH2
Изомерия
и номенклатура
Структурная изомерия:
•
изомерия углеродного скелета:

Способ
дегидрирования. СН3—СН2—СН2—СН3 —>
CH2=CH—СН=СН2 + 2Н2
На первой стадии
этого процесса образуется как бутен-1,
так и бутен-2.
3. Способ
дегидрогалогенирования.
При
действии на дибромалканы спиртового
раствора щелочи происходит отщепление
двух молекул галогеноводорода и
образование двух двойных
связей:
 Существенным
является расположение галогенов в
молекуле дигалогенида. Так, например,
в случае 2,3-дибромбутана или
2,2-ди-бромпропана образуются
соответствующие алкины .
Химические
свойства
Существенным
является расположение галогенов в
молекуле дигалогенида. Так, например,
в случае 2,3-дибромбутана или
2,2-ди-бромпропана образуются
соответствующие алкины .
Химические
свойства
свойства алкадиенов с изолированными
двойными связями мало отличаются от
свойств алкенов. Алкадиены с сопряженными
связями обладают некоторыми
особенностями.
1. Реакции присоединения.
Алкадиены способны присоединять
водород, галогены, галогеноводороды.
Особенностью
присоединения к алкадиенам с сопряженными
двойными связями является способность
присоединять молекулы как в положения
1 и 2 (1,2-присоединение), так и в положения
1 и 4
(1,4-присоединение):
Вr
Вr
|
|
СН2=СН—СН=СН2 + Вг2 —>
CH2—CH—CH=CH2
1,2-присоединение
Вг
Вг
|
l
CH2=CH—СН=СН2 + Вг2 —>
CH2—CH=CH—CH2
1,4-присоединение
2. Реакции
полимеризации. Полимеризация этих
соединений является основой получения
синтетических каучуков. двойная связь
оказывается центральной в элементарном
звене, а элементарное звено, в свою
очередь, может принимать как цис-, так
и транс-конфигурацию:

Натуральный
и синтетический каучуки. Резина
Натуральный каучук выделяется из
млечного сока (латекса) гевеи.
Натуральный каучук -цис-полиизопрен,
, элементарные звенья которого
соответствуют изопрену (2-метилбутадиену-1,3)
и находятся в цис-конфигурации. Каучук,
в котором все элементарные звенья
находятся или в цис-, или в
транс-конфигурации, называется
стереорегулярным. При нагревании
каучука с серой (до 8%) образуется
резина. При вулканизации происходит
сшивание полимерных цепей за счет
сульфидных мостиков, что приводит к
увеличению прочности.
 Арены-
производные бензолаС 6Н 6
С nН 2n- 6(при
n >= 6).
sр 2-гибридизация
Арены-
производные бензолаС 6Н 6
С nН 2n- 6(при
n >= 6).
sр 2-гибридизация
Радикал
бензола С 6Н 5называется фенил,
радикал толуола С 6Н 5СН 2— бензил.Бензол
и его ближайшие гомологи – жидкости
без цвета, но с характерным запахом.
Практически
не растворяются в воде. Пар бензола
сильно ядовит. Несмотря на формальную
непредельность, бензол отличается
высокой устойчивостью к нагреванию
и окислению (в гомологах бензола
окисляется только боковая цепь).
Характерными для бензола являются
реакции замещения:
а) нитрование
в присутствии концентрированной
серной кислоты на холоду:

б) галогенированиев
присутствии галогенидов железа (III):

в) алкилированиев
присутствии хлорида алюминия:

В
производных бензола атом или группа,
заместившие водород кольца, и само
бензольное кольцо влияют друг на
друга. По характеру влияния различают:
1) заместители
I рода – CI, Br, I, СН 3, С nН 2n+1, ОН
и NH 2. Они облегчают реакции дальнейшего
замещения и направляют второй
заместитель по отношению к себе
в орто-(о-, или 2-) положение и
в пара-( п-, или 4-) положение [для
запоминания: орто – около, пара
– против], например:
2) заместители
II рода – NO 2, С(Н)O, СООН и CN. Они
затрудняют реакции дальнейшего
замещения и направляют второй
заместитель в мета-( м-, или 3-)
положение, например:

Бензол
стоек к окислению даже при действии
сильных окислителей. Гомологи бензола
с одним боковым радикалом вступают в
реакции окисления только за счет
радикала; при этом, какова бы ни была
его длина, отщепляется вся цепь, кроме
ближайшего к кольцу атома углерода
(он создает карбоксильную группу):
В
жестких условиях бензол вступает в
реакции присоединения:

Стирол
C 6H 5—CH=CH 2 , как этилен, легко
полимеризуется:
 Полистирол–
термопластичная пластмасса (термопласт),
. Используется для изготовления
изоляции электропроводов, посуды
разового употребления, упаковочной
массы (пенопласт).
Полистирол–
термопластичная пластмасса (термопласт),
. Используется для изготовления
изоляции электропроводов, посуды
разового употребления, упаковочной
массы (пенопласт).
Получение
аренов :1) дегидрирование:

2) дегидроциклизация:

3) тримеризация
ацетилена (устаревший способ):
Спирты
-
соединения, содержащие одну или
несколько гидроксильных групп,
непосредственно связанных с
углеводородным радикалом.
Классификация
спиртов1. По
числу гидроксильных групп спирты
подразделяются
одноатомные (одна
группа -ОН) СH3 – OH метанол, CH3 – CH2 – OH этанол
многоатомные (две
и более групп -ОН).
двухатомный
спирт – этиленгликоль (этандиол)HO–СH2–CH2–OH
трехатомный
спирт – глицерин (пропантриол-1,2,3) HO–СH2–СН(ОН)–CH2–OH
Двухатомные
спирты с двумя ОН-группами при одном
и том же атоме углерода неустойчивы,
отщепляя воду, превращаются в
альдегиды R–CH=O. Спиртов R–C(OH)3 нет.
2. В
зависимости от того, с каким атомом
углерода (первичным, вторичным или
третичным) связана гидроксигруппа,
различают спирты

Типы
атомов углерода

3. По
строению радикалов, связанных с
атомом кислорода, спирты подразделяются
на

Предельные
одноатомные спирты.
С nН 2n+1ОН
Общая
формула:
CnH2n+1OH или
ROH или
CnH2n+2O
|
Гомологический
ряд

Номенклатура
спиртов
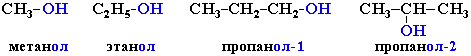
Изомерия
спиртов 1) структурная изомерия:

2)межклассовая
изомерия с простыми эфирами
этиловый
спирт СН3CH2–OH и диметиловый
эфир CH3–O–CH3
3)Возможна
также пространственная изомерия –
оптическая.
бутанол-2 СH3CH(OH)СH2CH3,
в молекуле которого второй атом
углерода связан с четырьмя различными
заместителями, существует в форме
двух оптических изомеров.
Строение
спиртов
 Из
электронной формулы видно, что
кислород в молекуле спирта имеет
две неподеленные электронные
пары. Свойства спиртов и фенолов
определяются строением гидроксильной
группы, характером ее химических
связей, строением углеводородных
радикалов и их взаимным влиянием.
Из
электронной формулы видно, что
кислород в молекуле спирта имеет
две неподеленные электронные
пары. Свойства спиртов и фенолов
определяются строением гидроксильной
группы, характером ее химических
связей, строением углеводородных
радикалов и их взаимным влиянием.
Связи
О–Н и С–О – полярные ковалентные.
Это следует из различий в
электроотрицательности кислорода
(3,5), водорода (2,1) и углерода (2,4).
Электронная плотность обеих связей
смещена к более электроотрицательному
атому кислорода:
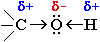
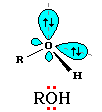
Атому
кислорода в спиртах свойственна
sp3-гибридизация. Подвижность атома
водорода в гидроксильной группе
спирта несколько меньше, чем в воде.
Более "кислым" в ряду одноатомных
предельных спиртов будет метиловый
(метанол).
Радикалы в молекуле
спирта также играют определенную
роль в проявлении кислотных свойств.
Обычно углеводородные радикалы
понижают кислотное свойства. Но если
в них содержатся, электроноакцепторные
группы, то кислотность спиртов
заметно увеличивается. Например,
спирт (СF3)3С—ОН за счет атомов фтора
становится настолько кислым, что
способен вытеснять угольную кислоту
из ее солей.
|
Химические
свойства предельных одноатомных
спиртов
В
химических реакциях гидроксисоединений
возможно разрушение одной из двух
связей:
· С–ОН
с отщеплением ОН-группы
· О–Н
с отщеплением водорода
Это
могут быть реакции замещения, в
которых происходит замена ОН или Н,
или реакция отщепления (элиминирования),
когда образуется двойная связь.
Полярный
характер связей С–О и О–Н способствует
гетеролитическому их разрыву и
протеканию реакций по ионному механизму.
При разрыве связи О–Н с отщеплением
протона (Н+) проявляются кислотные
свойства гидроксисоединения, а при
разрыве связи С–О – свойства
основания и нуклеофильного реагента.
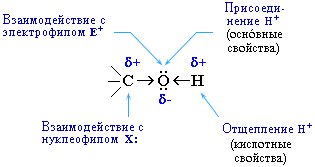
С
разрывом связи О–Н идут реакции
окисления, а по связи С–О –
восстановления.
Спирты могут
вступать в многочисленные реакции,
давая различные классы соединений.
Кислотно-основные
RO- + H+ ↔ ROH ↔ R+ + OH- алкоголят-ион
Кислотные
свойства уменьшаются в ряду, а
основные возрастают:
HOH
→ R-CH2-OH → R2CH-OH → R3C-OH
вода первичный вторичный третичный
|
Кислотные
свойства
1.С
активными щелочными металлами:
2C2H5OH +
2 Na → 2C2H5ONa + H2
этилат натрия
Алкоголяты
подвергаются гидролизу
C2H5ONa + H2O ↔ C2H5OH + NaOH
2.Основные
свойства- с галогенводородными
кислотами:
C2H5OH
+ HBr ↔ C2H5Br + H2O
бромэтан
Лёгкость
протекания реакции зависит от природы
галогенводорода и спирта – увеличение
реакционной способности происходит
в следующих рядах:
HF < HCl < HBr < HI
|
первичные < вторичные < третичные
|
II.
Окисление
1). В
присутствии окислителей [O]
– K2Cr2O7 или KMnO4 спирты
окисляются до карбонильных соединений:
Первичные
спирты при окислении образуют
альдегиды, которые затем легко
окисляются до карбоновых кислот.
Уксусный
альдегид, или ацетальдегид, получается
при окислении этилового спирта
хромовой смесью.


При
окислении вторичных спиртов образуются
кетоны.

Третичные
спирты более устойчивы к действию
окислителей. Они окисляются только
в жестких условиях (кислая среда,
повышенная температура), что приводит
к разрушению углеродного скелета
молекулы и образованию смеси продуктов
(карбоновых кислот и кетонов с меньшей
молекулярной
массой).
В
кислой среде:
1)Для
первичных и вторичных одноатомных
спиртов качественной реакцией
является взаимодействие их с кислым
раствором дихромата калия. Оранжевая
окраска гидратированного
иона Cr2O72- исчезает и появляется
зеленоватая окраска, характерная
для иона Cr3+ .
CH3OH
+ K2Cr2O7 + 4H2SO4 → CO2 + K2SO4 +
Cr2(SO4)3 + 6H2O
3CH3-CH2-OH
+ K2Cr2O7 + 4H2SO4 → 3CH3COH + K2SO4 +
Cr2(SO4)3 + 7H2O
2)В
более жёстких условиях окисление
спиртов идёт до карбоновых кислот:
3CH3-CH2-OH
+ 2K2Cr2O7 + 8H2SO4 t→ 3CH3COOH + 2K2SO4 +
2Cr2(SO4)3 + 11H2O
3)Третичные
спирты устойчивы к окислению в
щелочной и нейтральной среде. В
жёстких условиях (при нагревании, в
кислой среде) они окисляются с
расщеплением связей С-С и образованием
кетонов и карбоновых кислот. В
нейтральной среде:
CH3 – OH +
2KMnO4 →K2CO3 + 2MnO2 + 2H2O, а остальные
спирты до солей соответствующих
карбоновых кислот.
2). Качественная
реакция на первичные спирты!

3).
Горение
CnH2n+1-OH
+ O2 t → CO2 + H2O + Q
III. Реакции
отщепления
1)
Внутримолекулярная дегидратация
CH3-CH2-CH(OH)-CH3 t>140,H2SO4(к)→ CH3-CH=CH-CH3 +
H2O
бутанол-2 бутен-2

В
тех случаях, когда возможны 2
направления реакции, например:
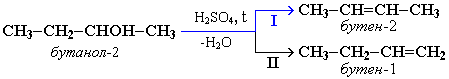
дегидратация
идет преимущественно в направлении
I, т.е. по правилу Зайцева – с
образованием более замещенного
алкена. Правило Зайцева: Водород
отщепляется от наименее гидрированного
атома углерода соседствующего с
углеродом, несущим гидроксил.

2) Межмолекулярная
дегидратация
2C2H5OH t<140,H2SO4(к)→ С2H5-O-C2H5 +
H2O
простой
эфир
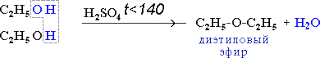
-
при переходе от первичных спиртов
к третичным увеличивается склонность к
отщеплению воды и образованию
алкенов; уменьшается способность
образовывать простые эфиры.
3)
Реакция дегидрирование и дегидратация
предельных одноатомных спиртов –реакция
С.В. Лебедева
2C2H5OH 425,ZnO,Al2O3→ CH2=CH-CH=CH2 +
H2 + 2H2O
IV. Реакции
этерификации. Спирты вступают в
реакции с минеральными и органическими
кислотами, образуя сложные эфиры.
Реакция обратима (обратный процесс
– гидролиз сложных эфиров).

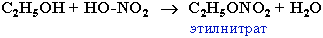
|
Многоатомные
спирты. Этиленгликоль, глицерин.
Многоатомные
спирты – содержатся несколько
гидроксильных групп (-ОН)
|

Получение
многоатомных спиртов
I.
Получение двухатомных спиртов
В промышленности
1. Каталитическая
гидратация оксида этилена (получение
этиленгликоля):

2. Взаимодействие
дигалогенпроизводных алканов с водными
растворами щелочей:

3. Из
синтез-газа:
2CO
+ 3H2 250°,200МПа,kat → CH2(OH)-CH2(OH)
В
лаборатории
1. Окисление
алкенов:

II.
Получение трёхатомных спиртов
(глицерина) Омыление жиров (триглицеридов):

Химические
свойства многоатомных спиртов
1.
С активными металлами:
HO-CH2-CH2-OH
+ 2Na → H2↑+ NaO-CH2-CH2-ONa (гликолят
натрия)
2.
С гидроксидом меди(II) – качественная
реакция!

1.
С галогенводородными кислотами
HO-CH2-CH2-OH
+ 2HCl ↔
Cl-CH2-CH2-Cl
+ 2H2O
2. С азотной кислотой

Тринитроглицерин
- основа динамита
фенол
1.
Фенолы - производные ароматических
углеводородов, в молекулах которых
гидроксильная группа (- ОН)
непосредственно связана с атомами
углерода в бензольном кольце.
2.
Классификация фенолов
Различают
одно-, двух-, трехатомные фенолы в
зависимости от количества ОН-групп
в молекуле:
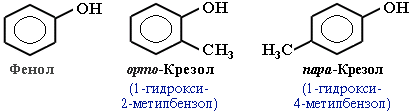
3. Изомерия
и номенклатура фенолов
Возможны
2 типа изомерии:

Для
фенолов широко используют тривиальные
названия, сложившиеся исторически.
В названиях замещенных моноядерных
фенолов используются также
приставки орто-, мета-и пара
-, употребляемые в номенклатуре
ароматических соединений
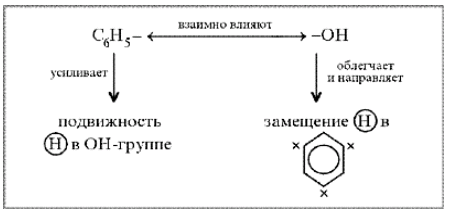
Фенильная
группа C6H5 – и гидроксил –ОН
взаимно влияют друг на друга

неподеленная
электронная пара атома кислорода
притягивается 6-ти электронным
облаком бензольного кольца, из – за
чего связь О–Н еще сильнее поляризуется.
Фенол - более сильная кислота, чем
вода и спирты.
В
бензольном кольце нарушается
симметричность электронного облака,
электронная плотность повышается
в положении 2, 4, 6. Это делает более
реакционноспособными связи С-Н в
положениях 2, 4, 6. и – связи бензольного
кольца.
Фенол
C6H5OH (карболовая кислота) — бесцветное
кристаллическое вещество на воздухе
окисляется и становится розовым,
при обычной температуре ограниченно
растворим в воде, выше 66 °C
смешивается с водой в любых
соотношениях. Фенол — токсичное
вещество, вызывает ожоги кожи,
является антисептиком
Получение
фенола в промышленности
1). Из
каменноугольной смолы:
C6H5ONa +
H2SO4(разб) → С6H5 – OH + NaHSO4
3). Из
галогенбензолов:
С6H5-Cl + NaOH t,p →
С6H5 – OH + NaCl
Химические
свойства фенола (карболовой кислоты)
I. Свойства
гидроксильной группы
Кислотные
свойства – выражены ярче, чем у
предельных спиртов:
!
Феноляты – соли слабой карболовой
кислоты, разлагаются угольной
кислотой –
C6H5-ONa
+ H2O + СO2 →
C6H5-OH + NaHCO3
По
кислотным свойствам фенол превосходит
этанол в 106 раз. При этом во столько
же раз уступает уксусной кислоте. В
отличие от карбоновых кислот, фенол
не может вытеснить угольную кислоту
из её солей
C6H5-OH + NaHCO3 = реакция
не идёт –
Кислотные
свойства фенола усиливаются под
влиянием связанных с бензольным
кольцом электроноакцепторных групп
(NO2-, Br-)
C6H5-OH<
п-нитрофенол < 2,4,6-тринитрофенол
|
2,4,6-тринитрофенол
или пикриновая кислота сильнее
угольной
II. Свойства
бензольного кольца
1). Взаимное
влияние атомов в молекуле фенола
проявляется не только в особенностях
поведения гидроксигруппы, но и в
большей реакционной способности
бензольного ядра. Гидроксильная
группа повышает электронную плотность
в бензольном кольце, особенно,
в орто- и пара-положениях
(+М-эффект ОН-группы):
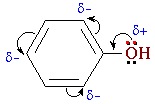 Поэтому
фенол значительно активнее бензола
вступает в реакции электрофильного
замещения в ароматическом
кольце.Нитрование. Под действием
20% азотной кислоты HNO3 фенол легко
превращается в смесь орто- и пара-нитрофенолов:
Поэтому
фенол значительно активнее бензола
вступает в реакции электрофильного
замещения в ароматическом
кольце.Нитрование. Под действием
20% азотной кислоты HNO3 фенол легко
превращается в смесь орто- и пара-нитрофенолов:

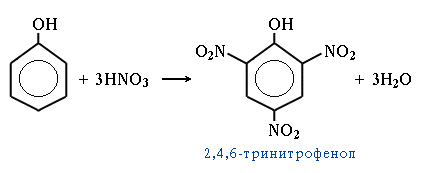
С
концентрированной HNO3 образуется
2,4,6-тринитрофенол (пикриновая
кислота):
Галогенирование.
Фенол легко при комнатной температуре
взаимодействует с бромной водой с
образованием белого осадка
2,4,6-трибромфенола (качественная
реакция на фенол):

Конденсация
с альдегидами. Например:

Гидрирование
фенола
C6H5-OH +
3H2 Ni, 170ºC → C6H11 – OH циклогексиловый
спирт (циклогексанол)
III. Качественная
реакция - обнаружение
фенола
6C6H5-OH + FeCl3 → [Fe(C6H5-OH)3](C6H5O)3 +
3HCl
FeCl3 - светло-жёлтый
раствор
[Fe(C6H5-OH)3](C6H5O)3 - фиолетовый
раствор
|
АЛЬДЕГИДЫ
Альдегидами
называются органические соединения,
содержащие карбонильную группу, в
которой атом углерода связан с радикалом
и одним атомом водорода, то есть общая
формула альдегидов 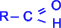 .
Исключение составляет муравьиный
альдегид
.
Исключение составляет муравьиный
альдегид 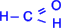 ,
в котором, как видно, R=H.
,
в котором, как видно, R=H.
Изомерия
Получение
1.
окисление и каталитическое дегидрирование
первичных спиртов.
a) Окисление
первичных спиртов перманганатом калия
или хромовой смесью.
Как видно, при
дальнейшем окислении образуются
кислоты. Эти реакции приводились уже
при рассмотрении химических свойств
спиртов.
b) Дегидрирование
первичных спиртов. Реакцию проводят,
пропуская пары спирта над нагретым
до 200-300С катализатором, в качестве
которого используются медь, никель,
кобальт и др.
СН3-СН2-ОН
+ СuO = CH3 -COH + Cu + H2O
|
|
2. Уксусный
альдегид получают гидратацией ацетилена
по реакции Кучерова.

|
|
|
|
|
|
4. Альдегиды
получают гидролизом дигалогенопроизводных
углеводородов, однако только тех, у
которых оба атома галогена расположены
у одного из концевых атомов углерода.
CH3–CH2–
|
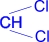
|
+
2H2O = [CH3–CH2–
|

|
+
2HCl
|
1,1-
дихлорпропан
|
1,1-пропандиол
|
|
|
|
|
|
|
Простейший
альдегид – муравьиный – газ с
весьма резким запахом. Другие низшие
альдегиды – жидкости, хорошо растворимые
в воде. Альдегиды кипят при более
низкой температуре, чем спирты с тем
же числом углеродных атомов. Это cвязано
с отсутствием в альдегидах водородных
связей. В то же время температура
кипения альдегидов выше, чем у
соответствующих по молекулярной массе
углеводородов, что связано с высокой
полярностью альдегидов.
Химические
свойства и применение альдегидов
1) Альдегиды
медленно окисляются кислородом воздуха
в карбоновые кислоты:

2) Качественная
реакция на альдегиды – реакция
«серебряного зеркала».

3)Восстановление
гидроксида меди(II) в оксид меди(I) –
другая характерная реакция альдегидов.
При нагревании голубого осадка
Cu(OH)2 в смеси с альдегидом наблюдается
исчезновение голубой окраски и
образование красного осадка Cu2O:

4) Альдегиды
присоединяют водород Н2 по двойной
связи С=О при нагревании в присутствии
катализатора (Ni, Pt, Pd). Реакция
сопровождается разрывом  -связи
в карбонильной группе С=О и присоединением
по месту ее разрыва двух атомов Н
молекулы водорода Н–Н. Таким образом
из альдегидов получают спирты:
-связи
в карбонильной группе С=О и присоединением
по месту ее разрыва двух атомов Н
молекулы водорода Н–Н. Таким образом
из альдегидов получают спирты:

6) Реакция альдегидов
со спиртами. R-CHO
+ 2ROH  R-CH(OH)-OR полуацеталь
R-CH(OH)-OR полуацеталь
В
избытке спирта при наличии каталитических
количеств кислоты происходит дальнейшее
нуклеофильное замещение ОН-группы
полуацеталя остатком спирта с
образованием ацеталя:
R-CH(OH)-OR
+ ROH
R-CH(OR)2 +
H2O.
Применение
альдегидов
1)взаимодействие
с фенолом. Реакция поликонденсации.
Получение фенолформальдегидной смолы

 Формалин
(40%-й водный раствор формальдегида)
применяется в качестве антисептика(обеззараживающего
средства).
Формалин
(40%-й водный раствор формальдегида)
применяется в качестве антисептика(обеззараживающего
средства).
Ацетальдегид
СН3СНО – бесцветная жидкость (tкип =
21 °С) с резким запахом, хорошо
растворимая в воде. Главное использование
ацетальдегида – получение уксусной
кислоты.
Карбоновые
кислоты
Органические
вещества, молекулы которых содержат
одну или несколько карбоксильных
групп.
Карбоксильная
группа 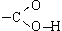 (сокращенно
—COOH) - функциональная группа карбоновых
кислот - состоит из карбонильной группы
и связанной с ней гидроксильной
группы.
По числу карбоксильных
групп карбоновые кислоты делятся на
одноосновные, двухосновные и т.д.
Общая
формула одноосновных карбоновых
кислот R—COOH. Пример двухосновной
кислоты - щавелевая кислота HOOC—COOH.
По
типу радикала карбоновые кислоты
делятся на предельные (например,
уксусная кислота CH3COOH), непредельные
[например, акриловая кислота CH2=CH—COOH,
олеиновая CH3—(CH2)7—CH=CH—(CH2)7—COOH] и
ароматические (например, бензойнаяC6H5—COOH).
(сокращенно
—COOH) - функциональная группа карбоновых
кислот - состоит из карбонильной группы
и связанной с ней гидроксильной
группы.
По числу карбоксильных
групп карбоновые кислоты делятся на
одноосновные, двухосновные и т.д.
Общая
формула одноосновных карбоновых
кислот R—COOH. Пример двухосновной
кислоты - щавелевая кислота HOOC—COOH.
По
типу радикала карбоновые кислоты
делятся на предельные (например,
уксусная кислота CH3COOH), непредельные
[например, акриловая кислота CH2=CH—COOH,
олеиновая CH3—(CH2)7—CH=CH—(CH2)7—COOH] и
ароматические (например, бензойнаяC6H5—COOH).
Изомеры
и гомологи
Одноосновные
предельные карбоновые кислоты R—COOH
являются изомерами сложных
эфиров  (сокращенно
R'—COOR'') с тем же числом атомов углерода.
Общая формула и тех, и других CnH2nO2.
(сокращенно
R'—COOR'') с тем же числом атомов углерода.
Общая формула и тех, и других CnH2nO2.
Химические
свойства карбоновых кислот
Карбоновые
кислоты проявляют высокую реакционную
способность. Они вступают в реакции
с различными веществами и образуют
разнообразные соединения, среди
которых большое значение
имеют функциональные производные,
т.е. соединения, полученные в результате
реакций по карбоксильной группе.

Названия
солей составляют из названий остатка
RCOO– (карбоксилат-иона) и металла.
Например, CH3COONa – ацетат натрия,
(HCOO)2Ca – формиат кальция, C17H35COOK –
стеарат калия и т.п.
I. Общие
с другими кислотами
1.
Диссоциация: R-COOH ↔ RCOO- + H+
-Сила
кислот уменьшается в ряду:
H-COOH
> CH3-COOH > CH3-CH2-COOH
Карбоновые
кислоты - слабые электролиты
2.
Взаимодействие с активными
металлами: 2R-COOH + 2Na → 2R-COONa + H2↑
3.
Взаимодействие с основными оксидами
и основаниями:
2R-COOH
+ CaO → (R-COO)2Ca + H2O R-COOH + NaOH → R-COONa +
H2O
4.
Взаимодействие с солями слабых
кислот:
R-COOH
+ NaHCO3 → R-COONa + H2O + CO2↑
В
водных растворах гидролизуются:
R-COONa + H2O ↔ R-COOH + NaOH
5.
Образование сложных эфиров со
спиртами: реакция этерификации
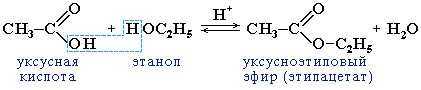
II. Специфические
свойства
1.
Образование функциональных
производных R-CO-X (свойства
гидроксильной группы)
Получение хлорангидридов:
R-COOH
+ PCl5 → R-CO-Cl + POCl3 + HCl
2.
Образование амидов
CH3COOH
+ NH3→CH3COONH4 t˚C→ CH3CONH2 + H2O
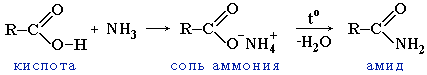
Вместо
карбоновых кислот чаще используют
их галогенангидриды:
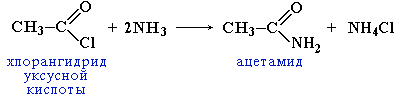
Амиды
образуются также при взаимодействии
карбоновых кислот (их галогенангидридов
или ангидридов) с органическими
производными аммиака (аминами):
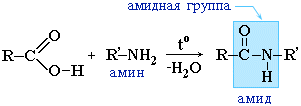
Амиды
играют важную роль в природе. Молекулы
природных пептидов и белков построены
из a-аминокислот с участием амидных
групп - пептидных связей
3.
Реакции замещения с галогенами
(свойства
углеводородного радикала, образуется
а-хлорпроизводное карбоновой
кислоты ):

4.
Особенности муравьиной кислоты H-COOH:
· Даёт
реакцию «Серебряного зеркала»:
H-COOH
+ 2[Ag(NH3)2]OH
→ 2Ag↓
+ (NH4)2CO3 +
2NH3 +
H2O
· Окисление
хлором:H-COOH + Cl2 → CO2 + 2HCl
· Вступает
в реакцию с гидроксидом меди(II):
H-COOH
+ 2Cu(OH)2 t → Cu2O↓ + CO2↑ + 3H2O
· Разлагается
при нагревании: HCOOH t,H2SO4→ CO↑
+ H2O
5.
Реакции декарбоксилирования солей
карбоновых кислот (получение
алканов):
R-COONa
+ NaOH t → Na2CO3 + R-H (алкан)
6.
Окисление в атмосфере кислорода
R-COOH + O2 → CO2 + H2O
Жиры –
сложные эфиры глицерина и высших
карбоновых кислот. Общее
название таких соединений –
триглицериды.
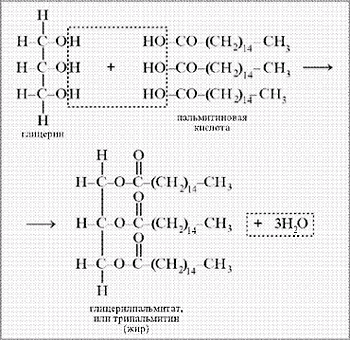
Общая
формула жиров (триглицеридов)

Животные
жиры содержат главным образом
глицериды предельных кислот и
являются твердыми веществами.
Растительные жиры, часто называемые
маслами, содержат глицериды
непредельных карбоновых кислот.
Это, например, жидкие подсолнечное,
конопляное и льняное масла.

Природные
жиры содержат следующие жирные
кислоты
Насыщенные:
стеариновая (C17H35COOH)
пальмитиновая (C15H31COOH)
Масляная
(C3H7COOH)
|
В
СОСТАВЕ
ЖИВОТНЫХ
ЖИРОВ
|
Ненасыщенные:
олеиновая (C17H33COOH, 1 двойная
связь)
линолевая (C17H31COOH, 2 двойные
связи)
линоленовая (C17H29COOH, 3 двойные
связи)
арахидоновая (C19H31COOH,
4 двойные связи, реже встречается)
|
В
СОСТАВЕ
РАСТИТЕЛЬНЫХ
ЖИРОВ
|
Жиры
содержатся во всех растениях и
животных. Они представляют собой
смеси полных сложных эфиров глицерина
и не имеют чётко выраженной температуры
плавления.
Химические
свойства жиров
1. Гидролиз, или омыление,
жиров происходит под действием
воды, с участием ферментов или
кислотных катализаторов (обратимо)
, при этом образуются спирт -
глицерин и смесь карбоновых кислот:

или
щелочей (необратимо). При щелочном
гидролизе образуются соли высших
жирных кислот, называемые мылами. Мыла
получаются при гидролизе жиров в
присутствии щелочей:

Мыла
— это калиевые и натриевые соли
высших карбоновых кислот.
2.Гидрирование
жиров – превращение жидких
растительных масел в твердые жиры
– имеет большое значение для пищевых
целей. Продукт гидрогенизации
масел – твердый жир (искусственное
сало, саломас). Маргарин –
пищевой жир, состоит из смеси
гидрогенизированных масел
(подсолнечного, кукурузного, хлопкого
и др.), животных жиров, молока и
вкусовых добавок (соли, сахара,
витаминов и др.).
Так
в промышленности получают маргарин:
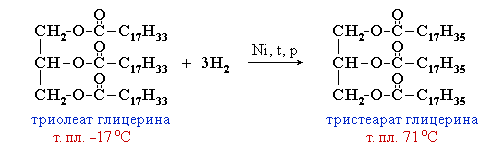

Реакция
получения жиров (этерификация)

Мыло –
щелочная соль высших карбоновых
кислот. Жидкое мыло образовано солями
калия. а твердое мыло – солями натрия.
Углеводы

Моносахариды (простые
углеводы) – углеводы, которые не
гидролизуются. В зависимости от
числа атомов углерода подразделяются
на триозы, тетрозы, пентозы, гексозы.
Для человека наиболее важны глюкоза,
фруктоза, галактоза, рибоза,
дезоксирибоза.
Дисахариды –
углеводы, которые гидролизуются с
образованием двух молекул моносахаридов.
Наиболее важны для человека сахароза,
мальтоза и лактоза.
Полисахариды –
высокомолекулярные соединения
(крахмал,целлюлоза)– углеводы,
которые гидролизуются с образованием
множества молекул моносахаридов.
Углеводы часто называют сахаристыми
веществами или сахарами.
Получение.
В промышленности
Гидролиз крахмала
(C6H10O5)n +
nH2O t,H+→ nC6H12O6
крахмал глюкоза
В
лаборатории
6 HCOH → C6H12O6
формальдегид
6CO2 +
6H2O hν, хлорофилл → C6H12O6 +
6O2
C12H22O11 +
H2O t,H+→ 2 C6H12O6
мальтоза
глюкоза
C12H22O11 +
H2O t,→ C6H12O6 + C6H12O6
сахароза глюкоза фруктоза
Молекулярная
формула глюкозы С6Н12О6

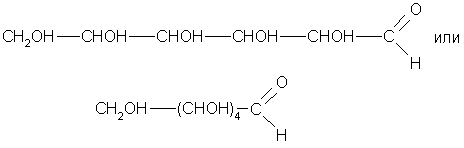
Глюкоза
– альдегидоспирт, точнее – многоатомный
альдегидоспирт.
В растворе глюкозы
находится альдегидная форма и
молекулы циклического строения.
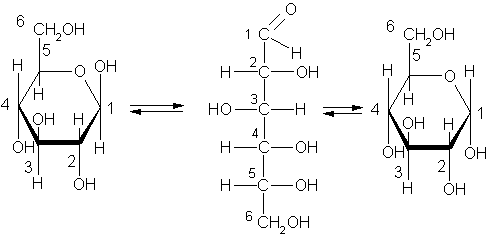
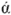
Химические
свойства глюкозы
I. Специфические
свойства-реакции брожения :
1.Спиртовое
брожение:C6H12O6 → 2C2H5-OH + 2CO2↑
2.
Молочнокислое брожение:

3. Маслянокислое брожение: C6H12O6 →
C3H7COOH + 2H2 ↑+ 2CO2↑
II.
Свойства альдегидов
1.
Реакция серебряного зеркала:
СH2OH(CHOH)4-COH + 2[Ag(NH3)2]OH → СH2OH(CHOH)4-COONH4 +
2Ag↓+ 3NH3 + H2O
СH2OH(CHOH)4-COOH
- глюконовая кислота
2.
Окисление гидроксидом меди (II):
СH2OH(CHOH)4-COH +
2Cu(OH)2 t → СH2OH(CHOH)4-COOH + Cu2O +
2H2O
голубой
красный
3.
Восстановление:
СH2OH(CHOH)4-COH
+ H2 t,Ni → СH2OH(CHOH)4-CH2OH
сорбит
– шестиатомный спирт
III.
Свойства многоатомных спиртов
1.
Образование простых эфиров со
спиртами

α -
глюкоза
|
+
СH3ОН
|
→
|
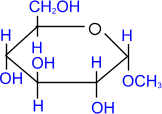
|
+
H2О
|
2.
Качественная реакция многоатомных
спиртов. Глюкоза растворяет гидроксид
меди (II) и ведет себя как многоатомный
спирт, образуя комплексное соединение
– ярко синего цвета.

3.Горение
C6H12O6 + 6O2 → 6H2O + 6CO2 +
2800 кДж
Азотсодержащие органические
соединения
1.
Нитросоединения.Азот может входить
в органические соединения в виде
нитрогруппы NO2.Нитросоединения получают
при прямом нитровании предельных
углеводородов азотной кислотой или
при нитровании ароматических
углеводородов азотной кислотой в
присутствии серной кислоты

Амины -органические
производные аммиака.
Амины
могут быть первичными R –
NH2, вторичными RR'NH и третичнымиRR'R"
N, в зависимости от числа атомов
водорода, которые замещены на радикалы
R, R', R". Например, первичный амин
— этиламин C2H5NH2, вторичный амин
— дижетиламин(CH3)2NH, третичный
амин – триэтиламин (C2H5)3N.
Основность
аминов Алифатические
амины – более
сильные основания, чем аммиак, т.к.
алкильные радикалы увеличивают
электронную плотность на атоме азота
за счет +I-эффекта.
По этой причине электронная пара
атома азота удерживается менее
прочно и легче взаимодействует с
протоном.
Ароматические
амины являются
более слабыми основаниями, чем
аммиак, поскольку неподеленная
электронная пара атома азота смещается
в сторону бензольного кольца, вступая
в сопряжение с его π-электронами.
Ряд
увеличения основных свойств аминов:
C6H5-NH2 <
NH3 < R3N
< R-NH2 <
R2NH
-------------------------------------------------→
возрастание
основных свойств
|
Амины,
как и аммиак, проявляют основные
свойства, они в водном растворе
гидратируются и диссоциируют как
слабые основания:

а
с кислотами образуют соли:
 Третичные
амины присоединяют галогенпроизводные
с образованием солей четырехзамещенного
аммония:
Третичные
амины присоединяют галогенпроизводные
с образованием солей четырехзамещенного
аммония:
 Ароматические
ажины (в которых аминогруппа
связана непосредственно с бензольным
кольцом) являются более слабыми
основаниями, чем алкиламины, из-за
взаимодействия неподеленной пары
электронов атома азота с ?-электронами
бензольного кольца. Аминогруппа
облегчает замещение водорода в
бензольном кольце, например на бром;
из анилина образуется 2,4,6-триброманилин:
Ароматические
ажины (в которых аминогруппа
связана непосредственно с бензольным
кольцом) являются более слабыми
основаниями, чем алкиламины, из-за
взаимодействия неподеленной пары
электронов атома азота с ?-электронами
бензольного кольца. Аминогруппа
облегчает замещение водорода в
бензольном кольце, например на бром;
из анилина образуется 2,4,6-триброманилин:

Получение: восстановление
нитросоединений с помощью атомарного
водорода (получают либо непосредственно
в сосуде по реакции Fe + 2НCl = FeCl2 +
2Н0, либо при пропускании водорода
Н2 над никелевым катализатором
Н2 = 2Н0) приводит к синтезупервичных аминов:
a) реакция
Зинина

Амины
используются в производстве
растворителей для полимеров,
лекарственных препаратов, кормовых
добавок, удобрений, красителей. Очень
ядовиты, особенно анилин (желто-коричневая
жидкость, всасывается в организм
даже через кожу).
Аминокислоты.
Белки
Аминокислоты –
органические соединения, содержащие
в своем составе две функциональные
группы – кислотную СООН и
аминную NH2; являются основой
белковых веществ.
Примеры:

Аминокислоты
проявляют свойства и кислот, и аминов.
Так, они образуют соли (за счет
кислотных свойств карбоксильной
группы):

и
сложные эфиры (подобно другим
органическим кислотам):

С
более сильными (неорганическими)
кислотами они проявляют свойства
оснований и образуют соли за счет
основных свойств аминогруппы:

Поэтому
глицин в реакции со щелочами переходит
в глицинат-ион, а с кислотами – в
катион глициния, равновесие смещается
соответственно в сторону образования
анионов или катионов.
Белки –
органические природные соединения;
представляют собой биополимеры,
построенные из остатков аминокислот.
В молекулах белков азот присутствует
в виде амидогруппы – С(О) – NH– (так
называемая пептидная связь С
– N). Белки обязательно содержат С,
Н, N, О, почти всегда S, часто Р .
При
гидролизе белков получают смесь
аминокислот, например:

По
числу остатков аминокислот в молекуле
белка различают дипептиды (приведенный
выше глицилаланин), трипептиды и
т. д. Природные белки (протеины)
содержат от 100 до 1 105 остатков
аминокислот.Образование макромолекул
протеинов (биополимеров), т. е.
связывание молекул аминокислот в
длинные цепи, происходит при участии
группы СООН одной молекулы и группы
NH2 другой молекулы:
 пептидная
(амидная связь)
пептидная
(амидная связь)
Цветные
реакции на белки
1)Биуретовая
реакция (обнаружение в белках
пептидных связей)
Эта
реакция обусловлена наличием в
белковой молекуле пептидных связей,
возникающих при взаимодействии
молекул аминокислот.

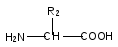

В
результате взаимодействия ионов
двухвалентной меди с пептидными
связями в щелочной среде образуется
комплексное соединение, окрашенное
в красно-фиолетовый цвет.
2) Ксантопротеиновая
реакция
Эта
реакция основана на образовании
нитропроизводных ароматических
аминокислот (фенилаланин, тирозин,
триптофан). Нитропроизводные имеют
желтую окраску в кислой среде и
оранжевую – в нейтральной и щелочных
средах (ксантос –
по-гречески – желтый).
|

|













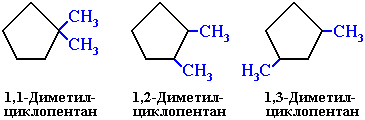





 Это
качественная реакция алкенов –
бромная вода Br2 (бурая жидкость)
обесцвечивается.
Это
качественная реакция алкенов –
бромная вода Br2 (бурая жидкость)
обесцвечивается.




 Sp3-гибридизация
Sp3-гибридизация




 Существенным
является расположение галогенов в
молекуле дигалогенида. Так, например,
в случае 2,3-дибромбутана или
2,2-ди-бромпропана образуются
соответствующие алкины .
Химические
свойства
Существенным
является расположение галогенов в
молекуле дигалогенида. Так, например,
в случае 2,3-дибромбутана или
2,2-ди-бромпропана образуются
соответствующие алкины .
Химические
свойства
 Арены-
производные бензолаС 6Н 6
С nН 2n- 6(при
n >= 6).
sр 2-гибридизация
Арены-
производные бензолаС 6Н 6
С nН 2n- 6(при
n >= 6).
sр 2-гибридизация






 Полистирол–
термопластичная пластмасса (термопласт),
. Используется для изготовления
изоляции электропроводов, посуды
разового употребления, упаковочной
массы (пенопласт).
Полистирол–
термопластичная пластмасса (термопласт),
. Используется для изготовления
изоляции электропроводов, посуды
разового употребления, упаковочной
массы (пенопласт).




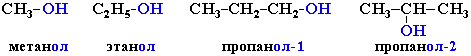


 Из
электронной формулы видно, что
кислород в молекуле спирта имеет
две неподеленные электронные
пары. Свойства спиртов и фенолов
определяются строением гидроксильной
группы, характером ее химических
связей, строением углеводородных
радикалов и их взаимным влиянием.
Из
электронной формулы видно, что
кислород в молекуле спирта имеет
две неподеленные электронные
пары. Свойства спиртов и фенолов
определяются строением гидроксильной
группы, характером ее химических
связей, строением углеводородных
радикалов и их взаимным влиянием.





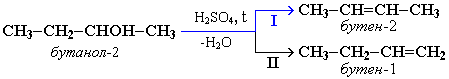

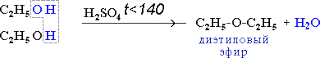












 Поэтому
фенол значительно активнее бензола
вступает в реакции электрофильного
замещения в ароматическом
кольце.Нитрование. Под действием
20% азотной кислоты HNO3 фенол легко
превращается в смесь орто- и пара-нитрофенолов:
Поэтому
фенол значительно активнее бензола
вступает в реакции электрофильного
замещения в ароматическом
кольце.Нитрование. Под действием
20% азотной кислоты HNO3 фенол легко
превращается в смесь орто- и пара-нитрофенолов:











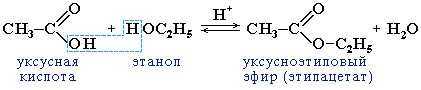
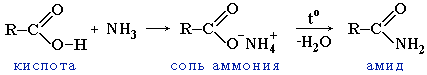
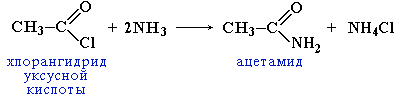
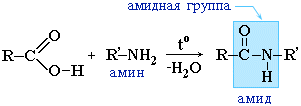






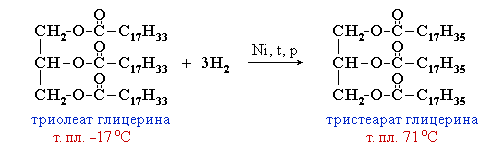












 Третичные
амины присоединяют галогенпроизводные
с образованием солей четырехзамещенного
аммония:
Третичные
амины присоединяют галогенпроизводные
с образованием солей четырехзамещенного
аммония: Ароматические
ажины (в которых аминогруппа
связана непосредственно с бензольным
кольцом) являются более слабыми
основаниями, чем алкиламины, из-за
взаимодействия неподеленной пары
электронов атома азота с ?-электронами
бензольного кольца. Аминогруппа
облегчает замещение водорода в
бензольном кольце, например на бром;
из анилина образуется 2,4,6-триброманилин:
Ароматические
ажины (в которых аминогруппа
связана непосредственно с бензольным
кольцом) являются более слабыми
основаниями, чем алкиламины, из-за
взаимодействия неподеленной пары
электронов атома азота с ?-электронами
бензольного кольца. Аминогруппа
облегчает замещение водорода в
бензольном кольце, например на бром;
из анилина образуется 2,4,6-триброманилин:




 пептидная
(амидная связь)
пептидная
(амидная связь)
