
- •Строение альдегидов и кетонов.
- •Номенклатура альдегидов и кетонов.
- •Номенклатура альдегидов и кетонов.
- •2. Углеводы. Классификация и номенклатура. Строение, конфигурация и конформация.
- •5. Алкины. Реакции алкинов. Сн-кислотность. Ацетилениды, строение и свойства. Реакции электрофильного и нуклеофильного присоединения, их механизмы. Окисление, восстановление, гидрирование алкинов.
- •6. Галогенпроизводные углеводородов. Реакции нуклеофильного замещения и отщепления. Ароматические галогенпроизводные.
- •Реакции электрофильного замещения бензола.
1. Альдегиды и кетоны: строение, изомерия, номенклатура. Химические свойства. Основность. Реакции нуклеофильного присоединения. Восстановление до спиртов и углеводородов. Реакции ароматических альдегидов и кетонов с участием ароматического ядра.
Альдегиды и кетоны относятся к карбонильным органическим соединениям. Карбонильными соединениями называют органические вещества, в молекулах которых имеется группа >С=О (карбонил или оксогруппа).
Общая формула карбонильных соединений:
|
В зависимости от типа заместителя Х эти соединения подразделяют на: альдегиды (Х = Н ); кетоны ( Х = R, R' ); карбоновые кислоты ( Х = ОН ) и их производные (Х = ОR, NH2, NHR, Hal и т.д.).
Альдегиды - органические соединения, в молекулах которых атом углерода карбонильной группы (карбонильный углерод) связан с атомом водорода. Общая формула: R–CН=O или
|
R = H, алкил, арил |
Функциональная группа –СН=О называется альдегидной. Кетоны - органические вещества, молекулы которых содержат карбонильную группу, соединенную с двумя углеводородными радикалами. Общие формулы: R2C=O, R–CO–R' или
|
R, R' = алкил, арил |
|
Строение альдегидов и кетонов.
Свойства альдегидов и кетонов определяются строением карбонильной группы >C=O.
Атомы углерода и кислорода в карбонильной группе находятся в состоянии sp2-гибридизации. Углерод своими sp2-гибридными орбиталями образует 3s-связи (одна из них - связь С–О), которые располагаются в одной плоскости под углом около 120° друг к другу. Одна из трех sp2-орбиталей кислорода участвует в s-связи С–О, две другие содержат неподеленнные электронные пары. p-Связь образована р-электронами атомов углерода и кислорода. |
Связь С=О сильно полярна. Ее дипольный момент (2,6-2,8D) значительно выше, чем у связи С–О в спиртах (0,70D). Электроны кратной связи С=О, в особенности более подвижные p-электроны, смещены к электроотрицательному атому кислорода, что приводит к появлению на нем частичного отрицательного заряда. Карбонильный углерод приобретает частичный положительный заряд.

Поэтому углерод подвергается атаке нуклеофильными реагентами, а кислород - электрофильными, в том числе Н+.
В молекулах альдегидов и кетонов отсутствуют атомы водорода, способные к образованию водородных связей. Поэтому их температуры кипения ниже, чем у соответствующих спиртов. Метаналь (формальдегид) - газ, альдегиды С2–C5 и кетоны С3–С4 - жидкости, высшие - твердые вещества. Низшие гомологи растворимы в воде, благодаря образованию водородных связей между атомами водорода молекул воды и карбонильными атомами кислорода. С увеличением углеводородного радикала растворимость в воде падает.
Номенклатура альдегидов и кетонов.
Систематические названия альдегидов строят по названию соответствующего углеводорода и добавлением суффикса -аль. Нумерацию цепи начинают с карбонильного атома углерода. Тривиальные названия производят от тривиальных названий тех кислот, в которые альдегиды превращаются при окислении.
Формула |
Название |
|
систематическое |
тривиальное |
|
H2C=O |
метаналь |
муравьиный альдегид (формальдегид) |
CH3CH=O |
этаналь |
уксусный альдегид (ацетальдегид) |
(CH3)2CHCH=O |
2-метил-пропаналь |
изомасляный альдегид |
CH3CH=CHCH=O |
бутен-2-аль |
кротоновый альдегид |
Систематические названия кетонов несложного строения производят от названий радикалов (в порядке увеличения) с добавлением слова кетон. Например: CH3–CO–CH3 - диметилкетон (ацетон);
CH3CH2CH2–CO–CH3 - метилпропилкетон.
В более общем случае название кетона строится по названию соответствующего углеводорода и суффикса -он; нумерацию цепи начинают от конца цепи, ближайшего к карбонильной группе (заместительная номенклатура ИЮПАК).
Примеры: CH3–CO–CH3 - пропанон (ацетон);
CH3CH2CH2–CO–CH3 - пентанон-2;
CH2=CH–CH2–CO–CH3 - пентен-4-он-2.
Номенклатура альдегидов и кетонов.
Для альдегидов и кетонов характерна структурная изомерия.
Изомерия альдегидов:
изомерия углеродного скелета, начиная с С4 |
|
межклассовая изомерия с кетонами, начиная с С3 |
|
циклическими оксидами (с С2) |
|
непредельными спиртами и простыми эфирами (с С3) |
|
Изомерия кетонов: углеродного скелета (c C5) |
|
положения карбонильной группы (c C5) |
|
межклассовая изомерия (аналогично альдегидам).
Реакции нуклеофильного присоединения.
Альдегиды и кетоны легко присоединяют нуклеофильные реагенты по С=О связи. Процесс начинается с атаки нуклеофила по карбонильному атому углерода. Затем образующийся на первой стадии тетраэдрический интермедиат присоединяет протон и дает продукт присоединения:

Активность карбонильных соединений в AdN–реакциях (реакции нуклеофильного присоединения) зависит от величины эффективного положительного заряда на карбонильном атоме углерода и объема заместителей у карбонильной группы. Электронодонорные и объемистые заместители затрудняют реакцию, электроноакцепторные заместители повышают реакционную способность карбонильного соединения. Поэтому альдегиды в AdN–реакциях активнее, чем кетоны.

Присоединение спиртов и тиолов.
Альдегиды присоединяют спирты с образованием полуацеталей. При избытке спирта и в присутствии кислотного катализатора реакция идет дальше – до образования ацеталей

Кетоны в аналогичных условиях кеталей не дают.
Тиолы как более сильные нуклеофилы, чем спирты, образуют продукты присоединения и с альдегидами, и с кетонами.

Присоединение синильной кислоты
Синильная кислота присоединяется к карбонильным соединением в условиях основного катализа с образованием циангидринов.

Присоединение бисульфита натрия.
Альдегиды и метилкетоны присоединяют бисульфит натрия NaHSO3 c образованием бисульфитных производных.
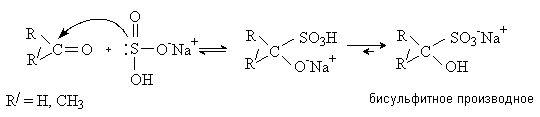
Присоединение воды.
Альдегиды и кетоны присоединяют воду с образованием гидратов. Реакция протекает обратимо. Образующиеся гидраты термодинамически не стабильны. Равновесие смещено в сторону продуктов присоединения только в случае активных карбонильных соединений.
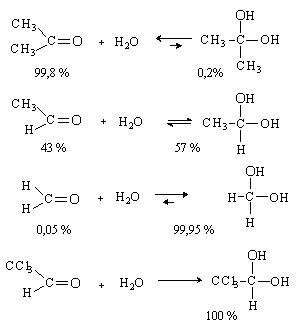
Реакции нуклеофильного присоединения азотистых оснований.
К этим реакциям относятся:
а) образование иминов (азометинов) – оснований Шиффа

б) образование оксимов

в) образование гидразонов

г) синтез семикарбазонов

Восстановление до спиртов и углеводородов.
Присоединение водорода к молекулам альдегидов происходит по двойной связи в карбонильной группе. Продуктом гидрирования альдегидов являются первичные спирты, кетонов - вторичные.

а) восстановление по Клемменсену.
Если карбонильное соединение устойчиво к действию кислот, то используют этот тип восстановления

б) восстановление по Кижнеру-Вольфу
Этот вид восстановления используется в тех случаях, когда объект восстановления устойчив к основаниям

Аммиачный раствор гидроксида серебра [Ag(NH3)2]OH при легком нагревании с альдегидами (но не с кетонами) окисляет их в кислоты с образованием свободного металлического серебра. Если пробирка, в которой идет реакция, была предварительно обезжирена изнутри, то серебро ложится тонким слоем на ее внутренней поверхности — образуется серебряное зеркало:
![]()

Кетоны в такие реакции не вступают. У них идет «жесткое окисление» — разрыв связи С-С
Реакция галогенирования. Альдегиды и кетоны легко вступают в реакции с галогенами с образованием а-галогенопроизводные:

Реакции ароматических альдегидов и кетонов с участием ароматического ядра.
Различают следующие типы карбонильных соединений аренов.

В реакции электрофильного замещения ароматические альдегиды вступают в соответствии с правилами ориентации. Альдегидная группа электроноакцепторная группа, она проявляет —I; —М-эффекты и относится к мета-ориентантам.
Например:

Нитрование ацетофенона легко осуществляется нитрующей смесью при температуре 00С:

м-нитроацетофенон









