
- •1.Электролиты. Растворы электролитов. Электролитическая диссоциация кислот оснований и солей. Константа диссоциации. Степень диссоциации.
- •2 .Ионное произведение воды. Водородный показатель среды, его расчет для сильных и слабых электролитов. Индикаторы.
- •3. Гидролиз солей.
- •4.Равновесие между ионами в растворе и твёрдой фазой .Произведение растворимости.
- •5.Образование простейших комплексов и растворах. Координационное число. Константа устойчивости.
- •6.Коллоидные растворы. Строение коллоидных растворов. Золи , гели и твёрдые коллоиды. Методы изучения коллоидных растворах. Свойства и применение коллоидных растворов.
- •7. Классификация и номенклатура неорганических соединений.
- •8.Свойства кислот, оснований и солей в свете теории электролитической диссоциации Арркниуса. Ионные уравнения реакций.
- •9. Оксид: классификация, получение, хим.Свойства.
- •10. Кислоты: классификация, получение, хим.Свойства.
- •11. Основания: классификация, получение, хим.Свойства. Щелочи.
- •12. Водород. Изотопы водорода. Соединения водорода с металлами и неметаллами. Вода, пероксид водорода.
- •13. Положение металлов в периодической системе химических элементов. Общее в строении атомов металлов. Металлическая связь. Применение металлов и их сплавов в авиации.
- •14. Общие способы получения металлов. Характерные химические свойства металлов. Электрохимический ряд напряжений металлов.
- •15. Коррозия металлов и ее виды. Защита металлов от коррозии.
- •16. Щелочные металлы: получение и химические свойства. Оксиды, пероксиды, гидроксиды и соли щелочных металлов.
- •17. Щелочноземельные металлы: получение и хим. Свойства. Их оксиды, гидроксиды, соли.
- •18. Щелочноземельные металлы: бериллий, магний, кальций. Жесткость воды и способы ее устранения.
- •19. Алюминий. Оксиды и гидроксиды алюминия. Применение алюминия и его сплавов.
- •20. Химия переходных металлов. Хром и его соединения.
- •21. Химия переходных металлов. Марганец и его соединения.
- •22. Химия переходных металлов. Железо и его соединения.
- •23. Химия переходных металлов. Медь и его соединения.
- •24. Химия переходных металлов. Цинк и его соединения.
- •25. Химия переходных металлов. Серебро и его соединения.
- •26. Галогены: характеристика, получение, химические свойства. Галогеноводороды. Галогениды. Кислородосодержащие соединения галогенов.
- •27. Подгруппа кислорода. Кислород, изотопы кислорода. Оксиды и пероксиды. Озон.
- •28. Подгруппа кислорода. Сера. Сероводород. Оксиды серы. Сернистая и серная кислоты и их соли.
- •29. Подгруппа азота. Азот. Амиак, соли аммнони, амиды металлов, нитриды. Оксиды азота.
- •30. Азотистая и азотная кислота и их соли. Эфиры азотной кислоты. Взаимодействие азотной кислоты с металлами и неметаллами.
- •31. Подгруппа азота. Фосфор. Оксиды фосфора и фосфорные кислоты.
- •32. Подгруппа углерода. Углерод и его свойства. Оксиды углерода. Угольная кислота и его соли. Карбиды: кальция, алюминия, железа.
- •34. Классификация органических соединений.
- •35. Номенклатура органических соединений (международная, рациональная, тривиальная). Правила названия веществ по систематической номенклатуре. Распределение функциональных групп по старшинству.
- •36. Изомерия органических соединений. Типы изомерии ( с примерами).
- •37. Классификация реагентов и реакций в органической химии.
- •39. Предельные углеводороды (алканы), их электронное и пространственное строение. Номенклатура и изомерия. Физические свойства. Важнейшие представители. Предельные углеводороды в природе.
- •40. Алканы. Получение и химические свойства.
- •41. Представление о циклоалканах. Получение химические свойства циклоалканах.
- •42. Этиленовые углеводороды (алкены), их электронное и пространственное строение. Номенклатура, изомерия, получение химические свойства алкенов. Правило Марковникова.
- •43. Диеновые углеводороды (алкадиены): особенности химических свойств сопряженных диенов. Важнейшие представители. Получение и применение в промышленности.
- •44. Ацетиленовые углеводороды, их электронное и пространственное строение, номенклатура.
- •45. Ароматические углеводороды (арены). Бензол, электронное и пространственное строение. Промышленное получение и применение бензола. Гомологи бензола.
- •46. Спирты первичные, вторичные, третичные. Номенклатура, строение, химические свойства и получение одноатомных спиртов. Промышленные методы синтеза этанола.
- •47. Классификация спиртов. Многоатомные спирты (этиленгликоль, глицерин), их особенности.
- •48. Простые эфиры: характеристика, получение, химические свойства. Сравнение их свойств со свойствами изомерных им спиртов.
- •1. Реакции с участием гидроксильной группы
- •2. Реакции с участием бензольного кольца
- •50. Альдегиды. Номенклатура, строение, физические и химические свойства. Особенности карбонильной группы. Муравьиный и уксусный альдегиды, получение, применение.
- •51. Кетоны: характеристика, получение, химические свойства. Ацетон.
- •52. Карбоновые кислоты. Номенклатура, строение, физические и химические свойства. Строение карбоксильной группы, взаимное влияние карбоксильной группы и углеводородного радикала.
- •56. Галогенпроизводные углеводородов: получение, химическиес свойства, применение. Важнейшие представители.
- •57. Амины: классификация и номенклатура. Получение, химические свойства, важнейшие представители.
- •58. Реакции полимеризации и поликонденсации. Важнейшие физико-химические свойства полимеров. Классификация полимерных соединений.
- •59. Пластические массы, их применение. Элементорганические полимерные соединения. Каучуки.
- •60. Химические волокна (искусственные, синтетические). Поверхностные покрытия и клеи.
1.Электролиты. Растворы электролитов. Электролитическая диссоциация кислот оснований и солей. Константа диссоциации. Степень диссоциации.
Электролиты – это вещества, растворы которых проводят электрический ток посредством ионов, на которые они распадаются под действием полярных молекул растворителя.
КЛАССИФИКАЦИЯ ЭЛЕКТРОЛИТОВ
Сильные Электролиты,
которые полностью диссоциируют в
растворе
|
Слабые Электролиты,
которые не диссоциируют полностью |
1) соли (NaCl, KCl, MgSO4, CH3COONa) |
1) соли (Hg2Cl2) |
2) щелочи (NaOH, KOH, Ca(OH)2) |
2) основания (NH3) |
3) кислоты (HNO3, H2SO4, HCl, HClO4) |
3) кислоты (H2CO3, H3BO3, CH3COOH, C6H5COOH) |
|
4) органические соединения (C6H4(OH)2 (гидрохинон), C6H5NH2 (анилин)) |
Раствор электролита – это раствор, который способен проводить электрический ток.
Доля молекул, распадающихся на ионы, оценивается степенью электролитической диссоциации, которую обычно обозначают α . Степень диссоциации – это отношение числа молекул, распавшихся на ионы, к числу молекул растворенного вещества. α= n/N
В зависимости от степени диссоциации различают электролиты сильные и слабые. Электролиты со степенью диссоциации больше 30% обычно называют сильными, со степенью диссоциации от 3 до 30% — средними, менее 3% — слабыми электролитами.
Более
точной характеристикой диссоциации
электролита является константа
диссоциации,
которая от концентрации раствора не
зависит. В общей реакции :
 , где комплекс
, где комплекс
 разбивается на x единиц A и y единиц B,
константа диссоциации определяется
так:
разбивается на x единиц A и y единиц B,
константа диссоциации определяется
так:

2 .Ионное произведение воды. Водородный показатель среды, его расчет для сильных и слабых электролитов. Индикаторы.
Вода является слабым электролитом и в незначительной степени диссоциирует на ионы по реакции;
Образуя в растворе ионы Н и ОН, вода является амфотерным электролитом.
Ионным
произведением воды:
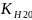 = [
= [ ]·[
]·[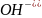 ]
]
При
температуре 25 = 1·
= 1· и остается постоянным в водных растворах
кислот, щелочей, солей или других
соединений.
и остается постоянным в водных растворах
кислот, щелочей, солей или других
соединений.
KН2О = [H+]·[OH—] = 1·10-14
При повышении температуры ионное произведение воды сильно возрастает.
Полученное выражение применимо не только к чистой воде, но и к растворам.
Если осуществляется условие [H+] = [OH—] , то раствор называется нейтральным, но обычно эти величины не совпадают, тогда при увеличении одного показателя, другой должен уменьшаться, так, чтобы их произведение оставалось постоянным (1·10-14).
Водородный показатель рН – это отрицательный десятичный логарифм концентрации ионов водорода РН = – lg [H+]
Гидроксильный показатель рОН – это отрицательный десятичный логарифм концентрациигидроксид – ионов
PОН = – lg[OH–]
Среда pH: Нейтральная----------
Кислая<7 (6,5,3)
Щелочная>7 (8,9,10)
рН+рОН=14
Формулы для расчета рH сильных и слабых электролитов.
1) кислота – сильный электролит рH=-lg[H+] ; [H+]=Cкислоты.
2)
кислота – слабый электролит. рH=-lg[H+]
;[H+]=

3)основание – сильный электролит рOH=-lg[OH-] ;[OH-]=C основания
рH=14-pOH
4) основание - слабый электролит
рOH=-lg[OH-];
[OH-]=
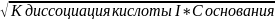
рH=14-pOH
Реакцию среды на практике можно определить при помощи кислотно-основных индикаторов, которые меняют свой цвет в зависимости от рН раствора. К наиболее распространенным относятся лакмус, фенолфталеин и метилоранж.
Индикаторы |
Цвет индикатора в средах |
||
В кислой |
В нейтральной |
В щелочной |
|
метилоранж |
красный |
Оранжевый |
Желтый |
фенолфталеин |
Бесцветный |
Бесцветный |
Малиновый |
лакмус |
красный |
фиолетовый |
синий |


