
- •Молекулярная физика Лекция 1. Основное уравнение молекулярно-кинетической теории идеального газа
- •Средняя кинетическая энергия и число степеней свободы
- •Лекция 4. Изопроцессы. Работа и теплоемкость в политропических процессах. Уравнение Ван-дер-Ваальса
- •Лекция 5. Элементы статистической физики. Распределение Максвелла
- •Лекция 6. Распределение молекул по энергиям. Распределение Больцмана. Барометрическая формула
- •Лекция 7. Явления переноса: теплопроводность, диффузия, вязкое трение
- •Лекции 8 -9. Второе начало термодинамики. Цикл Карно. Энтропия
- •Лекция 10. Состояния вещества. Фазовые перходы.
- •Лекция 11. Поверхностное натяжение. Явления на границе раздела фаз. Теплоемкость твердых тел.
Лекция 4. Изопроцессы. Работа и теплоемкость в политропических процессах. Уравнение Ван-дер-Ваальса
Адиабатический
процесс
– это процесс, происходящий без
теплообмена с окружающей средой. Поэтому
первое начало термодинамики (7) для него
будет выглядеть так:
 .
Подставим U
из (16):
.
Подставим U
из (16):
 ,
или
,
или
 ,
,
 ,
,
 .
.
Разделим
последнее выражение на
 ,
,
 ,
и преобразуем,
,
и преобразуем,
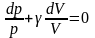 .
.
Левая часть – это сумма дифференциалов логарифмов,
 ,
,
 ,
,
 . (17)
. (17)
Э то
и есть уравнение
адиабаты,
называемое еще уравнением Пуассона.
Пользуясь уравнением состояния, уравнение
адиабаты можно представить в другом
виде:
то
и есть уравнение
адиабаты,
называемое еще уравнением Пуассона.
Пользуясь уравнением состояния, уравнение
адиабаты можно представить в другом
виде:
 .
.
В адиабатическом процессе молярная теплоемкость равна нулю, т.к. нет теплообмена. Из урав-
82
нения
 видно, что >1,
поэтому адиабата (кривая 2 на рис.6) идет
круче изотермы (pV=const,
кривая 1).
видно, что >1,
поэтому адиабата (кривая 2 на рис.6) идет
круче изотермы (pV=const,
кривая 1).
Политропические процессы. Так называются процессы, уравнение которых имеет вид:
 , (18)
, (18)
где
n
- любое число. Из этого определения
следует, что адиабатический процесс
является политропическим с показателем
политропы n
= .
Политропическими являются также
изохорический (
= ),
изобарический (р=
)
и изотермический (Т
=
)
процессы. Покажем, что в любом
политропическом процессе молярная
теплоемкость постоянна:
),
изобарический (р=
)
и изотермический (Т
=
)
процессы. Покажем, что в любом
политропическом процессе молярная
теплоемкость постоянна:
 .
Запишем по аналогии с адиабатическим
процессом уравнение политропы
(18) в форме
.
Запишем по аналогии с адиабатическим
процессом уравнение политропы
(18) в форме

и вычислим от него полный дифференциал:
 ,
,
 ,
,
 (14),
(14),
 =
.
=
.
 . (19)
. (19)
Подстановка
в эту формулу значения n
=1,
=1 (для
изотермического процесса) дает
 ;
83
;
83
для
адиабатического процесса n
=
, откуда
 ;
для процессов: изохорического
;
для процессов: изохорического
 ;
для изобарического
;
для изобарического
 .
Из (19) после подстановки
и
можно выразить показатель
политропы
через теплоемкости:
.
Из (19) после подстановки
и
можно выразить показатель
политропы
через теплоемкости:
 . (20)
. (20)
Работа газа при политропических процессах. В принципе работу газа в любом процессе принципиально можно вычислить по формуле (9). Однако во многих случаях работу удобнее вычислить с помощью I начала термодинамики:
 =
=
 =
=
 .
.
Подставляя
сюда
 (см. выше (19)), получим
(см. выше (19)), получим
 =
= .
.
Мы получили еще две формулы для работы в любом политропическом процессе:
 . (21)
. (21)
Последняя
формула неудобна только для изотермических
процессов, для которых вычислим работу
непосредственно из (9). Подставим в (9)
давление из уравнения состояния: :
:
 .
.
Таким образом, в изотермическом процессе при температуре Т и изменении объема от V1 до V2 совершается работа
84
 . (22)
. (22)
Внутренняя энергия и теплоемкость. Внутреннюю энергию можно выразить через число степеней свободы, если принять во внимание, что внутренняя энергия одного моля – это средняя энергия молекулы (5), умноженная на число Авогадро:
 . (23)
. (23)
С учетом (12) и (15) получим
 ;
;  . (24)
. (24)
Полученные выражения позволяют придать ещё один смысл постоянной адиабаты:
 . (25)
. (25)
 Уравнение
Ван-дер-Ваальса.
Модель идеального газа имеет область
применения, ограниченную не слишком
большими давлениями. По мере роста
давления наблюдаются все большие
отклонения от уравнения
Уравнение
Ван-дер-Ваальса.
Модель идеального газа имеет область
применения, ограниченную не слишком
большими давлениями. По мере роста
давления наблюдаются все большие
отклонения от уравнения
 .
Выделим две причины такого поведения.
.
Выделим две причины такого поведения.
1. Молекулы имеют собственный объем, который уже при 100 атм составляет более половины объема газа.
2. Взаимодействие между молекулами становится существенным: типичная кривая энергии взаимодействия между двумя молекулами в зависимости
85
от
расстояния между ними приведена на
рис.7. При r
< молекулы
отталкиваются, при r
>
притягиваются. Значит, по мере сближения
молекул количественно и качественно
меняется характер взаимодействия между
ними.
молекулы
отталкиваются, при r
>
притягиваются. Значит, по мере сближения
молекул количественно и качественно
меняется характер взаимодействия между
ними.
Это влияние можно учесть, введя поправки в уравнение состояния для идеальных газов, и тогда получится уравнение Ван-дер-Ваальса, которое принято записывать для одного моля:
 . (26)
. (26)
Постоянные
Ван-дер-Ваальса: а
и b
имеют для каждого газа свои значения.
Поправка в первой скобке,
 ,
обусловлена силами притяжения между
молекулами: при переходе к реальному
газу давление на стенки сосуда уменьшается,
его приходится искусственно «исправлять».
Поправка b
связана с уменьшением свободного объема
за счет собственного объема молекул.
,
обусловлена силами притяжения между
молекулами: при переходе к реальному
газу давление на стенки сосуда уменьшается,
его приходится искусственно «исправлять».
Поправка b
связана с уменьшением свободного объема
за счет собственного объема молекул.
