
- •Молекулярная физика Лекция 1. Основное уравнение молекулярно-кинетической теории идеального газа
- •Средняя кинетическая энергия и число степеней свободы
- •Лекция 4. Изопроцессы. Работа и теплоемкость в политропических процессах. Уравнение Ван-дер-Ваальса
- •Лекция 5. Элементы статистической физики. Распределение Максвелла
- •Лекция 6. Распределение молекул по энергиям. Распределение Больцмана. Барометрическая формула
- •Лекция 7. Явления переноса: теплопроводность, диффузия, вязкое трение
- •Лекции 8 -9. Второе начало термодинамики. Цикл Карно. Энтропия
- •Лекция 10. Состояния вещества. Фазовые перходы.
- •Лекция 11. Поверхностное натяжение. Явления на границе раздела фаз. Теплоемкость твердых тел.
Молекулярная физика Лекция 1. Основное уравнение молекулярно-кинетической теории идеального газа
Молекулярная физика – это часть курса общей физики, в которой изучают свойства систем, исходя из молекулярно-кинетической теории. Согласно этой теории все тела состоят из огромного количества молекул (или атомов), находящихся в непрерывном хаотическом тепловом движении. Поведение систем, состоящих из очень большого количества частиц (макросистем), описываются с помощью вероятностных методов, позволяющих перейти к параметрам, характеризующим макроскопические свойства, исходя из коллективного поведения составляющих системы частиц и на основе молекулярно-кинетической теории. Термодинамический подход, когда система описывается параметрами состояния (объем, давление, температура и.т.д.) и статистический подход, говорящий на языке функций распределения и средних значений величин, взаимно дополняют друг друга. Молекулярно-кинетическая теория достигла особенно больших успехов применительно к газам.
 Давление
газа на стенки сосуда.
Основное уравнение кинетической теории
газов.
Будем считать молекулы газа одинаковыми
упругими шариками, которые большую
часть времени не взаимодействуют друг
с другом. Кратковременные взаимодействия
сводятся к столкновениям, происходящим
по законам упругого удара. Эта модель
называется идеальным
газом. На
первом этапе будем считать, что молекулы
пробегают от одной стенки сосуда до
другой прямолинейно, перпендикулярно
стенке и без столкновений между собой.
Определим давление как модуль средней
силы, действующей нормально к поверхности,
отнесенный к площади этой поверхности:
Давление
газа на стенки сосуда.
Основное уравнение кинетической теории
газов.
Будем считать молекулы газа одинаковыми
упругими шариками, которые большую
часть времени не взаимодействуют друг
с другом. Кратковременные взаимодействия
сводятся к столкновениям, происходящим
по законам упругого удара. Эта модель
называется идеальным
газом. На
первом этапе будем считать, что молекулы
пробегают от одной стенки сосуда до
другой прямолинейно, перпендикулярно
стенке и без столкновений между собой.
Определим давление как модуль средней
силы, действующей нормально к поверхности,
отнесенный к площади этой поверхности:
 .
.
71
Пусть
газ находится в сосуде кубической формы
с ребром l
(рис.1). Молекула массы m,
движущаяся со скоростью
 к левой стенке, при упругом соударении
со стенкой получит приращение проекции
импульса
к левой стенке, при упругом соударении
со стенкой получит приращение проекции
импульса
 ,
затем отразится от правой стенки и
полетит обратно. Время τ
между двумя последовательными соударениями
с левой стенкой τ=
,
затем отразится от правой стенки и
полетит обратно. Время τ
между двумя последовательными соударениями
с левой стенкой τ= .
За время Δt
число соударений о левую стенку равно
.
За время Δt
число соударений о левую стенку равно
 =
=
 ,
,
а приращение импульса равно
 =
=
 .
.
Пусть
n1
молекул в единице объема движутся со
скоростью
 ,
n2
молекул движутся со скоростью
,
n2
молекул движутся со скоростью
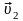 ,
и т.д. Очевидно, что из n1
молекул одна треть, т.е.
,
и т.д. Очевидно, что из n1
молекул одна треть, т.е. молекул, движутся вдоль оси х,
и по стольку же вдоль осей y
и z.
Всего молекул, движущихся в одном из
трех направлений, будет
молекул, движутся вдоль оси х,
и по стольку же вдоль осей y
и z.
Всего молекул, движущихся в одном из
трех направлений, будет
 ,
где
,
где
 -
объем сосуда. За время Δt
вследствие столкновений с левой стенкой
эти молекулы получат суммарное приращение
проекции импульса, равное
-
объем сосуда. За время Δt
вследствие столкновений с левой стенкой
эти молекулы получат суммарное приращение
проекции импульса, равное
 =
=
 .
.
По
второму закону Ньютона
 ,
давление на левую стенку со стороны
этих
молекул равно
,
давление на левую стенку со стороны
этих
молекул равно
72
 =
=
 ,
,
 .
.
Аналогично
 молекул (со скоростями
)
создадут давление
молекул (со скоростями
)
создадут давление
 и т.д. Давление, производимое всеми
молекулами на левую стенку равно:
и т.д. Давление, производимое всеми
молекулами на левую стенку равно:
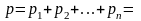 +
+ +…+
+…+ =
=
=
= .
.
Последняя
сумма представляет собой сумму квадратов
всех скоростей в единице объема. Разделив
её на концентрацию n
( ),
мы получим средний квадрат скорости:
),
мы получим средний квадрат скорости:
 .
.
Поэтому
давление
 =
= .
Перепишем это уравнение
.
Перепишем это уравнение
 ,
,
 . (1)
. (1)
Это и есть основное уравнение кинетической теории газов: давление газа равно двум третям средней кинетической энергии поступательного движения молекул в единице объема газа.
73
Лекция 2. Уравнение состояния идеального газа.
