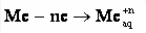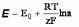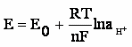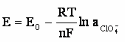- •2. Сущность потенциометрич. Ма. Механизм возникновения потенциала на границе металл-раствор и др. Межфазовых границах. Условие Гуггенгейма. Уравнение Нернста.
- •3. Понятия электродного потенциала и э.Д.С. Гальванич.Ячейки. Водородная шкала потенциалов. Схематическое изображение электродов и гальванич. Ячеек. Правила знаков э.Д.С. И электродных потенциалов.
- •4. Вторичн.Электроды сравнения: устр-во и особенности функционирования. Диффузионный потенциал и способы его устранения.
- •5. Ионно-металлические и Red-Ox электроды: механизм функционирования, важнейшие представители, применение в анализе.
- •6. Классификация мембранных (исэ) электродов по типам мембран и электродноактивных веществ. Устройство, принцип функционирования и основные представители.
- •7. Основные хар-ки исэ: коэффициенты селективности нижний и верхний пределы обнаружения и методы их определения.
- •10. Электроды на основе жидких ионообменниках: устр-во, механизм функц-ния и важнейшие представители. Факторы, определяющие селективность и пределы функционирования. Примеры применения в анализе.
- •12. Сложные устр-ва на основе исэ: газовые селективные электроды, ферментные электроды, ионселективные полевые транзисторы.
- •13. Основные варианты метода прямой потенциометрии: м-д градуир. Графика, м-д ограничивающих растворов, м-д стандартного раствора, метод добавок. Их достоинства и недостатки.
- •20. Количественный полярографический анализ. Уравнение Ильковича.
- •22. Твердые микроэлектроды и их применение в полярографии, достоинства и недостатки по сравнению с ртутным капельным электродом.
- •24. Сущность амперометрическ. Титрования. Типы кривых амперометрическ. Титрования.
- •25. Кондуктометрия и кондуктометр. Титрование и их аналитич. Применение.
Егоров
1. Хар-ка основных типов электрохимич.ячеек (элктролитич.ячейка, гальва- нический элемент) и их использование в электрохимич. МА.
2. Сущность потенциометрич. МА. Механизм возникновения потенциала на границе металл-раствор и др. межфазовых границах. Условие Гуггенгейма. Уравнение Нернста.
3. Понятия электродного потенциала и э.д.с. гальванич.ячейки. Водородная шкала потенциалов. Схематическое изображение электродов и гальванич. ячеек. Правила знаков э.д.с. и электродных потенциалов.
4. Вторичн.электроды сравнения: устр-во и особенности функционирования. Диффузионный потенциал и способы его устранения.
5. Ионно-металлические и Red-Ox электроды: механизм функционирования, важнейшие представители, применение в анализе.
6. Классификация мембранных (ИСЭ) электродов по типам мембран и электродноактивных веществ. Устройство, принцип функционирования и основные представители.
7. Основные хар-ки ИСЭ: коэффициенты селективности нижний и верхний пределы обнаружения и методы их определения.
8. Стеклянные электроды для pH-метрии и определения ионов щелочных металлов: устр-во, механизм функционирования, факторы, ответственные за селективность. Уравнения Никольского и Эйзенмана-Никольского.
9. Эл-ды на основе труднорастворимых осадков: устр-во, механизм функционирования и важнейшие представители. Факторы, ответственные за селективность и нижний предел обнаружения. Примеры прим-я в анализе и научных исследованиях.
10. Электроды на основе жидких ионообменниках: устр-во, механизм функц-ния и важнейшие представители. Факторы, определяющие селективность и пределы функционирования. Примеры применения в анализе.
11. Эл-ды на основе нейтральных переносчиков: устр-во, механизм функц-ния и важнейшие представители. Факторы, определяющие селективность и пределы функционирования. Примеры применения в анализе.
12. Сложные устр-ва на основе ИСЭ: газовые селективные электроды, ферментные электроды, ионселективные полевые транзисторы.
13. Основные варианты метода прямой потенциометрии: м-д градуир. графика, м-д ограничивающих растворов, м-д стандартного раствора, метод добавок. Их достоинства и недостатки.
14. Анализ кривых потенциометрич.титрования. Факторы, определяющие высоту скачка потенциала в кислотно-основном, осадительном и Red-Ox титровании. Практические способы установления точки эквивалентности.
15. Основные источники погрешностей при работе с ИСЭ и способы их устранения.
16. Полярографический МА, общая хар-ка. Применение полярографии для определения неорг. и орг. соединений.
17. Принципиальная схема полярографической установки. Полярографическ. волна, хар-ка ее отдельных участков. Полярографический спектр.
18. Составляющие полярографируемого раствора и их роль в проведении полярографического анализа.
19. Полярографические max, причины их возникнов., способы устранения и применение для определения ПАВ.
20. Количественный полярографический анализ. Уравнение Ильковича.
21. Качественный полярографический анализ. Уравнение обратимой полярографической волны. Способы нахождения потенциала полуволны.
22. Твердые микроэлектроды и их применение в полярографии, достоинства и недостатки по сравнению с ртутным капельным электродом.
23. Основные пр-пы и конкретные пути повышения чувствит-сти и селектив-ности полярографическ. анализа. Дифференциальная, переменнотоковая, осциллографическая, инверсионная, импульсная вольтамперометрия.
24. Сущность амперометрическ. титрования. Типы кривых амперометрическ. титрования.
25. Кондуктометрия и кондуктометр. титрование и их аналитич. применение.
26. Кулонометрия и кулонометрическое титрование. Схема установки и способы нахождения количества перенесенного электричества. Практическое применение для определения металлов, окислителей и восстановителей в различных объектах.
1. Хар-ка основных типов электрохимич.ячеек (элктролитич.ячейка, гальва- нический элемент) и их использование в электрохимич. МА.
ЭХ-ячейки бывают двух типов: гальванич. элементы и электролитич. ячейки (электролизеры). В гальванич. элементе химические реакции протекают самопроизвольно на границе раздела электрод/электролит, а электроды соединены друг с другом проводником. В электролитич. ячейке реакции на границе раздела электрод/электролит протекают за счет внешнего источника электрич. энергии; последняя превращается в химич. энергию продуктов реакций, протекающих на электродах. Устройство гальванич. элемента представлено на рис. 1, а электролизера - на рис. 2. Отметим, что одна и та же ячейка в зависимости от режима работы может вести себя как гальванич. элемент, так и электролизер.

Рис. 1. ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ. В простом гальванич. элементе Даниеля перемещение каждых двух электронов по внешней цепи приводит к окислению одного атома цинка и осаждению одного атома меди. Электронейтральность растворов обеспечивается с помощью солевого мостика.
Простой гальванич. элемент состоит из двух электродов: цинкового, погруженного в водный раствор сульфата цинка, и медного, погруженного в водный раствор сульфата меди (II). Такой элемент аналогичен медно-цинковым парам в вольтовом столбе. При замкнутой внешней цепи атомы цинка на поверхности цинкового электрода окисляются до ионов с высвобождением электронов: Zn -> Zn2+ + 2e-. Эти электроны перемещаются по внешней цепи на медный электрод и восстанавливают ионы меди до атомов: Cu2+ + 2ē → Cu. Поток электронов во внешней цепи - это и есть ток, вырабатываемый элементом. Суммарная реакция, приводящая к химич. превращению и к генерации электрич. энергии, имеет вид
Cu2+ + Zn → Cu + Zn2+
Точно такая же реакция протекает при добавлении металлич. цинка в раствор сульфата меди, но в этом случае химич. энергия переходит в тепловую. ЭХ-ячейки часто представляют схематически, обозначая границу между электродом и электролитом вертикальной или косой чертой (| или /), а солевой мостик - двумя косыми черточками (//). Так, гальванич. элементу на рис. 1 отвечает запись
Zn / Zn2+(1M) // Cu2+(1M) / Cu
где M - молярная концентрация раствора.
В электролитич. ячейке, изображенной на рис. 2, протекают те же реакции, что и в промышленных электролизерах для получения хлора и щелочи: превращение рассола (концентрированного водного раствора NaCl) в хлор и гидроксид натрия NaOH:

Рис. 2. ЭЛЕКТРОЛИТИЧЕСКАЯ ЯЧЕЙКА. Перемещение каждых двух электронов во внешней цепи приводит к окислению двух ионов хлора с образованием одной молекулы хлора на углеродном аноде и разложению двух молекул воды, в которых два протона восстанавливаются до одной молекулы водорода и образуются два гидроксид-иона на железном катоде.
2Cl- + 2H2O → Cl2 + H2 + 2OH-
Хлорид-ионы на графитовом электроде окисляются до газообразного хлора, а вода на железном электроде восстанавливается до водорода и гидроксид-иона. Электролиты остаются электронейтральными благодаря перемещению ионов натрия через перегородку - ионообменную мембрану. Электрод, на котором осуществляется окисление (цинк на рис. 1 и графит на рис. 2), называется анодом, а электрод, на котором происходит восстановление, - катодом.
2. Сущность потенциометрич. Ма. Механизм возникновения потенциала на границе металл-раствор и др. Межфазовых границах. Условие Гуггенгейма. Уравнение Нернста.
Потенциометрич. МА основан на измерении электродного потенциала и нахождении зависимости между его величиной и конц-цией, точнее, активностью потенциалопределяющего компонента в растворе.
Простейшая потенциометрич. ячейка содержит два электрода: потенциал одного из них прямо или косвенно зависит от конц-ции определяемых ионов — его называют индикаторным электродом; и второй электрод, относительно которого измеряется потенциал индикаторного электрода, называемый электродом сравнения.
Ионы, от конц-ации которых непосредственно зависит потенциал электрода, называют потенциалопределяющими для данного электрода.
Возникновение электродного потенциала связано с ЭХ-процессом, происходящим на границе раздела металл/раствор. При погружении, например, индифферентного электрода из благородного металла в раствор, содержащий окислительно-восстановительную (редокс) систему (пару), устанавливается динамическое равновесие, которое м.б. выражено след. уравнением: Ок + ne ↔ Вос,
а электрод приобретает так называемый равновесный потенциал (Ер). Математическое выражение его зависимости от активности компонентов рассматриваемой редокс-системы дается уравнением Нернста:
Ep
= E0Ок/Вос
+
 ln
ln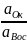 (31)
(31)
где Е° — стандартный потенциал редокс-системы, равный Ер, когда активности всех участвующих в ЭХ-реакции компонентов равны единице; R — газовая постоянная (8,3144 Дж/К·моль); Т — абсолютная темп-ра; п — число электронов, принимающих участие в данной ЭХ-реакции; F — постоянная Фарадея (≈96500 Кл).
В общем случае, когда ЭХ-реакция выражена равновесием
аА+bВ + сС+ ... +e ↔mM+pP + qQ+ ....
уравнение можно изобразить в виде
Ep
= E0A,B,C/M,P,Q
+
ln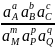 (32)
(32)
Компонентами, участвующими в реакции, м.б. ионы окислителя, восстановителя, водорода и др., молекулы растворителя (например, воды), тв. фаза (металл, оксид металла или малорастворимый электролит) и газообразные вещ-ва (например, Нг, СЬ, С1г и пр.). При этом в уравн. (32) не фигурируют те компоненты, активность которых постоянна или равна единице. К таким компонентам относятся тв. фаза, газообразное вещ-во, если раствор насыщен им при давлении 1 атм, а также растворитель вследствие большой его конц-ции и тем самым малых изменений его активности в процессе реакции.
Практически невозможно измерять потенциалы отдельного электрода. Поэтому необходимо составить гальванич. элемент (электролитич. ячейку) из двух полуэлементов с электродами, между которыми возникает разность потенциалов, при этом потенциал одного электрода постоянен и заранее известен. Такие электроды, относительно которых определяют потенциал индикаторного электрода, носят название электродов сравнения. По международному соглашению в качестве стандартного электрода сравнения принят стандартный водородный электрод (СВЭ.). Но так как водородный электрод малопригоден в обычных условиях работы (трудоемкость его приготовления), то на практике используют другие электроды сравнения, наприм. насыщен. каломельный электрод (НКЭ) или хлорсеребряный (ХСЭ).
Механизм возникновения потенциала
Если металлич. пластинку опустить в растворитель (наприм., воду), то металл начнет переходить в раствор в виде катионов. Вследствие этого на пластинке будет накапливаться отрицат. заряд, т.к. электроны не переходят в раствор. Отметим, что превалирующий переход катионов в др. фазу характерен только для полярных жидкостей и объясняется большей выгодностью сольватации катионов, чем электронов.
Процесс перехода катионов металла не бесконечен. По мере протекания процесса заряд на пластинке увеличивается, и переход в раствор новых катионов становится все менее выгодным. С др. стороны, раствор заряжается все более положительно и начинает выталкивать катионы на поверхность металлич. пластинки. Установившееся равновесие хар-тся равенством скоростей перехода катионов из раствора на пластинку металла и перехода катионов из пластинки в раствор. При изменении условий нахождения металла в растворе равновесие будет нарушаться, а при возвращении в первоначальные условия равновесие будет возвращаться в исходное состояние. Данное равновесие называется обратимостью электрода.
Вблизи границы с металлич. пластинкой конц-ция катионов высока. Значит. кол-во катионов находится в первом ряду, непосредственно прилегающем к поверхности металла, образуя положительную обкладку двойного электрического слоя (д.э.с.).
В результате такого процесса между пластинкой и раствором возникает разность потенциалов. Эта разность является следствием протекания электрохимической реакции:
|
(1) |
Количественно она может быть записана следующим уравнением:
|
(2) |
Процессы аналогичные протекающим на границе “металл-растворитель” протекают и на границах др. фаз: “кристалл-жидкость”, “стекло-жидкость”, а также на границах “жидкость-жидкость”. Наприм., при контакте стекла с жидк. фазой происходит перераспределение ионов водорода между стеклом и растворителем.
Между фазами стекла и раствора возникает разность потенциалов, которая также описывается уравнением Нернста:
|
(3) |
Раствор перхлората тетрадециламмония в нитробензоле также образует двухфазную систему с водой. Перхлорат-ионы способны переходить в водную фазу такой системы. И опять же межфазовый потенциал может быть записан следующим уравнением:
|
(4) |
Движущей силой выхода ионов в раствор в случае стеклянной и жидкой фазы является, как и в случае металла, выгодная гидратация катионов водорода и анионов ClO4―.
Условие Гуггенгейма
Условием равновесия при распределении заряженных частиц между фазами является равенство электрохимич. потенциалов частиц в фазах
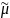 р-р
=
м
р-р
=
м
Электрохимич. потенциал – сумма химич. и электрич. потенциалов.
i= μi0 + RT ln ai + ziFφ в растворе
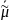 i
=
i
=
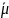 i0
+ RT ln
i0
+ RT ln
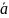 i
+ziF
i
+ziF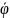 в
фазе
в
фазе
μ0 + RT ln ai + ziFφ = i0 + RT ln ai + ziF
E
=
– φ
=
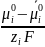 +
+
 lg
lg
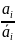
E = Ei0 + lg ai