
Одноосновные насыщенные кислоты
Гомологический ряд этих кислот начинается муравьиной кислотой

Изомерия кислот этого ряда определяется строением углеводородного радикала при карбоксильной группе и начинается с четвёртого члена ряда. Тривиальные названия карбоновых кислот привились очень прочно и широко используются наряду с названиями по номенклатуре ИЮПАК. Названия кислот по этой номенклатуре производятся от названия соответствующего углеводорода с добавлением суффикса -овая кислота. Иногда эти кислоты называют как производные уксусной кислоты.
|
муравьиная, метановая |
|
|
уксусная, этановая |
|
|
пропионовая, пропановая |
|
|
масляная, бутановая |
|
|
изомасляная, 2-метилпропановая |
|
|
валериановая, пентановая |
|
Одноосновные ненасыщенные кислоты
К ряду ненасыщенных карбоновых кислот можно отнести следующие:
-

акриловая, пропеновая

винилуксусная, бутен-3-овая

кротоновая, бутен-2-овая

метакриловая, 2-метилпропеновая

олеиновая, октадецен-9-овая

линолевая, октадекадиен-9,12-овая

линолевая,
октадекатриен-9,12,15- овая

арахидоновая,
эйкозатетраен-5,8,10,13-овая
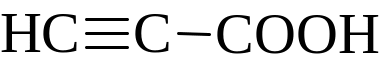
Про пропиоловая, пропиновая
Необходимо отметить, что кислоты типа
 с сопряжёнными
двойными связями (карбонильной и
этиленовой) обычно называют ,-ненасыщенными
кислотами. Они резко отличаются по
способам получения и свойствам от кислот
с изолированными двойными связями. К
последним относятся олеиновая, линолевая,
линоленовая, арахидоновая кислоты,
остатки которых входят в состав молекул
жиров. К α,β–ненасыщенным кислотам,
относятся акриловая и метакриловая
кислоты.
с сопряжёнными
двойными связями (карбонильной и
этиленовой) обычно называют ,-ненасыщенными
кислотами. Они резко отличаются по
способам получения и свойствам от кислот
с изолированными двойными связями. К
последним относятся олеиновая, линолевая,
линоленовая, арахидоновая кислоты,
остатки которых входят в состав молекул
жиров. К α,β–ненасыщенным кислотам,
относятся акриловая и метакриловая
кислоты.
Двухосновные насыщенные кислоты
Примерами предельных двухосновных кислот могут служить:
|
щавелевая, этандиовая (дикарбоновая)
|
|
малоновая, пропандиовая |
|
янтарная, бутандиовая |
|
метилмалоновая, метилпропандиовая |
|
глутаровая, пентандиовая |
|
адипиновая, гександиовая и т.д. |
Двухосновные ненасыщенные кислоты
Наиболее простыми представителями этого ряда кислот являются фумаровая и малеиновая кислоты. Они имеют одинаковую структурную формулу и являются геометрическими изомерами:

Одинаковость структурной формулы обеих кислот подтверждается тем, что при гидрировании они дают одну кислоту – янтарную

Ароматические карбоновые кислоты
В зависимости от числа карбоксильных групп, – СООН, связанных с ароматическим ядром, ароматические карбоновые кислоты могут быть одно-, двух- и многоосновными. Они обычно носят тривиальные названия. Например:
|
бензойная кислота |
|
о-, м- и п-толуиловые кислоты |
|
о-фталевая |
|
м-фталевая или изофталевая |
44. Аминокислотами называют соединения, в которых одновременно содержатся аминная и карбоксильная группы. Простейшие аминокислоты имеют тривиальные названия. Обычно же их называют как замещённые соответствующих кислот, обозначая положение аминогрупп относительно кислотной буквами α, β, γ, δ и т. д. Используется также названия по номенклатуре ИЮПАК:
|
глицин, гликокол, аминоуксусная, аминоэтановая |
|
α-аланин, α-аминопропионовая, 2-аминопропановая |
|
β-аланин, β-аминопропионовая, 3-аминопропановая |
|
валин, α-аминовалериановая, 2-аминопентановая |
|
изолейцин, 2-амино-3-метилпентановая |
|
лизин, α,δ-диаминокапроновая, 2,6-диаминогексановая
|
Аминокислоты могут содержать одну или несколько кислотных групп и различаться по основности. В молекулу аминокислоты может также входить и несколько аминогрупп.
Сущ-ет несколько видов классификации аминокислот:
1) в основу положено строение радикалов аминокислот
-алифатические (глицин, аланин)
-гидроксилсодержащие (ОН) - серин, трионин
- серосодержащие (SH) – метионин, цистеин
- ароматические (тирозин, фенилаланин, триптофан)
- с анионобраз. группами (кислые) – аспарагиновая к-та
- амины аспарагиновых и глуткминовых к-т (аспарагин, глутамин)
- основные (аргинин, гистидин)
2) основан на полярности аминокислот
Различают полярные (CO, CS, CN) и неполярные (C=C, C-H)
3) на основе ионных свойства радикалов
Положительно заряженные, отрицательно заряж., нейтральные.
4) по числу аминных и карбоксильных групп
Моноаминомонокарбоновые, моноаминодикарбоновые (ГЛУ, Асп), диаминомонокарбоновые (лизин, аргинин, гистидин).
5) по значимости
Заменимые, незаменимые и частично заменимые.
Незаменимые амин-ты не образ-ся в организме человек и животных, но обязательно должны поступать в организм – валин, лейцин, изолейцин, трионин, триптофан, метионин, лизин, фенилаланин.
Частично незаменимые не синтезируются в организме детей. Незаменимые аминокислоты синтезир-ся в растениях.
Изомерия
Все природные аминокислоты, за исключением глицина, имеют при альфа-углеродном атоме водорода различные заместители.
45. Методы получения
– Аминокислоты имеют чрезвычайно большое физиологическое значение. Из остатков аминокислот построены белки и полипептиды. При гидролизе белковых веществ животных и растительных организмов образуются аминокислоты.
– Действие аммиака на галоидзамещённые кислоты

– α-Аминокислоты получают действием аммиака на оксинит-рилы

Оксинитрилы получают действием на альдегиды HCN

Физические свойства
Аминокислоты в
настоящее время рассматриваются как
продукты нейтрализации карбоксила и
аминогруппы в одной и той же молекуле,
т.е. внутренние соли
Молекула внутренней соли является биполярным ионом, то есть молекулой с разноимёнными зарядами на противоположных концах молекулы. уществованием аминокислот в виде биполярных ионов объясняются высокие температуры плавления аминокислот, их малая летучесть, нерастворимость в углеводородах и хорошая растворимость в воде. Некоторые аминокислоты оптически активны.
Химические свойства
Поскольку в молекулах аминокислот имеются амино- и карбоксильные группы, они вступают в реакции, характерные для этих функциональных групп. Дополнительно к этому познакомимся со свойствами аминокислот, которые обусловлены одновременным присутствием в структуре молекул обеих функциональных групп.
– Наличие в молекуле аминокислоты кислотной и основной групп обуславливает амфотерность этих соединений и существование их в виде биполярного иона. В кислой среде образуется катион соли аминокислоты как основания, в щелочной – анион соли аминокислоты, как кислоты.

Концентрация водородных ионов (рН среды), при которой амфотерное соединение наименее и в равной мере диссоциировано по обоим направлениям, называется изоэлектрической точкой. В изоэлектрической точке аминокислота существует в виде биполярного иона (в целом электрически нейтрального соединения), поэтому в изоэлектрической точке водные растворы аминокислот неэлектропроводны. Изоэлектрическая точка для каждой аминокислоты является индивидуальной характеристикой и может использоваться для их идентификации.
– С основаниями аминокислоты образуют соли. Особенно характерно образование медных солей, имеющих интенсивную синюю окраску. Эти вещества являются внутрикомплексными соединениями

– Химическое поведение аминокислот в значительной мере определяется взаимным расположением аминогруппы и карбоксила. Особенно ярко это проявляется при нагревании аминокислот.α-Аминокислоты при нагревании легко отщепляют воду и дают дикетопиперазины.

β-Аминокислоты отщепляют аммиак и образуют аммонийную соль непредельной кислоты

γ- и δ-Аминокислоты отщепляют воду внутримолекулярно и дают лактамы

Отдельные представители
α-Аминопропионовая кислота (α-аланин)
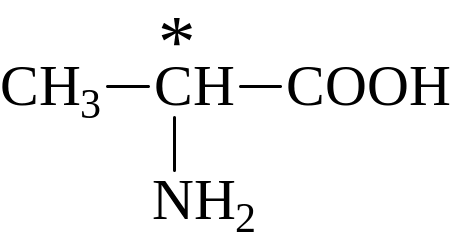 В
α-аланине имеется асимметрический атом
углерода. Поэтому он оптически активен.
L(+)-аланин
входит в состав всех белков. Его можно
получать гидролизом фиброина шёлка.
В
α-аланине имеется асимметрический атом
углерода. Поэтому он оптически активен.
L(+)-аланин
входит в состав всех белков. Его можно
получать гидролизом фиброина шёлка.
2,6-диаминогексановая кислота (лизин)
*
![]()
В состав лизина входят две аминогруппы и один карбоксил. Поэтому он является сильным основанием. L(+)-лизин входит в состав белков и относится к незаменимым аминокислотам.
6-Аминогексановая кислота (ε-аминокапроновая)
![]()
Эта кислота и её лактам, капролактам, используется для получения синтетического волокна капрон.
46. Известно, что аминокислоты входят в состав белков. Белки находятся во всех растительных и животных организмах и являются главными носителями жизни. Несмотря на многочисленность белков, в их состав входят не более 22 разных аминокислот. При гидролизе белок превращается в смесь аминокислот. Гидролиз природных белков показал, что в их состав входят α-аминокислоты. В 1891г. А.Я. Данилевский высказал предположение, что α-аминокислоты связываются в белке за счёт амидных связей, образованных карбоксилом одной молекулы аминокислоты и аминогруппой другой.

Такого рода связи носят название «пептидных связей». Этим путём могут быть соединены 2,3,4 остатка одинаковых или разных α-аминокислот в виде дипептида, трипептида, тетрапептида и т. д. Такие соединения в общем случае называются полипептидами. Молекулы полипептидов (белков) в общем случае будут иметь следующую структуру:

Полипептиды различаются между собой длиной основной цепи, составом и строением радикалов R и последовательностью их чередования в структуре молекулы, иными словами, последовательностью чередования остатков аминокислот. По концам молекулы полипептида расположены карбоксильная и аминогруппы. Белки построены сложнее полипептидов. Белками называют полипептиды большой молекулярной массы, способные к организации устойчивой пространственной структуры, которой нет у полипептидов. Однако отдельные фрагменты белковой молекулы могут рассматриваться как полипептидные звенья. Пептиды имеют важное значение. Пептидные гормоны и нейропептиды, например, регулируют большинство процессов организма человека, в том числе, принимают участие в процессах регенерации клеток. Пептиды иммунологического действия защищают организм от попавших в него токсинов. Для правильной работы клеток и тканей необходимо адекватное количество пептидов. Однако с возрастом и при болезнях возникает дефицит пептидов, который существенно ускоряет износ тканей, приводит к старению всего организма. Поскольку природные полипептиды состоят из остатков различных α-аминокислот, при их получении синтетическим путём возникают большие трудности. Во-первых, необходимо выдержать определённую последовательность соединения аминокислот, и во-вторых – избежать соединения двух молекул одной кислоты, остаток которой вводится в пептид при наращивании его цепи. Первое обстоятельство выполняется при стадийном проведении синтеза. На каждой стадии к полипептиду, полученному на предыдущей стадии, добавляется один аминокислотный остаток и продукт очищается. Однако, из-за большого числа таких стадий и трудоемкости очистки синтез занимает много времени и общий выход конечного продукта чрезвычайно мал. Действительно, первый полный синтез пептида, гормона окситоцина (1953 г.), содержащего всего 8 аминокислотных остатков, рассматривался как выдающееся достижение. Следует отметить, что две различные аминокислоты могут образовывать четыре дипептида. Количество дипептидов резко возрастает с увеличением числа участвующих в их образовании неодинаковых аминокислот. Чтобы избежать произвольного соединения остатков аминокислот, в том числе и одинаковых, применяют специальные приемы пептидного синтеза: защиту (блокирование) одних функциональных групп и активацию других. Чтобы в смеси глицина и аланила однозначно получался только первый дипептид (глицилаланин), необходимо заблокировать аминогруппу глицина и карбоксильную группу аланина. Образование остальных трех дипептидов становится невозможным. При синтезе полипептидов, содержащих большое число аминокислотных остатков, требуется проведение множества реакций, которые сопровождаются однотипными операциями по выделению и очистке продукта на каждой стадии, что сопряжено с большими затратами времени. В наст. время созданы автоматич. приборы (синтезаторы), которые в запрограммированной последовательности осущ-ют необходимые операции. Эти методики используются для получения гормона инсулина, необходимого больным диабетом для снижения содержания сахара в крови.
47. Для описания строения белковой молекулы были введены понятия о первичной, 2-ной, 3-ной, 4-ной структурах белковых молекул. Под первичной структурой понимают кол-во и последоват. расположения аминокислот в полипептидной цепи. Между первич. Структурой и его фун-ей сущ-ет тесна связь. Для того, чтобы белок обладал опред. функ-ми, необходима определенная аминокислотная последоват. Даже небольшое изменение в послед-ти аминокислот нарушает функции белка. Исследования показали, что первичная струк-ра белка генетически закреплена. Первым белком, у которого была опред. первичная структура, явл-ся белок инсулин (содержит 51 аминокислоту). Белковые в-ва, содержащие от 2 до 50 аминокислот, наз-ся пептидами, а более 50 аминокислот – белки. Связи, которые стабилиз. Первичную стр-ру, наз-ся пептидными. Пептидная связь образуется в результате дегидратации (удаление воды). Пептидная связь явл-ся ковалентной, очень прочной, при тепловой денатурации не разрушается. Атомы Н и О пептидной цепи, N и альфа-углеродные атомы наход-ся в 1 плоскости. Вторичная структура представлена 3 видами: альфа-спираль, бэта-структура, статистический клубок. Вторичная стр-ра обр-ся того или иного вида вращения вокруг связей, соед. Альфа-углеродные атомы полипептидной цепи. Связи, которые удерживают вторичную стр-ру, наз-ся водородными (между пептидными связями). Третичная стр-ра белков обр-ся путём дополнит. Складывания пептидной цепи, содержащей альфа, бэта-структуру и статистический клубок. Основной движущей силой возникновения 3-ной стр-ры явл-ся взаимод. аминокислот с молекулами воды. Гидрофобные радикалы смотрят внутрь молекулы, а полярные радикалы наход-ся на поверхности и ориентируются в сторону воды.








