
50. Дисахариды при гидролизе дают два одинаковых или разных моносахарида. Строение и свойства дисахаридов зависят от того, в каких формах присутствуют в них моносахариды: α- или β-, пиранозной или фуранозной, за счет каких гидроксилов связаны между собой остатки моносахаридов в молекуле дисахарида. Дисахариды делятся на две группы: восстанавливающие и невосстанавливающие дисахариды. К восстанавливающим дисахаридам относятся мальтоза, целлобиоза, лактоза.
Мальтоза или солодовый сахар при гидролизе расщепляется на две молекулы D-глюкозы. Поскольку на образование эфирной связи между остатками молекул моносахаридов используется только глюкозидный гидроксил первого остатка, а глюкозидный гидроксил второго остатка остается свободным, мальтоза способна к таутомерии с раскрытием цикла второго остатка.

Присутствие открытой формы с альдегидной группой делает мальтозу хорошим восстановителем. Подобно моносахаридам она вступает во все реакции карбонильной группы, спиртовых и полуацетального гидроксилов. Она мутаротирует в водных растворах. Мальтоза получается при неполном гидролизе крахмала.
Целлобиоза также является восстанавливающим дисахаридом. От мальтозы она отличается тем, что первым остатком ней является остаток β-D-глюкопиранозы , а не α-D-глюкопиранозы как в мальтозе.

4(β-D-глюкопиранозидо)–α-D-глюкопираноза Карбонильная форма: 4(β-D-глюкопиранозидо)–D–глюкоза
Целлобиоза получается при неполном гидролизе целлюлозы.
Лактоза или молочный сахар состоит из остатков β-D-галактозы в пиранозной форме и D-глюкозы. Молочный сахар содержится в молоке (в коровьем 4…5 %). Менее сладок, чем тростниковый сахар.
К группе невосстанавливающих дисахаридов относятся сахароза и трегалоза. К таутомерии они неспособны, так как эфирная связь между остатками образована с участием обоих гликозидных гидроксилов. Сахароза – тростниковый или свекловичный или просто сахар. При гидролизе даёт глюкозу и фруктозу и состоит из остатков α-D-глюкозы в пиранозной и β-D-фруктозы в фуранозной формах:

2-(α-D-глюкопиранозидо)- β -D-фруктофуранозид
или в формулах Фишера
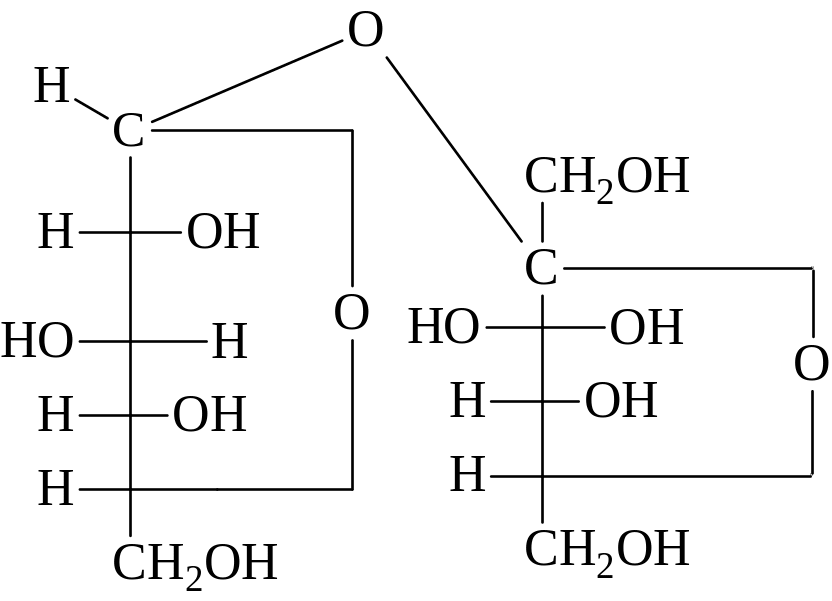
Сахароза широко распространена в природе. Например, в сахарной свекле её содержание доходит до 28 % от веса сухого вещества. Получают сахарозу из сахарной свеклы и сахарного тростника. Является весьма важным питательным и вкусовым веществом. Хорошо усваивается организмом человека. При сгорании 1 г сахарозы выделяется 16,7 кДж·моль-1 энергии. Сахароза образует бесцветные прозрачные кристаллы (tпл=160 °С). Расплавленная сахароза застывает в аморфную массу, называемую карамелью.
Инверсия сахарозы
При гидролизе сахарозы она расщепляется на эквимолекулярные количества D-(+)-глюкозы и D-(–)-фруктозы.

При этом фруктоза значительно сильнее вращает влево, чем образующаяся глюкоза и еще остающаяся в растворе сахароза – вправо. Поэтому, по мере течения реакции гидролиза образующаяся фруктоза постепенно компенсирует слабое правое вращение еще остающейся в растворе сахарозы и получающейся глюкозы. Поэтому правое вращение раствора со временем уменьшается, а затем происходит перемена направления вращения плоскости поляризации. Это явление называется инверсией сахарозы. Получающаяся в результате гидролиза смесь равных количеств глюкозы и фруктозы называется инвертным сахаром (инвертным сиропом) и используется в кондитерской промышленности, а также в качестве добавок к натуральному меду.
41. Aминами называют, продукты замещения атомов водорода в аммиаке на углеводородные радикалы.
Алифатические амины
Первичными аминами называют продукты замещения одного атома водорода в аммиаке R–NH2. Причём первичность, вторичность или третичность углеводородного радикала в данном случае роли не играет. Замещение двух водородов аммиака на одинаковые или разные углеводородные радикалы дает вторичный, а трех – третичный амин. Изомерия аминов определяется положением аминогруппы в углеродной цепи и количеством и строением радикалов, связанных с азотом.
По радикально-функциональной номенклатуре амины обычно называют как производные аммиака, добавляя к названию радикалов слово «амин». При составлении названия по номенклатуре ИЮПАК исходят из названия углеводорода с самой длинной цепью и вводят названия замещающей группы в этой цепи в виде приставки: амино- (-NH2), метиламино- (-NHCH3), диметиламино- [-N(CH3)2] и т.д. Цифрой указывают положение заместителя.
Способы получения
– Главный путь получения аминов – алкилирование аммиака или аминов галоидными алкилами – реакция Гофмана.
CH3I+2NH3 → CH3 – NH2 + NH4I
йодметан метиламин йодистый аммоний
– Амиды кислот при расщеплении гипобромидом или гипохлоридом дают первичные амины

– Восстановление нитросоединений, нитрилов и изонитрилов.
Реакции протекают при действии водорода в присутствии катализаторов Pt, Pd, Ni.

Физические свойства
Простейшие амины – газы, хорошо растворимые в воде и обладающие сходным с аммиаком запахом, но с более сильным «рыбным» оттенком. По сравнению со спиртами амины менее диссоциированы. Температуры кипения их соответственно ниже. Среди изомеров ниже кипят третичные амины, выше – первичные.
Химические свойства
В химическом отношении амины сходны с аммиаком.
– Также как и аммиак они обнаруживают щелочную реакцию с обычными индикаторами. Свойства аминов как оснований обусловлены способностью атома азота за счёт неподелённой пары электронов присоединять протон с образованием алкилзамещённого иона аммония

С водой амины образуют алкилзамещённые гидроксиды аммония

С минеральными кислотами они дают алкилзамещённые аммонийные соли

Реакции с кислотами свидетельствуют о том, что амины являются органическими основаниями. В большинстве случаев алифатические амины более сильные основания, чем аммиак.
– Амины подвергаются ацилированию, в том числе и ацетилированию уксусным ангидридом или хлористым ацетилом:

Амины нашли применение как органические основания и растворители, в синтезах некоторых поверхностно активных веществ, добавок при флотационном разделении солей, при получении целого ряда других ценных продуктов.
