- •2. Трансферазы
- •3. Гидролазы
- •1. Субстратная специфичность
- •2. Каталитическая специфичность
- •Активаторы и ингибиторы ферментов. Ингибиторы ферментов различного характера.
- •Характеристика конкурентных ингибиторов
- •Количественное определение ферментативной активности
- •Пример количественного анализа ферментативной активности; определение содержания дегидрогеназы
- •Сопряженный ферментный анализ
- •Единицы измерения активности ферментов
- •Энзимодиагностика, энзимотерапия. Применение ферментов как аналитических реагентов при лабораторной диагностике (определение глюкозы, этанола, мочевой кислоты и т.Д.) Энзимодиагностика
- •Энзимотерапия
2. Каталитическая специфичность
Фермент катализирует превращение присоединённого субстрата по одному из возможных путей его превращения. Это свойство обеспечивается строением каталитического участка активного центра фермента и называется каталитической специфичностью, или специ-фич-ностью пути превращения субстрата. Так, молекула глюкозо-6-фосфата в клетках печени человека - субстрат 4 различных ферментов: фосфоглюкомутазы, глюкозо-6-фосфатфосфа-тазы, фосфоглюкоизомеразы и глюкозо-6-фос-фатдегидрогеназы. Однако из-за особенностей строения каталитических участков этих ферментов происходит различное превращение этого соединения с образованием 4 различных продуктов (см. схему на след. стр.)
Активаторы и ингибиторы ферментов. Ингибиторы ферментов различного характера.
Соединения, которые при добавлении их в реакционную смесь вызывают уменьшение скорости ферментативной реакции, называются ингибиторами. Один из классов ингибиторов – необратимые ингибиторы или каталитические яды. Они взаимодействуют с ферментом и снижают его активность до нуля, например, ионы тяжелых металлов.
Более важным классом ингибиторов является класс обратимых ингибиторов.Они образуют с ферментом динамические комплексы, которые отличаются по своим каталитическим свойствам от свободного фермента. Фермент в присутствии ингибитора может характеризоваться более высоким численным значением Km (конкурентное ингибирование), более низким значением υm (чистое неконкурентное ингибирование), значениями υm и Km, уменьшенными в одинаковой степени (бесконкурентное ингибирование), или определенной комбинацией этих эффектов (смешанное ингибирование). Понятие “чистое неконкурентное ингибирование” используется редко.
Для определения типа ингибирования используют механизм, предложенный Боттсоми Моралесом. Большинство простых типов ингибирования являются частными случаями этого механизма, представленного на схеме (1.25):

Эта схема включает четыре формы фермента (E, ES, EI и EIS) и шесть реакций, протекающих между ними. Все простые случаи можно получить, если не учитывать некоторых реакций. Например, ингибирование является конкурентным, если отсутствует форма EIS и протекающие с ее участием реакции; неконкурентным, если отсутствует форма EI, и смешанным, если в схеме присутствуют обе указанные выше формы (EIS и EI), однако прямой переход между ними невозможен. Схема Боттса – Моралеса особенно полезна при анализе ингибиторов, которые не являются продуктами ферментативной реакции.
Эта схема описывает также некоторые механизмы действия активатора, когда в систему вносят вещество, повышающее скорость реакции. Поэтому ее можно рассматривать как общую схему, описывающую механизм действиямодификаторов, под которыми понимают как ингибиторы и активаторы одновременно
Ингибиторы ферментов - это вещества, замедляющие ферментативные реакции.

Характеристика конкурентных ингибиторов
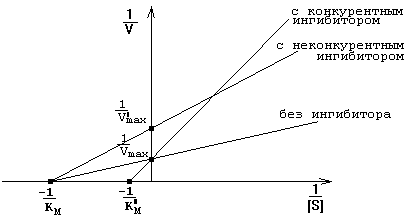
Конкурируют с субстратом за обладание активным центром фермента. По структуре они похожи на субстрат. Присоединяются к адсорбционному центру фермента: действуют на стадии I-го этапа ферментативного катализа. Поэтому конкурентные ингибиторы увеличивают Km и уменьшают сродство фермента к субстрату. Они не изменяют Vmax ферментативной реакции: при повышении концентрации субстрата действие конкурентных ингибиторов можно преодолеть - молекулы конкурентного ингибитора постепенно вытесняются субстратом с активного центра фермента.
ХАРАКТЕРИСТИКА НЕКОНКУРЕНТНЫХ (АЛЛОСТЕРИЧЕСКИХ) ИНГИБИТОРОВ
Связываются с аллостерическим центром фермента. Происходят изменения конформации аллостерического центра, а затем, через всю молекулу, они передаются на каталитический центр. Изменение конформации каталитического центра вызывает снижение активности фермента. Поэтому неконкурентные ингибиторы уменьшают Vmax - снижают скорость протекания II-го этапа ферментативного катализа. Не влияют на Km и не изменяют сродство фермента к субстрату.
Действие обратимых ингибиторов на кинетические константы представлено на графике зависимости 1/V от 1/[S] (график Лайнуивера-Берка) - смотрите рисунок.
|
Измеряя скорость реакции при разных концентрациях субстрата в присутствии и в отсутствие ингибитора, можно не только распознать тип ингибирования, но и по степени изменения Км или Vmax количественно оценить степень сродства данного ингибитора к ферменту
.
. ИЗОФЕРМЕНТЫ отличаются по структуре, но выполняют одну и ту же функцию. Изоферменты, в частности, имеют алкогольдегидрогеназа и лактатдегидрогеназа (существуют целых 5 изомеров лактатдегидрогеназы). Изоферменты могут различаться по каталитической активности, несмотря на то, что катализируют одну и ту же реакцию. Так, в клетках печени человека различаются цитоплазматическая ацетальдегиддегидрогеназа (низкоактивная, с высоким значением Km) и митохондриальная ацетальдегиддегидрогеназа (AcDH), с малым значением Km. Последнее обстоятельство является биохимической причиной непереносимости алкоголя у коренного населения Юго-Восточной Азии, которое связано с практическим отсутствием у них (по генетическим причинам) митохондриальной AcDH и превращение образовавшегося из этанола ацетальдегида осуществляется у них малоактивной цитоплазматической AcDH.
Профермент — неактивный предшественник фермента. Другие названия: зимоген, проэнзим, энзимоген. Физиологический смысл проферментов заключается в том, чтобы ткани, продуцирующие ферменты, не подвергались воздействию этих самых ферментов. Поэтому акт продукции фермента (профермента) отделен от акта его активации — превращения в фермент. И поэтому проферменты, в основном, встречаются у протеолитических ферментов, расщепляющих белки, в отличие отлиполитических ферментов, расщепляющих жиры.
Регуляция активности ферментов. Аллостерические ингибиторы и активаторы
Активность ферментов может регулироваться с помощью многих факторов. Одним из важнейших факторов, регулирующих активность ферментов является кислотность среды. Для большинства ферментов имеется определенное значение рН, при котором активность максимальна, выше и ниже этого значения рН активность фермента уменьшается. Значение рН, соответствующее максимальной активности фермента, не обязательно совпадает со значением рН, характерным для внутриклеточного. Это позволяет предположить, что влияние рН на активность ферментов может быть одним из факторов, ответственных за регуляцию ферментативной активности внутри клетки. Поскольку в клетке содержатся сотни ферментов и каждый из них по-разному реагирует на изменение кислотности среды, значение рН внутри клетки является, возможно, одним из важных элементов в сложной системе регуляции клеточного метаболизма. Влияние реакции среды на активность фермента состоит в изменении степени ионизации функциональных групп фермента и субстрата. Различным значениям рН соответствует разная третичная структура фермента. При значительном отклонении рН от оптимальных значений ферменты становятся неустойчивыми. Изменение рН может влиять на образование фермент-субстратного комплекса, а также замедлять или ускорять высвобождение продуктов реакции.
Другим фактором, регулирующим активность фермента в интактной клетке является ингибирование. Различают прежде всего обратимое и необратимое ингибирование. Необратимое ингибирование сопровождается разрушением или модификацией одной или нескольких функциональных групп фермента. Обратимое ингибирование подразделяется наконкурентное и неконкурентное. Конкурентное ингибирование может быть ослаблено или устранено путем увеличения концентрации субстрата, для ингибитора характерно структурное сходство с субстратом, с которым они конкурируют за активный центр фермента этого класса. В основе неконкурентного ингибирования лежит обратимое взаимодействие ингибитора с какой- либо группой молекулы фермента, существенной для активности фермента, но не входящей в активный центр. Неконкурентное торможение может быть снято только при химическом изменении ингибитора, в результате чего ослабляется его связь с ферментом.Своеобразными регуляторами активности ферментов являются аллостерические эффекторы, которые могут действовать и как активаторы, и как ингибиторы. По химической структуре они отличаются от субстрата и присоединяются к ферменту в аллостерическом центре. Присоединяясь к аллостерическому центру, эффектор изменяет третичную и четвертичную структуру всего фермента таком образом, что нарушается положение функциональных групп в каталитически активном центре, вследствие чего увеличивается или уменьшается его способность связывать и преобразовывать субстрат.
В интактной клетке многие ферменты работают, как правило, одновременно, катализируя последовательные цепи реакций, в которых продукт, полученный при участии первого фермента оказывается в роли субстрата следующего фермента и т.д. По сложности молекулярной организации мультиферментные системы можно разделить на 3 группы. В простейших системах отдельные ферменты растворены в цитоплазме и работают независимо друг от друга. Небольшие молекулы субстратов, характеризующиеся высокой скоростью диффузии, очень быстро находят дорогу от одного фермента к другому. Другие системы обладают более высокой организацией. Отдельные ферменты, относящиеся к этим системам могут ассоциировать друг с другом и функционировать совместно в форме ферментных комплексов. К наиболее высокоорганизованным относятся ферментные системы, связанные с крупными надмолекулярными структурами, такими как мембрана и рибосома , например, дыхательная цепь.
Многие мультиферментные системы обладают способностью автоматически поддерживать требуемую скорость суммарной реакции. В большинстве таких систем конечный продукт последовательности реакций оказывает ингибирующее действие на первый фермент, в результате чего скорость всего процесса в целом определяется стационарной концентрацией конечного продукта. Такой тип ингибирования называется ингибированием по типу обратной связи. Фермент, регулирующийся конечным продуктом называется регуляторным или аллостерическим, а ингибирующий продукт - эффектором или модулятором.
Регуляторные ферменты имеют обычно более крупные и сложные молекулы, чем ферменты, не наделенные регуляторными свойствами. В настоящее время они подразделяются на 3 класса: 1) гомотропные, 2) гетеротропные, 3) гомогетеротропные. Для гомотропных регуляторных ферментов молекула субстрата служит не только субстратом, но и модулятором, как правило, повышающим активность фермента при повышении концентрации субстрата. Гетеротропные регуляторные ферменты стимулируются или ингибируются присутствующими обычно в среде специфическими эффекторами или модуляторами, которые не являются субстратами. Гомогетеротропные - субстрат является одним из двух или нескольких модуляторов, регулирующих активность фермента.
Центр связывания регуляторного фермента не совпадает с активным каталитическим центром. Регуляторные ферменты обычно состоят из субъединиц , способных взаимодействовать друг с другом. Ряд ферментов существует в виде нескольких форм - изоферментов, которые представляют собой различные сочетания из двух или нескольких типов полипептидных цепей. Считается, что изоферменты играют важную роль в регуляции ферментативной активности, а также в процессах развития и дифференцировки.
Аллостерические ингибиторы и активаторы объединяют общим названием эффекторы. Эффектор - одна из важных особенностей аллостерических ферментов. Возможность изменять скорость реакции, катализируемой ферментом, ингибиторами и активаторами - краеугольный камень принципов регуляции метаболизма. Следующий график показывает пути, по которым эффекторы изменяют кинетический график типичного аллостерического фермента с положительной субстратной кооперативностью.
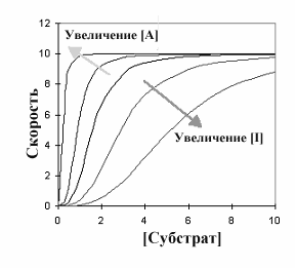 Центральная
линия графика - типичная сигмовидная
кривая в отсутствии любого эффектора.
В присутствии активатора (А) скорость
реакции повышается при любой данной
концентрации субстрата, в то время как
ингибитор уменьшает скорость реакции.
Интересны и изменения общей формы
кривой по сравнению с центральной
линией. Ингибитор увеличил сигмовидную
форму, удлиняя «носок» кривой, в то
время как активатор оказывал
противоположный эффект. При более
высокой концентрации активатора график
в целом приобретает характер гиперболы.
Это указывает на то, что аллостерический
ингибитор увеличивает уровень субстратной
кооперативности, в то время как активатор
уменьшает его.
Центральная
линия графика - типичная сигмовидная
кривая в отсутствии любого эффектора.
В присутствии активатора (А) скорость
реакции повышается при любой данной
концентрации субстрата, в то время как
ингибитор уменьшает скорость реакции.
Интересны и изменения общей формы
кривой по сравнению с центральной
линией. Ингибитор увеличил сигмовидную
форму, удлиняя «носок» кривой, в то
время как активатор оказывал
противоположный эффект. При более
высокой концентрации активатора график
в целом приобретает характер гиперболы.
Это указывает на то, что аллостерический
ингибитор увеличивает уровень субстратной
кооперативности, в то время как активатор
уменьшает его.
K-системы и V-системыКак видно из графика все линии стремятся к одному значению Vmax, но при этом эффектор влияет на связывание субстрата, что отмечено в изменении Км. Такая ситуация названа K-системой. Некоторые ферменты имеют эффекторы, которые изменяют Vmax. Тогда говорят о V-системе..
Двухфазный ответ на конкурентные ингибиторы. Помимо взаимодействия с эффекторами, аллостерические ферменты являются объектом обычного конкурентного торможения, подобно любому другому ферменту. Классические конкурентные ингибиторы действуют, потому что они структурно подобны субстрату фермента. В аллостерическом ферменте, с положительной субстратной кооперативностью конкурентный ингибитор также достаточно близок по строению субстрату, мог бы иметь те же самые свойства кооперативности как и субстрат. В этом случае, низкая концентрация конкурентного ингибитора увеличивает способность фермента связывать молекулы субстрата, что фактически равно увеличению скорости реакции. При более высоких концентрациях ингибитора это блокировало бы связывание субстрата обычным способом, и реакция замедлится. Ингибитор тем самым оказывает двухфазный эффект. При низких концентрациях - он действует как активатор, в то время как при высоких концентрациях, он действует как ингибитор.