
- •Движение жидкости (газа).
- •Тепло- и массоперенос.
- •Химические реакции.
- •Физико-химические процессы в потоке.
- •Этапы построения детерминированной модели
- •Формулировка математической модели
- •Программирование и
- •Отладка программы
- •Аналитическое решение задачи
- •Экспериментальное
- •Определение
- •Констант модели
- •Выбор параметров
- •Процесса вычислений
- •Решение контрольных задач
- •Контрольные
- •Эксперименты на
- •Натурном объекте
- •Оптимизация процесса с помощью модели
- •Определение целевой функции
- •Помощью модели
- •Разработка аналитической (интегральной) модели для системы с сосредоточенными параметрами.
- •Разработка программной (численной) модели для системы с сосредоточенными параметрами.
- •Разработка программной (численной) модели с распределёнными параметрами.
Движение жидкости (газа).
На основе общих законов механики движение жидкости (газа) описывается следующими соотношениями:
- уравнением сплошности, связывающим плотность движущейся среды плотностью с её скоростью :
![]() (3)
(3)
где J - объёмный источник изменения массы вследствие химических и фазовых превращений, - время;
- уравнениями Навье-Стокса
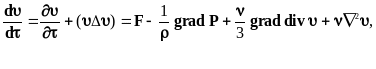 (
4)
(
4)
где - кинематическая вязкость жидкости, F - внешняя объёмная сила, Р - давление жидкости.
Левая часть уравнения содержит сумму локального и конвективного ускорения, в правой части суммируются объёмная сила, давление и силы сопротивления, обусловленные вязкостью.
Приведенная выше система уравнений позволяет определить неизвестные функции скоростей (x, y, z, ) и давления Р (x, y, z, ) при заданных значениях F (x, y, z, ), J (x, y, z, ), и . Решение подобной системы численными методами требует применения сложного математического аппарата и немалых затрат машинного времени. Для установившихся процессов, когда ускорениями в левой части уравнения (4) можно пренебречь, можно получить весьма известное уравнение Бернулли, используемое обычно для расчётов гидравлических режимов потоков.
Тепло- и массоперенос.
Дифференциальное уравнение переноса тепла в подвижной среде учитывает молекулярный перенос тепла кондукцией с коэффициентом теплопроводности и конвекцией со скоростью вследствие перемещения частиц жидкости:
![]() (5)
(5)
где t - температура, с - удельная теплоёмкость, Q - внутренний объёмный источник тепла химических или фазовых превращений. Аналогичные соотношения используются и для описания процесса диффузии:
![]() , (6)
, (6)
где С - концентрация диффундирующего вещества, D - коэффициент диффузии, r - объёмный источник вещества. Уравнения дают значения С (x, y, z, ) и t (x, y, z, ), отвечающие конкретным условиям задачи, если указаны соответствующие граничные условия (законы распределения температуры (концентрации) в начальный момент времени и условия на границах рассматриваемого тела на протяжении всего процесса. Граничные условия конвективного теплообмена (переноса вещества) задают в форме уравнения Ньютона, для лучистого теплообмена - по закону Стефана-Больцмана.
Химические реакции.
Описание химических превращений складывается из стехиометрических соотношений, уравнения химического равновесия и описания кинетических закономерностей.
Стехиометрическое уравнение является кратким выражением материального баланса реакции:
![]() (7)
(7)
где Si - стехиометрические коэффициенты; для исходных веществ Si<0, для продуктов реакции Si>0; Ai - символы веществ, участвующих в реакции. Наиболее часто для решения стехиометрических задач используются методы линейной алгебры 1].
Расчёт химического равновесия позволяет выяснить принципиальную возможность получения тех или иных веществ в требуемых количествах, а также оценить содержание в них примесей и побочных веществ.
Существует несколько методик термодинамического анализа сложных систем. Простейшие основаны на решении систем уравнений, образованных выражениями для констант равновесия, совместно с уравнениями стехиометрического баланса. Для многокомпонентных гетерогенных систем (а это - большинство металлургических процессов), используются методы, основанные на принципе максимума энтропии (или минимума энергии Гиббса) для системы, находящейся в равновесии, и реализуемые только с помощью компьютерных технологий. [2,3,4].
Кинетика
химической реакции
описывается скоростью r изменения массы
реагентов G в единице объёма V. Для
гомогенных реакций
![]() или единицу поверхности S. Для гетерогенных
процессов
или единицу поверхности S. Для гетерогенных
процессов
![]() .
Зависимость скорости реакции от
концентрации реагирующих веществ
записывается в виде
.
Зависимость скорости реакции от
концентрации реагирующих веществ
записывается в виде
![]() (8)
(8)
где ni (i=1, 2, ..., m) - порядок реакции по веществу Ai; k - константа скорости химического процесса, выражаемая уравнением Аррениуса (k = k0 exp (-E / RT) через энергию активации Е, R - универсальная газовая постоянная; k0 - предэкспоненциальный множитель.
