304- Органическая химия_Черных В.П. и др_Х., 2007 -776с
.pdf
Глава 26
482
амидная группа первичных и вторичных амидов содержит протон, сигнал которого проявляется при 5—6,5 и 6—9,4 млн–1 соответственно.
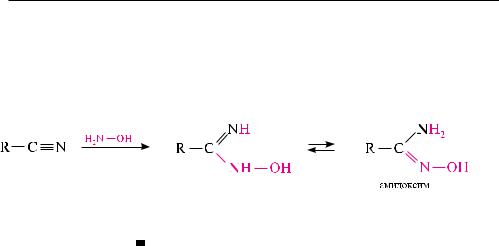
нитрилы. характерной реакцией нитрилов является их гидролиз в присутствии щелочи до карбоновых кислот с выделением аммиака. используется также реакция нитрилов с гидроксиламином. образующиеся амидоксимы дают устойчивые соли с кислотами:
вуф-диапазоне алифатические нитрилы поглощают в вакуумной области.
вик-спектре проявляется полоса средней интенсивности в области 2275— 2215 см–1, связанная с C N.
глава 27
геТерОФунКциОналЬные КарБОнОвые КислОТы
К гетерофункциональным карбоновым кислотам относятся производные карбоновых кислот, в углеводородном радикале которых один или несколько атомов водорода замещены на другие атомы или группы атомов — галоген, гидроксигруппу, аминогруппу, карбонильную группу и др.
наиболее важными гетерофункциональными карбоновыми кислотами являются галогенокарбоновые кислоты (галогенокислоты), гидроксикарбоновые кис-
лоты (гидроксикислоты), оксокарбоновые кислоты (альдегидо- и кетокислоты)
и аминокарбоновые кислоты (аминокислоты).
27.1. галОгенОКарБОнОвые КислОТы
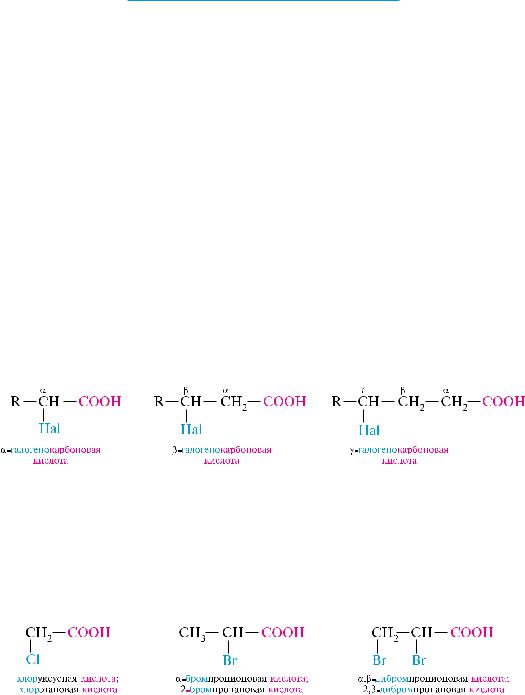
Галогенокарбоновыми кислотами называют производные карбоновых кислот, в углеводородном радикале которых один или несколько атомов водорода замещены атомами галогенов.
По природе углеводородного радикала различают алифатические, алицикли-
ческие и ароматические галогенокарбоновые кислоты. в зависимости от взаимного расположения атома галогена и карбоксильной группы выделяют - - - и другин алифатические галогенокислоты:
27.1.1. нОменКлаТУра
номенклатура галогенокарбоновых кислот аналогична номенклатуре карбоновых кислот (см. с. 424). в тривиальных названиях галогенокислот положение атома галогена относительно карбоксильной группы обозначают греческими буквами и т. д. в систематических названиях положение атома галогена указывают с помощью цифровых локантов, причем нумерацию начинают с атома углерода карбоксильной группы:
Глава 27
484
27.1.2. СПОСОБЫ ПОлУЧенИя
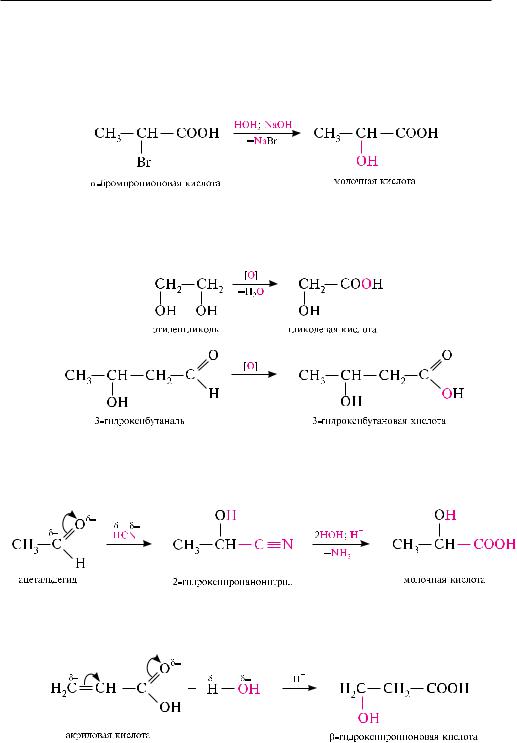
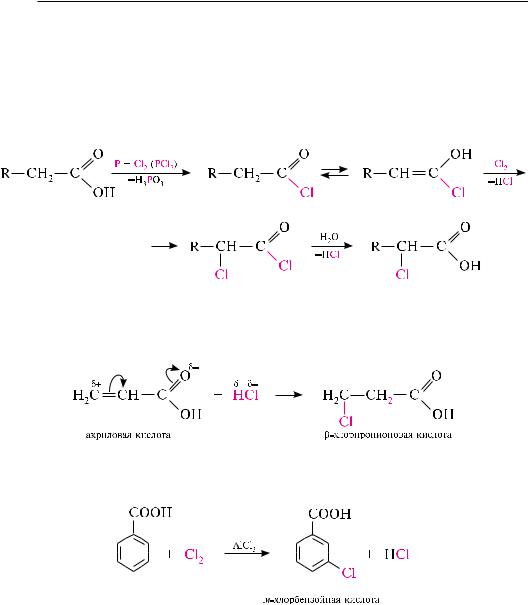
Галогенирование карбоновых кислот (реакция Гелля—Фольгарда—Зелинского).
При действии на карбоновые кислоты хлора или брома в присутствии каталитических количеств красного фосфора или фосфора (ІІІ) галогенидов образуются-хлор- или -бромкарбоновые кислоты. реакция протекает через стадию образования галогенангидрида кислоты, который, вследствие –I-эффекта атома галогена, галогенируется значительно легче, чем сама кислота:
Присоединение галогеноводородов к -ненасыщенным кислотам. При взаимо-
действии -ненасыщенных карбоновых кислот с галогеноводородами образуются -галогенокарбоновые кислоты. Присоединение галогеноводородов протекает против правила Марковникова (см. с. 438):
Галогенирование аренкарбоновых кислот. бензойная кислота галогенируется в условиях электрофильного замещения с образованием главным образом м-га- логенобензойных кислот:
27.1.3. ФИЗИЧеСКИе И хИмИЧеСКИе СВОЙСТВа
По физическим свойствам галогенокарбоновые кислоты представляют собой бесцветные жидкости или кристаллические вещества, растворимые в воде.
в химическом отношении для них характерны реакции с участием карбоксильной группы и реакции с участием атома галогена.
реакции по карбоксильной группе. введение атома галогена в углеводородный радикал карбоновой кислоты приводит к повышению кислотных свойств. Это обусловлено электроноакцепторным влиянием атома галогена, который, обладая отрицательным индуктивным эффектом, смещает электронную плотность
ГеТерОФУнКЦИОналЬнЫе КарБОнОВЫе КИСлОТЫ
485
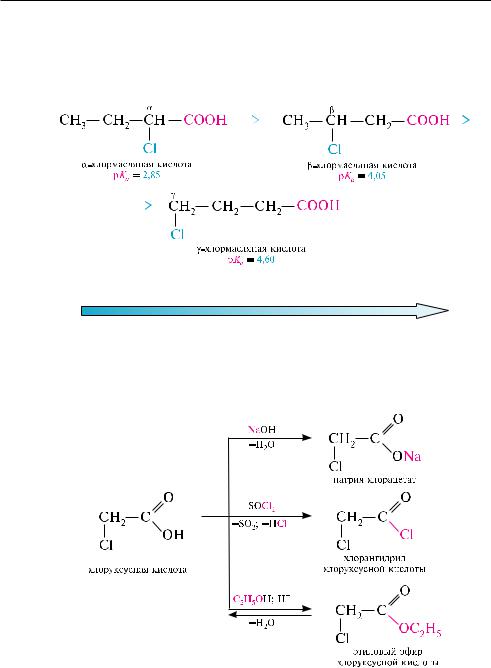
с атома углерода карбоксильной группы и тем самым повышает устойчивость аниона. например, константа кислотности pKa уксусной кислоты в водном растворе составляет 4,76, а хлоруксусной — 2,86. По мере удаления атома галогена от карбоксильной группы индуктивный эффект затухает и поэтому кислотность уменьшается, то есть сила кислот снижается в ряду и т. д.:
кислотность
При переходе от моно- к ди- и полигалогенокарбоновым кислотам кислотность увеличивается. наиболее сильной карбоновой кислотой является трифтор-
уксусная F3C—COOH (pKa = 0,23).
Галогенокислоты образуют все описанные в главе 26 функциональные производные — соли, галогенангидриды, сложные эфиры, амиды и др.:
реакции с участием атома галогена. алифатические галогенокарбоновые кислоты с участием атома галогена вступают в различные реакции нуклеофильного замещения, свойственные галогенопроизводным углеводородов. -Галогенокар- боновые кислоты значительно более реакционноспособны, чем галогеналканы. Это связано с электроноакцепторным влиянием карбоксильной группы, которая, проявляя –I-эффект, увеличивает подвижность атома галогена. замещение протекает, как правило, по механизму SN2. так, при взаимодействии галогенокарбо-
Глава 27
48
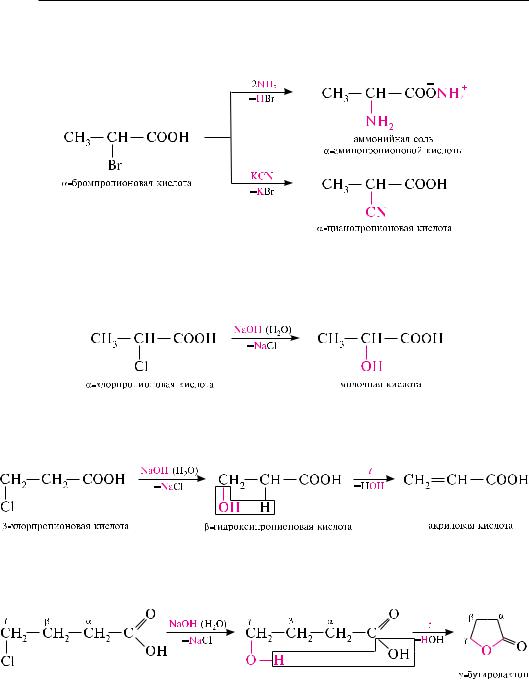
новых кислот с аммиаком, первичными или вторичными аминами образуются аминокислоты, при действии калия или натрия цианида — цианокарбоновые кислоты:
отношение алифатических галогенокислот к водным растворам щелочей зависит от взаимного расположения атома галогена и карбоксильной группы.
-Галогенокарбоновые кислоты при действии водных растворов щелочей образуют -гидроксикислоты:
-Галогенокарбоновые кислоты в присутствии водных щелочей образуют-гидроксикислоты, которые при нагревании отщепляют воду и превращаются в -ненасыщенные кислоты:
- и -Галогенокислоты в этих условиях сначала образуют - или -гидрокси- кислоты, которые при нагревании отщепляют воду, образуя - или соответственно -лактоны — внутримолекулярные (циклические) сложные эфиры:
в ряду ароматических галогенокарбоновых кислот нуклеофильное замещение атома галогена протекает в более жестких условиях. более реакционноспособными являются атомы галогенов, расположенные в орто- или пара-положении по отношению к карбоксильной группе (активированные атомы галогенов рассмотрены на с. 273). так, о-хлорбензойная кислота при нагревании с анилином в присутствии CuO и K2CO3 образует N-фенилантраниловую кислоту:

ГеТерОФУнКЦИОналЬнЫе КарБОнОВЫе КИСлОТЫ
487
27.1.4. ОТДелЬнЫе ПреДСТаВИТелИ. ПрИмененИе
хлоруксусные кислоты. Хлоруксусная кислота ClCH2—COOH — кристалличе-
ское вещество (т. пл. 62 °с). используется в производстве карбоксиметиленцеллюлозы, гербицидов, комплексонов.
Дихлоруксусная кислота Cl2CH—COOH — низкоплавкое вещество (т. пл. 13 °с, т. кип. 194 °с). используется в органическом синтезе.
Трихлоруксусная кислота Cl3C—COOH — гигроскопическое вещество (т. пл. 58 °с). Применяется в органическом синтезе; ее натриевая соль используется в качестве гербицида.
-Бромизовалериановая кислота (2-бром-3-метилбутановая кислота) (CH2)3CHCHBr—COOH — кристаллическое вещество (т. пл. 44 °с).
Уреид -бромизовалериановой кислоты ( бромизовал) используется в медицин-
ской практике в качестве снотворного средства, а ее этиловый эфир входит в состав ряда лекарственных препаратов (корвалол, валокардин).
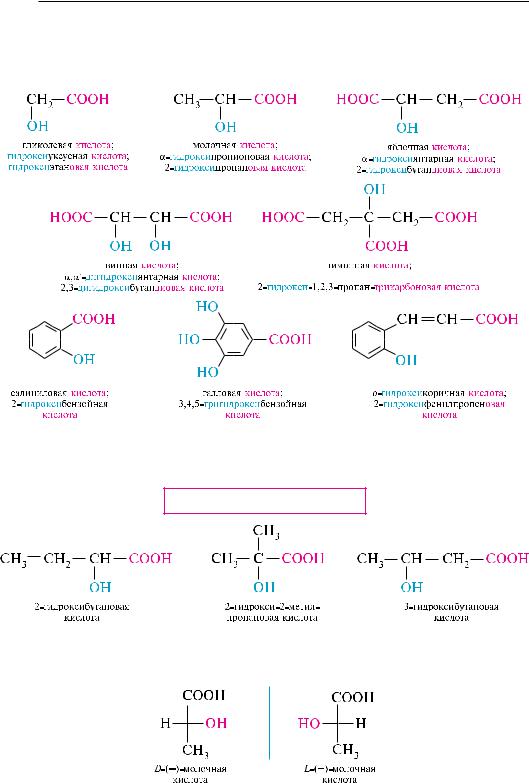
27.2. гидрОКсиКислОТы
Гидроксикислотами называют производные карбоновых кислот, содержащие
вуглеводородном радикале одну или несколько гидроксильных групп.
взависимости от природы углеводородного радикала различают алифатические гидроксикислоты (спиртокислоты) и ароматические гидроксикислоты (фенолокислоты). алифатические гидроксикислоты по взаимному расположению карбоксильной и гидроксильной групп подразделяют на - - - и другие гидроксикислоты.
число карбоксильных групп в молекуле гидроксикислоты определяет основность, а число гидроксильных групп, включая и гидроксилы, входящие в состав карбоксильных групп, характеризует атомность. так, гликолевая кислота
|
является одноосновной двухатомной кислотой, а яблочная |
кислота |
— двухосновной трехатомной кислотой. |
27.2.1. нОменКлаТУра. ИЗОмерИя
в ряду гидроксикислот широко используют эмпирические названия (гликолевая, молочная, яблочная, винная, лимонная, салициловая, галловая и др.). названия гидроксикислот образуют из тривиальных или систематических названий соответствующих карбоновых кислот и префикса гидрокси-.