
304- Органическая химия_Черных В.П. и др_Х., 2007 -776с
.pdf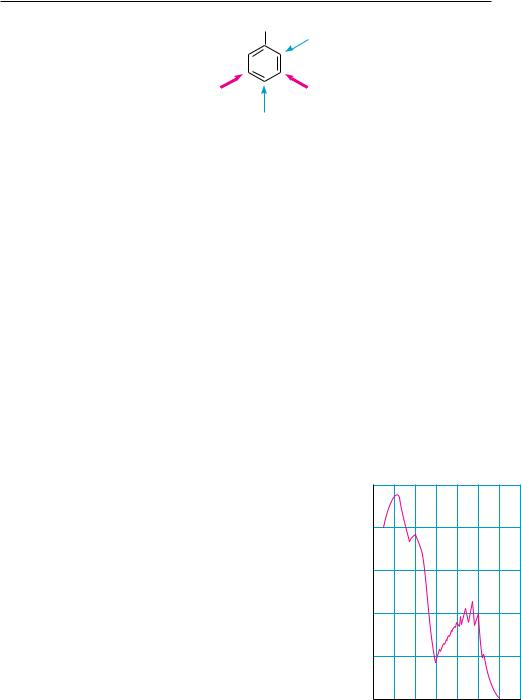
аромаТические угЛеВодороды. одноЯдерные арены
221
COOH
O2N
о-нитробензойная кислота
Следует также отметить, что наряду с электронной природой заместителей на соотношение продуктов замещения оказывают влияние пространственные факторы. При прочих равных условиях из-за стерических препятствий маловероятно вхождение третьей группы между двумя уже присутствующими заместителями.
14.7. ИДЕНТИФИКАЦИЯ МОНОЯДЕРНЫХ АРЕНОВ
Для идентификации моноядерных аренов чаще всего используют спектральные методы — УФ-, ИК-, ПМР-спектроскопию и масс-спектрометрию.
Бензолу и его гомологам присуще характерное поглощение в УФ-обла- сти: интенсивное поглощение в диапазоне 180—210 нм и малоинтенсивное — в области 230—270 нм. При высокой разрешающей способности прибора малоинтенсивная полоса проявляется в виде ряда узких пиков (тонкая структура). Малоинтенсивное поглощение в области 230—270 нм с тонкой структурой очень характерно для ароматических углеводородов, поэтому часто его называют поло-
сой бензольного поглощения (рис. 14.3).
В ИК-спектрах бензола и его гомологов имеются характерные полосы поглощения в облас-
ти 3100—3000 см–1, связанные с валентными lg ε колебаниями ароматических связей С—Н и полосы в области 1600—1500 см–1, обусловленные валентными колебаниями связей С С бензольного ядра. Наличие указанных полос свидетельствует о присутствии в структуре соединения бензольного кольца. По характеру других полос поглощения, особенно в областях 2000—1650 и 1225—950 см–1, можно установить число и взаимное расположение заместителей в бензольном ядре.
С бензольного ядра. Наличие указанных полос свидетельствует о присутствии в структуре соединения бензольного кольца. По характеру других полос поглощения, особенно в областях 2000—1650 и 1225—950 см–1, можно установить число и взаимное расположение заместителей в бензольном ядре.
Сигналы ароматических протонов в спектре ПМР бензола и его гомологов проявляются в слабом поле (δ = 6,5...8,0 млн–1). Это связано с дезэкранированием протонов за счет образующегося при действии внешнего магнитного поля кольцевого тока.
В масс-спектрах бензола и его гомологов наблюдается интенсивный пик молекулярного иона.
Глава 14
222
14.8. ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ. ПРИМЕНЕНИЕ
Бензол. Бесцветная жидкость с характерным запахом (т. кип. 80,1 °С), нерастворим в воде, горит сильно коптящим пламенем. Бензол сильно ядовит. В химической промышленности широко используется в качестве растворителя и исходного сырья для производства стирола, фенола, циклогексана, анилина, красителей, лекарственных препаратов.
Толуол (метилбензол). Бесцветная жидкость с характерным запахом (т. кип. 110,6 °С). Толуол практически нерастворим в воде, смешивается с этиловым спиртом и диэтиловым эфиром. Применяется в производстве лаков, типограф-
Фуллерены
В октябре 1996 года Харольд В. Крото (Великобритания), Ричард Смолли и Роберт Керл (США) были удостоены Нобелевской премии за открытие новой модификации
углерода — С60.
Соединение С60 было названо «бакминстерфуллерен» или «баки-болл» в честь известного архитектора Бакминстера Фуллера. Он разработал необычные сферические здания, основным фрагментом которых являются повторяющиеся гексагональные фрагменты. Для того, чтобы геометрическое тело приобрело сферическую поверхность, необходимо в определенные положения ввести пятиугольные фрагменты.
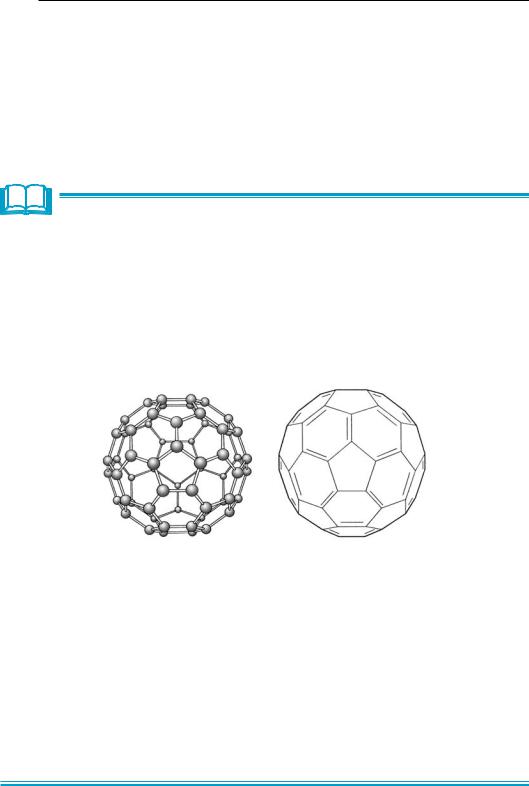
Структура С60 напоминает футбольный мяч, сшитый из 20 шести- и 12 пятиугольных фрагментов.
Молекула фуллерена С60.
В молекуле фуллерена sp2-гибридизованные углеродные атомы образуют σ-связи
стремя соседними атомами углерода. В результате перекрывания негибридизованных
2pz-орбиталей формируется делокализованная МО. Каждый углеродный атом предоставляет в систему делокализованных МО по одному электрону. Таким образом, 20 шестиугольных
циклов в составе С60 являются бензольными кольцами. Наличие таких колец — аргумент, объясняющий устойчивость новой модификации углерода.
Возникло представление о группе соединений под названием «фуллерены» как о новой группе ароматических соединений. Они более реакционноспособны по сравнению
саренами. Вступают в реакции нуклеофильного присоединения, что не характерно для аренов.
Фуллерены С60 обладают высоким электронным сродством и легко акцептируют электроны из щелочных металлов. Получена соль С60К, обладающая сверхпроводящими свойствами.
Исследования в области фуллеренов продолжаются.

аромаТические угЛеВодороды. одноЯдерные арены
223
ских красок, бензойной кислоты, взрывчатых веществ, лекарственных препаратов
идр. Используется в качестве добавки к моторному топливу для повышения октанового числа бензинов. Обладает слабым наркотическим действием.
ксилолы (о-, м- и п-диметилбензолы). Бесцветные жидкости с запахом бензола. Смешиваются с этанолом, диэтиловым эфиром, ацетоном, хлороформом, бензолом. Смесь изомерных ксилолов, так называемый технический ксилол, (т. кип. 138—144 °С), используется в промышленности в качестве растворителя
ивысокооктановой добавки к моторным топливам.
стирол (винилбензол). Бесцветная жидкость со своеобразным запахом, (т. кип. 145,2 °С). Используется в производстве полистирола, синтетического каучука.
кумол (изопропилбензол). Бесцветная жидкость (т. кип. 152,4 °С). Нерастворим в воде, смешивается с этанолом, диэтиловым эфиром, бензолом. Используется в производстве фенола и ацетона.
n-Цимол (1-изопропил-4-метилбензол). Бесцветная жидкость с приятным запахом (т. кип. 177,4 °С). Нерастворим в воде, растворяется в этаноле, хлороформе, ацетоне, диэтиловом эфире. Входит в состав жирных масел многих растений.
Глава 15
МНОГОЯДЕРНЫЕ АРЕНЫ С КОНДЕНСИРОВАННЫМИ (АННЕЛИРОВАННЫМИ) БЕНЗОЛЬНЫМИ ЦИКЛАМИ
Многоядерные арены с конденсированными циклами содержат в своем составе два или более бензольных ядра, имеющие общие атомы углерода.
В зависимости от способа сочленения циклов различают два основных типа конденсированных систем:
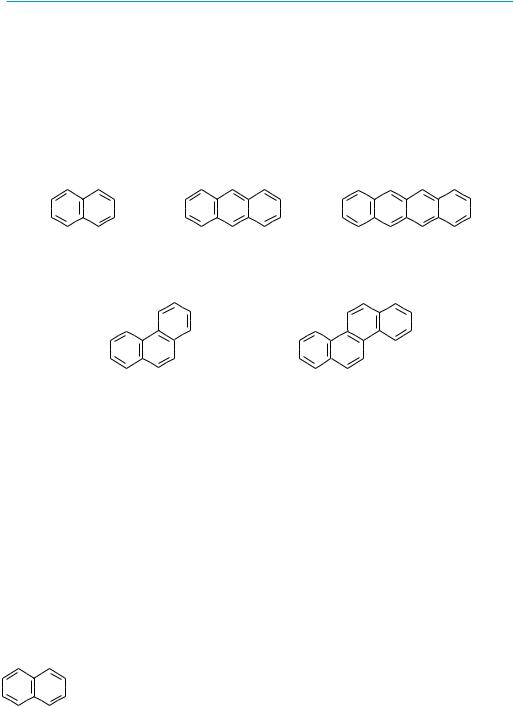
конденсированные системы с линейным расположением циклов:
нафталин |
антрацен |
тетрацен |
конденсированные системы с ангулярным (от англ. angel — угол) расположением циклов:
фенантрен |
хризен |
Наиболее важными представителями конденсированных аренов являются на-
фталин, антрацен и фенантрен.
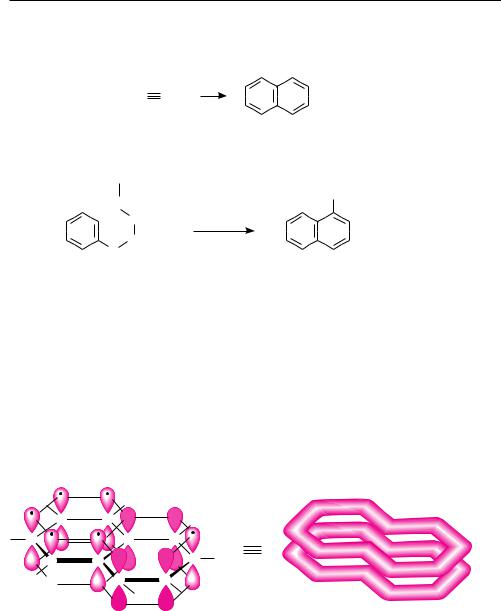
15.1. НАФТАЛИН
Впервые нафталин выделен из каменноугольной смолы в 1819 году. Элементный состав его молекулы установлен русским химиком Александром Абрамовичем Воскресенским в 1838 году, а строение доказано немецким химиком Карлом Гребе в 1898-м.
15.1.1. номенкЛаТура. изомериЯ
Молекула нафталина состоит из двух конденсированных бензольных колец. Нумерацию углеродных атомов нафталинового ядра проводят в соответствии с правилами IUPAC.
|
α |
α |
|
|
В молекуле нафталина, в отличие от бензола, углеродные атомы |
β 7 |
8 |
1 |
2 |
β |
не равнозначны. Атомы углерода в положениях 1, 4, 5, 8 принято |
|
обозначать буквой α и называть α-положения, а в положениях 2, 3, |
||||
6 |
5 |
4 |
3 |
β |
|
β |
|
6, 7 — буквой β и называть соответственно β-положения. |
|||
|
α |
α |
|
|
многоЯдерные арены с конденсироВанными БензоЛьными ЦикЛами
225
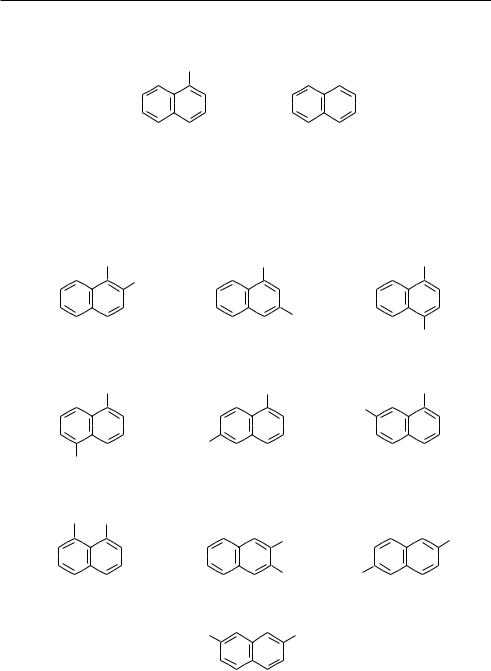
Вследствие неравнозначности положений однозамещенные нафталины существуют в виде α- и β-изомеров:
CH3
 CH3
CH3
α-метилнафталин; |
β-метилнафталин; |
1-метилнафталин |
2-метилнафталин |
В номенклатуре дизамещенных нафталина наряду с цифровыми локантами положений заместителей применяют также обозначения: орто-положение — 1,2;
мета – 1,3; пара – 1,4; ана – 1,5; пери – 1,8; амфи – 2,6.
Двухзамещенные нафталины с одинаковыми заместителями могут существо-
вать в виде десяти изомеров положения:
CH3 |
CH |
CH3 |
|
CH3 |
3 |
|
|
|
|
||
|
CH3 |
CH3 |
|
1,2-диметилнафталин; |
1,3-диметилнафталин; |
||
1,4-диметилнафталин; |
|||
î-диметилнафталин |
ì-диметилнафталин |
ï-диметилнафталин |
|
CH3 |
CH3 |
CH3 |
Í3C
Í3C
CH3
1,5-диметилнафталин; 1,6-диметилнафталин 1,7-диметилнафталин àíà-диметилнафталин
CH3 CH3 |
CH3 |
CH3 |
|
||
|
CH3 |
Í3C |
1,8-диметилнафталин; |
2,3-диметилнафталин |
2,6-диметилнафталин; |
ïåðè-диметилнафталин |
|
àìôè-диметилнафталин |
Í3C CH3
2,7-диметилнафталин
15.1.2.сПосоБы ПоЛучениЯ
Нафталин, его монометильные и некоторые диметильные производные в промышленности получают, главным образом, из каменноугольной смолы (содержание нафталина в каменноугольной смоле составляет около 10 %).
многоЯдерные арены с конденсироВанными БензоЛьными ЦикЛами
227
α- и β-атомами углерода больше напоминают двойные (длина связи 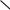 С—С
С—С в алкенах 0,134 нм). Вследствие разной длины углерод-углеродных связей в молекуле нафталина π-электронная плотность распределена неравномерно. Электронная плотность у α-атомов углерода выше, чем у β-атомов. Соответственно
в алкенах 0,134 нм). Вследствие разной длины углерод-углеродных связей в молекуле нафталина π-электронная плотность распределена неравномерно. Электронная плотность у α-атомов углерода выше, чем у β-атомов. Соответственно
иэнергия сопряжения нафталина (255,2 кДж/моль) значительно меньше удвоенной энергии сопряжения бензола (2·150,7 = 301,4 кДж/моль). Поэтому нафталин легче, чем бензол, вступает в реакции замещения, присоединения, окисления
ивосстановления.
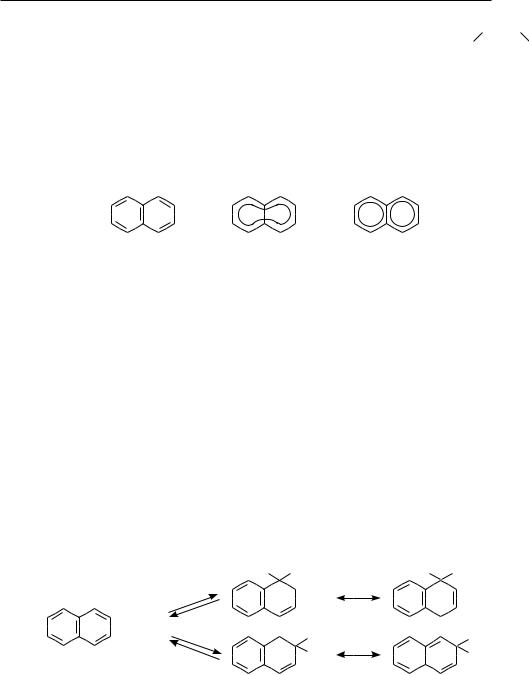
Для изображения молекулы нафталина в химической литературе применяют структурные формулы I—III.
I.II. III.
Применение формулы III малооправдано, так как нафталин не содержит в своей структуре двух независимых замкнутых сопряженных систем бензола.
15.1.4. химические сВоЙсТВа
Для нафталина, как и бензола, характерны реакции электрофильного замеще-
ния, присоединения, восстановления и окисления.
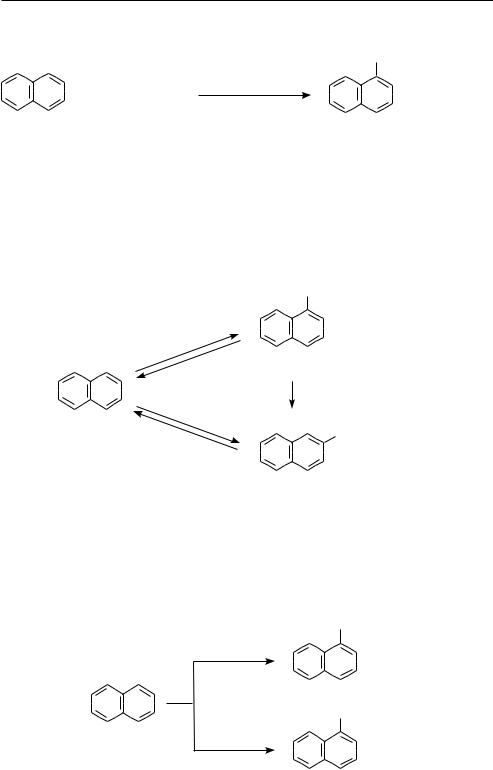
реакЦии ЭЛекТроФиЛьного замещениЯ (SE)
В реакции электрофильного замещения нафталин вступает легче, чем бензол.
При взаимодействии с электрофильными реагентами образуются преимущественно продукты α-замещения.
Предпочтительное направление замещения в α-положение обусловлено тем, что, во-первых, в α-положении нафталина электронная плотность выше, чем в β-положении (статический фактор), а во-вторых, при атаке электрофила в α-положение образуется более стабильный, и, следовательно, энергетически более выгодный для молекулы σ-комплекс, чем при атаке в β-положение (дина-
мический фактор):
|
H |
E |
H |
E |
-атака |
|
+ |
|
|
|
|
|
|
|
α |
|
|
|
|
+ E+ |
+ |
H |
+ |
H |
β- |
|
|
||
|
E |
|
E |
|
атака |
|
+ |
||
|
|
|
|
|
Из приведенной схемы видно, |
что |
при |
электрофильном |
замещении |
в α-положении образуется σ-комплекс, в котором положительный заряд может быть делокализован без нарушения ароматической системы соседнего кольца, тогда как в образующемся σ-комплексе при замещении в β-положении делокализация положительного заряда возможна только за счет нарушения ароматической системы соседнего кольца, что влечет за собой дополнительную затрату энергии.
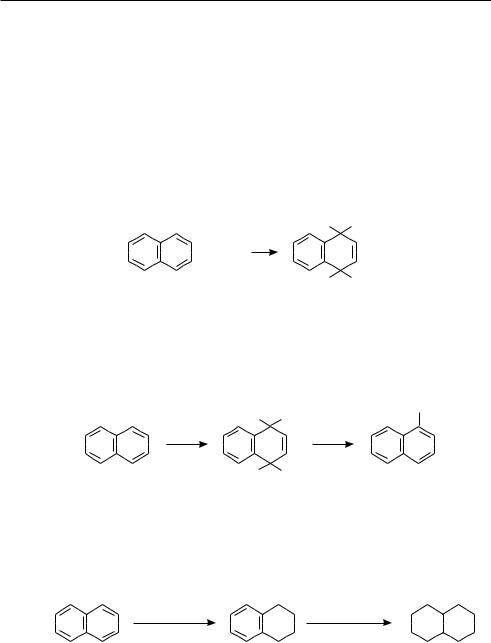
многоЯдерные арены с конденсироВанными БензоЛьными ЦикЛами
229
алкилирование и ацилирование. В присутствии кислот Льюиса (AlCl3, SnCl4
и др.) нафталин взаимодействует с галогеналканами и галогенангидридами карбоновых кислот с образованием смеси α- и β-замещенных изомеров.
реакЦии ПрисоединениЯ
Нафталин значительно легче бензола вступает в реакции присоединения, так как связи между α- и β-атомами углерода в молекуле нафталина имеют большую непредельность, чем связи С С в бензоле.
С в бензоле.
Так, при обычной или пониженной температуре в отсутствие катализатора нафталин присоединяет молекулу хлора с образованием продукта 1,4-присоеди- нения:
H Cl
+ Cl2
H Cl
1,4-дихлор-1,4-дигидронафталин
Рассмотренная выше (см. с. 228) реакция бромирования нафталина происходит по схеме присоединения-отщепления, то есть вначале бром присоединяется в положения 1 и 4, а затем продукт присоединения при нагревании отщепляет бромоводород, образуя α-бромнафталин:
H |
Br |
Br |
|
||
Br2 |
|
t |
–HBr
HBr
1,4-дибром-1,4-дигидронафталин α-бромнафталин
В присутствии катализатора Ni нафталин значительно легче, чем бензол, присоединяет водород. Процесс гидрирования нафталина протекает ступенчато. Сначала при температуре 150 °С образуется 1,2,3,4-тетрагидронафталин (тетралин), который при 200 °С гидрируется далее с образованием декагидронафталина
(декалина):
H2/Ni; 150 °C |
H2/Ni; 200 °C |
тетралин |
декалин |
окисЛение
Нафталин окисляется гораздо легче, чем бензол. В зависимости от условий окисления, образуются разные продукты. При окислении нафталина кислородом воздуха в присутствии катализатора V2O5 образуется ангидрид фталевой кислоты. Действием хрома (VI) оксида в уксусной кислоте нафталин окисляется до 1,4-нафтохинона:



 H
H

 C H
C H H
H  H
H