
Preparaty_-_proizvodnye_tsiklopentanpergidrofenantrena__1
.pdfгруппой. Эстрогенные препараты проявляют с помощью реактивов на фенольный гидроксил – с солями диазония в щелочной среде, реактивом Гиббса и др.
Выбор системы растворителей зависит от структурных особенностей молекулы стероидных гормонов, наличия функциональных групп, влияющих на хроматографическое поведение стероидных соединений. Чаще всего для идентификации различных классов стероидных гормонов в фармакопейных и нефармакопейных методиках используются следующие системы растворителей:
–производные андростана и гестагены:
хлороформ – ацетон (9 : 1); бензол – ацетон (9 : 1); гексан – ацетон (7 : 3); бензол – этилацетат (8 : 2);
циклогексан – этилацетат (1 : 1);
–кортикостероиды:
хлороформ – метиловый спирт – вода (95 : 5 : 0,2); хлористый метилен – метиловый спирт – вода (95 : 5 : 0,4);
хлористый метилен – эфир – метиловый спирт – вода (77 : 15:8: 0,4); дихлорметан – эфир – метиловый спирт – вода (77 : 15:8: 1,2); хлороформ – ацетон (3:2); н-бутанол – толуол – эфир (5 : 10 :85);
– эстрогены:
гептан – ацетон (8 : 2); гексан – ацетон (7 : 3);
циклогексан – этилацетат – ацетон (75 : 25 : 10); бензол – этилацетат (8 : 2); бензол – эфир – ацетон (50 : 50 : 1); толуол – этиловый спирт (8 : 2).
Подлинность определяется путем сравнения хроматографической подвижности анализируемого и стандартного образца стероидных гормонов. Основное пятно исследуемого стероидного соединения по положению
ицвету должно полностью совпадать с пятном стандартного образца.
Вслучае определения наличия специфических примесей (посторонние стероиды), которые представлены исходными продуктами и полупродуктами синтеза, продуктами гидролитического расщепления и т.д., на пластинку наносится определенное количество стандартного образца препарата, в котором содержатся допустимые количества примесей или рабочего стандартного образца данной примеси. Это позволяет проводить количест-
31
венную оценку содержания примесей с помощью визуального или денситометрического определения, а также методом спектрофотометрии после элюирования вещества из слоя сорбента. Условия определения посторонних стероидов в некоторых препаратах стероидных гормонов представлены в табл. 2.
Таблица 2
Определение посторонних стероидов в субстанциях и лекарственных формах стероидных гормонов методом ТСХ
Препарат |
Система |
Стандартный |
Результат |
||
растворителей |
образец |
||||
|
|
||||
1 |
2 |
|
3 |
4 |
|
|
Производные |
андростана – субстанции |
|
||
Тестостерона |
бутилацетат – петро- |
Тестостерона |
Содержание тестостерона |
||
лейный эфир – безвод- |
пропионат |
||||
пропионат (ЕФ, |
ная уксусная кислота |
Тестостерона |
ацетата не должно |
||
ст. 297) |
(70 : 30 : 1) |
|
ацетат |
превышать 1 %. |
|
|
|
|
|||
|
бутилацетат – петро- |
|
|
||
Метилтесто- |
лейный эфир – |
Метилтесто- |
Суммарное содержание |
||
стерон (ЕФ, ст. |
безводная уксусная ки- |
стерон |
примесей не должно пре- |
||
410) |
слота |
Тестостерон |
вышать 1 %. |
||
|
(70 : 30 : 1) |
|
|
|
|
Этистерон (ЕФ, |
хлороформ – метиловый |
Этистерон |
Не должно быть дополни- |
||
ст. 142) |
спирт |
тельных пятен, кроме ос- |
|||
(95 : 5) |
|
|
новного пятна. |
||
|
|
|
|||
Норэтистерон |
хлороформ – ацетон |
Этистерон |
Содержание этистерона |
||
(ЕФ, ст. 234) |
(9:1) |
|
не должно |
||
|
|
|
превышать 0,5 %. |
||
|
|
|
|
||
|
|
|
|
|
|
Левоноргестрел |
дихлорметан – этилаце- |
Левоноргестрел |
Суммарное содержание |
||
(ЕФ, ст. 926) |
тат |
примесей не должно пре- |
|||
(8:2) |
|
|
вышать 0,2 %. |
||
|
|
|
|||
|
|
|
|
|
|
|
Гестагены |
– субстанции |
|
||
Прогестерон |
хлороформ – этилаце- |
|
Прогестерон |
Суммарное содержание |
|
(ЕФ, ст. 429) |
тат |
|
примесей не должно пре- |
||
(66 : 33) |
|
|
вышать 1 %. |
||
|
|
|
|||
|
|
|
|
|
|
|
Кортикостероиды – субстанции |
|
|||
Гидрокортизона |
хлороформ – метиловый |
Гидрокортизон |
Кроме основного пятна, |
||
ацетат |
спирт – вода |
Гидрокортизона |
должно появиться не бо- |
||
( ФС 42-2554- |
|||||
(95 : 5 : 0,2) |
|
ацетат |
лее 4 посторонних пятен. |
||
95) |
|
||||
|
|
|
|
||
|
|
|
|
|
|
|
|
|
32 |
|
|
|
|
|
Окончание табл. 2 |
|
1 |
2 |
3 |
4 |
|
|
|
|
|
|
Гидрокортизона |
хлороформ – метиловый |
|
Суммарное содержание |
|
ацетат |
спирт – вода |
Гидрокортизон |
примесей не должно |
|
(НД 42-10579- |
||||
(180 : 15 :1) |
|
превышать 2 %. |
||
99) |
|
|||
|
|
|
||
|
хлористый метилен – |
|
Кроме основного пятна, не |
|
Триамцинолон |
эфир – метиловый |
Триамцинолон |
более двух |
|
(ФС 42-3115-95) |
спирт – вода |
посторонних |
||
|
||||
|
(77: 15 : 8 : 1) |
|
пятен. |
|
Флюоцинолона |
Дихлорметан – эфир – |
|
Суммарное содержание |
|
ацетонид (ЕФ, |
метиловый |
Флюоцинолона |
примесей не должно пре- |
|
ст. 494) |
спирт – вода |
ацетонид |
вышать 2 %. |
|
(77 : 15 : 8 : 1,2) |
|
|||
|
|
|
||
|
Лекарственные |
формы кортикостероидов |
|
|
Гидрокортизона |
|
|
|
|
ацетата |
хлороформ – метиловый |
Гидрокортизона аце- |
Суммарное содержание |
|
суспензия 2,5 % |
спирт – вода |
примесей не должно пре- |
||
для инъекций |
(95 : 5 : 0,2) |
тат |
вышать 4 %. |
|
|
||||
(ФС 42-2896-99) |
|
|
|
|
Кортизона аце- |
хлороформ – метиловый |
Кортизона |
Суммарное содержание |
|
тата таблетки по |
спирт – вода |
примесей не должно пре- |
||
0,025 и 0,05 г |
ацетат |
|||
(95 : 5 : 0,2) |
вышать 3 %. |
|||
(ФС 42-3424-97) |
|
|||
|
|
|
||
Метилпреднизо- |
|
|
Кроме основного пятна |
|
лон – лиофил. |
хлороформ – этилаце- |
|
||
Метилпредни- |
(Rf = 0,6), наблюдается |
|||
порошок для |
тат – ацетон – уксусная |
|||
инъекций (НД |
кислота (60 : 15 : 28 : 8) |
золон |
дополнительное пятно с |
|
|
Rf = 0,5. |
|||
42-8021-97) |
|
|
||
|
|
|
||
|
Эстрогены |
– субстанции |
|
|
Эстрадиола бен- |
толуол – этиловый |
Эстрадиола |
Суммарное содержание |
|
зоат (ЕФ, ст. |
спирт (8 : 2) |
бензоат |
примесей не должно пре- |
|
139) |
вышать 1 %. |
|||
|
|
|||
|
|
|
|
|
|
|
|
Суммарное содержание |
|
Этинилэстради- |
толуол – этиловый |
Этинилэстрадиол |
примесей не должно пре- |
|
ол (ЕФ, ст. 140) |
спирт (9 : 1) |
Эстрон |
вышать 1 %. Содержание |
|
|
|
|
эстрона – не более 0,5 %. |
|
|
|
|
|
|
Местранол (ЕФ, |
толуол – этиловый |
|
Суммарное содержание |
|
Местранол |
примесей не должно пре- |
|||
ст. 509) |
спирт (9 : 1) |
|||
|
вышать 1% |
|||
|
|
|
||
|
|
|
|
|
|
|
33 |
|
Высокоэффективная жидкостная хроматография (ВЭЖХ). ВЭЖХ является одним из ценных аналитических методов разделения и количественного определения стероидных гормонов. Метод включен в 9 статей на субстанции стероидных гормонов ЕФ (ципротерона ацетат, дезоксикортона ацетат, дексаметазон, эстрадиол, гидрокортизон, преднизон и др.). Основными преимуществами ВЭЖХ в анализе доброкачественности субстанций и лекарственных форм стероидных гормонов являются:
–универсальность, что позволяет подобрать хроматографические системы для разделения всех классов стероидных гормонов;
–простота в приготовлении анализируемых образцов;
–возможность разделения изомеров, например, определение примеси α-эстрадиола в эстрадиоле и бетаметазона в дексаметазоне.
Рассмотрим основные экспериментальные параметры, включенные в НД для анализа субстанций и лекарственных форм стероидных гормонов методом ВЭЖХ.
Тип сорбента и размеры хроматографической колонки. Для опре-
деления профиля примесей стероидных гормонов используются адсорбционные (нормально-фазный режим) и распределительные (обращено-фазный режим) хроматографические системы. В качестве адсорбентов нормальнофазного режима разделения чаще всего используется силикагель с малым размером частиц (5–10 нм), а обращено-фазного – силикагель с привитыми
молекулами октадецилсилана (Кизельгель C18, Бондапак C18, Сепарон C18 и
др.).
Для хроматографического разделения в режиме высокого давления используются стальные колонки длиной 10–25 см с внутренним диаметром
0,3–0,5 см.
Состав элюента и характер элюирования. Для элюирования стеро-
идных гормонов в обращено-фазном режиме ВЭЖХ используются полярные элюенты. Как правило, это 30–40% водные растворы ацетонитрила, а также их смеси с уксусной кислотой или метанолом.
Вадсорбционном варианте ВЭЖХ в качестве элюентов используют смеси: метанол – хлороформ (5 : 70), хлористый бутил – насыщенный водный раствор хлористого бутила – тетрагидрофуран – метанол – безводная уксусная кислота (475 : 475 : 70 : 35 : 30) и др.
Чаще всего используется изократический режим элюирования.
Тип детектора. Для детектирования стероидных гормонов универ-
сальным является УФ-детектор с переменной или фиксированной длиной волны. Детектирование 4- и 1,4-3-кетостероидов (андрогены, анаболики,
34
гестагены и кортикостероиды) проводят при длине волны 254 нм, для эстрогенов выбирают, как правило, специфическую длину волны – 280 нм.
Чувствительность ВЭЖХ существенно увеличивается при использовании электрохимического детектора (предел обнаружения 1 нг). Если эстрогены хроматографировать в виде флюоресцирующих дансилпроизводных, то предел обнаружения составляет ниже 0,05 нг.
5.1.2. Химические методы
Стероидные гормоны содержат в своей структуре ограниченный набор функциональных групп и функциональных фрагментов, пригодных для проведения функционального анализа.
Наличие стероидного цикла в структуре препаратов подтверждается концентрированной серной кислотой, которая является общим внутригрупповым специфическим реактивом. По окраске продуктов реакции, наличию или отсутствию флюоресценции в УФ-области спектра, изменению окраски после добавления воды (МФ III, ЕФ-1997, НД) или хлороформа (ГФ) можно отличить даже близкие по структуре лекарственные средства группы стероидных гормонов.
Методики проведения данной реакции отличаются, так, МФ и ЕФ рекомендует навеску препарата (1–2 мг) растворить в 2 мл концентрированной серной кислоты и через 5 мин должна появиться характерная окраска и
внекоторых случаях флюоресценция в УФ-свете. После чего необходимо добавить 10 мл воды, встряхнуть и зафиксировать изменение окраски и флюоресценции (см. табл. 3).
При испытании подлинности этистерона (прегнина) и норэтистерона методика проведения реакции модифицируется: 2 мг препарата растворяют
в2 мл безводного этанола и добавляют 2 мл концентрированной серной кислоты, смесь нагревают на водяной бане при температуре 70 °С; наблюдают сине-фиолетовое окрашивание с красной флюоресценцией (этистерон) или голубовато-фиолетовое окрашивание с красной флюоресценцией (норэтистерон).
ВГФ на препараты стероидных гормонов реакция с концентрированной серной кислотой используется в трех вариантах: 1) без добавления воды, 2) с добавлением воды и 3) с добавлением воды и хлороформа (см. табл. 4 и 5).
Значительные различия в окраске продуктов реакции с концентрированной серной кислотой для препаратов стероидных гормонов, согласно требованиям ГФ и ЕФ, можно объяснить более высокими требованиями, предъявляемыми ЕФ, к чистоте препаратов (посторонние стероиды).
35

Таблица 3
Окраска продуктов реакции препаратов стероидных гормонов концентрированной серной кислотой (МФ и ЕФ)
|
После добавления концентриро- |
||
Лекарственное |
ванной серной кислоты |
||
вещество |
окраска |
флюоресцен- |
|
|
ция |
||
|
|
||
Дексаметазон |
красно-коричневая |
нет |
|
Гидрокортизон |
красно-коричневая |
зеленая |
|
Кортизона ацетат |
желтая |
нет |
|
Преднизон |
желтая |
синяя |
|
Преднизолон |
красная |
красно- |
|
коричневая |
|||
|
|
||
|
|
|
|
Дезоксикортикор- |
желтая |
нет |
|
тона ацетат |
|||
|
|
||
Этинилэстрадиол |
оранжево-красная |
зеленая |
|
|
|
|
|
Местранол |
красная |
зеленовато- |
|
желтая |
|||
|
|
||
|
|
|
|
Ципротерона ацетат |
красная |
нет |
|
После добавления воды
окраска
нет
нет
нет
нет
серый хлопьевидный осадок
голубая
фиолетовая
розовая, розовый или фиолетовый осадок
фиолетовая
флюоресценция
нет
нет
нет
нет
желтая
красная
нет
нет
нет
Таблица 4
Окраска продуктов реакции препаратов стероидных гормонов концентрированной серной кислотой (ГФ XI)
Лекарственное |
После добавления концентри- |
После добавления воды |
|||
рованной серной кислоты |
|
|
|||
вещество |
|
|
|
|
|
окраска |
флюорес- |
окраска |
флюорес- |
||
|
|||||
|
ценция |
ценция |
|||
|
|
|
|||
Этинилэстрадиол |
оранжево- |
желто-зеленая |
оранжево- |
желто- |
|
|
красная |
|
красная |
зеленая |
|
Метандриол |
желто- |
зеленая |
желто- |
слабо |
|
оранжевая |
оранжевая |
зеленая |
|||
|
|
||||
Метилтестостерон |
оранжевая |
нет |
желто- |
зеленая |
|
оранжевая |
|||||
|
|
|
|
||
Метандиенон |
красная |
нет |
– |
– |
|
Кортизона ацетат |
желтая |
желтая |
– |
– |
|
Преднизон |
зеленовато- |
желто- |
– |
– |
|
желтая |
зеленая |
||||
|
|
|
|||
Преднизолон |
|
нет |
– |
– |
|
Гидрокортизона ацетат |
желтая → |
зеленая |
– |
– |
|
|
красная |
|
|
|
|
|
|
36 |
|
|
|
Таблица 5
Окраска продуктов реакции препаратов стероидных гормонов с концентрированной серной кислотой в хлороформе по ГФ XI
|
После добавления воды |
После добавления хлоро- |
|||
Лекарственное |
форма |
||||
|
|
||||
|
|
|
|
||
вещество |
|
|
|
|
|
окраска |
флюоресцен- |
нижний слой |
верхний |
||
|
|||||
|
|
ция |
|
слой |
|
Прогестерон |
желтая |
зеленая |
б/цв |
б/цв |
|
|
|
|
|
|
|
Этистерон (прегнин) |
малиновая |
зеленая |
оранжевый |
б/цв |
|
|
|
|
|
|
|
Дезоксикортикортона ацетат |
вишневая |
зеленовато- |
желтый |
зеленый |
|
коричневая |
|||||
|
|
|
|
||
|
|
|
|
|
|
Характерной реакцией идентификации 3-кетогруппы андрогенов, гестагенов и кортикостероидов служит реакция присоединения – элиминирования при взаимодействии с аминами в кислой среде с последующим измерением температуры плавления выделившегося осадка или образованием окрашенного продукта реакции. В качестве реактивов ГФ рекомендует использовать:
–гидроксиламина гидрохлорид (образуются осадки белого цвета)
–оксим этистерона – tпл = 226–232 °С
–оксим тестостерона пропионата – tпл = 166–171 °С
–оксим метилтестостерона – tпл = 210–216 °С;
–2,4-динитофенилгидразин (образуются осадки оранжево-красного
цвета)
–3,20-бис-2,4-динитрофенилгидразон прогестерона – tпл =
= 270–275 °С;
–2,4-динитрофенилгидразон метандиенона;
–фенилгидразин (образуются осадки желтого цвета)
–фенилгидразон преднизолона
–фенилгидразон преднизона.
Фенольное кольцо А эстрогенов обнаруживают по реакции этерификации с бензоилхлоридом, например, этинилэстрадиола бензоат имеет температуру плавления 199–202 °С.
Из цветных реакций на фенольный гидроксил чаще всего используется реакция азосочетания с солями диазония, полученными на основе сульфаниловой кислоты, 3-нитроанилина, сульфатиазола и др.
37
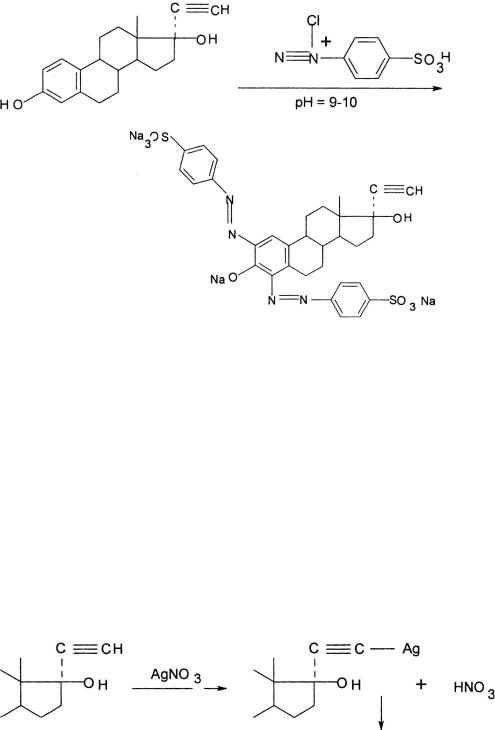
Полученный азокраситель в щелочной среде имеет вишнево-красную окраску, а в нейтральной или слабокислой среде этот продукт представляет собой оранжево-красный осадок.
Для идентификации эстрадиола или эстрадиола бензоата (ЕФ) по 1 мг препаратов смешивают с 0,5 мл свежеприготовленного раствора молибдата аммония в концентрированной серной кислоте (реактив Фреде), появляется голубое окрашивание с интенсивной зеленой флюоресценцией в УФ-свете или желтовато-зеленое окрашивание с интенсивной зеленой флюоресценцией соответственно. После добавления 1 мл концентрированной серной кислоты и 9 мл воды окраска растворов изменяется в розовую с желтоватой флюоресценцией.
Этинильный фрагмент в структуре этинилэстрадиола, прегнина и норэтистерона обнаруживается по реакции солеобразования с ионами серебра за счет подвижного атома водорода:
При использовании в качестве реактива аммиачного раствора нитрата серебра (ЕФ) и нагревании на водяной бане выпадает белый осадок ацетиленида серебра, который при дальнейшем нагревании переходит в серый, а затем на стенках пробирки образуется «серебряное зеркало».
38
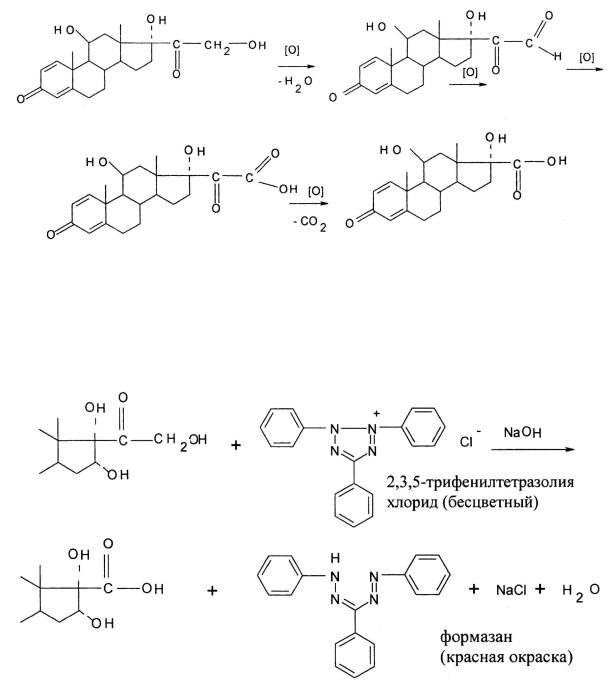
α-Кетольная группа (20-кето-21-гидроксигруппа) кортикостероидов проявляет восстановительные свойства и идентифицируется с помощью реактивов Фелинга, Несслера и Толленса, реакция протекает по схеме:
Реакция с 2,3,5-трифенилтетразолия хлоридом и тетразолиевым синим в щелочной среде также основана на восстановительных свойствах α-кетольной группы. ФС и ЕФ рекомендуют использовать ее для идентификации и количественного фотоколориметрического определения флюоцинолона ацетонида и триамцинолона в субстанции и лекарственных формах:
39
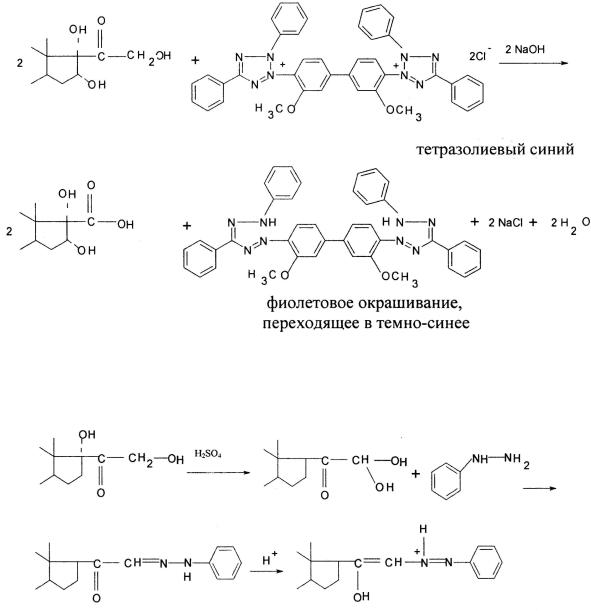
Глюкокортикоиды можно определить также реакцией с фенилгидразином в присутствии серной кислоты по появлению желтой окраски раствора.
Ковалентносвязанный фтор фторкортикостероидов (дексаметазон, бетаметазон, триамцинолон и др.) открывают по реакции с ализаринатом циркония после минерализации молекулы со спекающей смесью (KNО3-, Na2CО3).
40
