
- •Часть I
- •Решение типовых задач.
- •Однокомпонентные системы
- •Диаграмма состояния воды
- •Диаграмма состояния серы.
- •Двухкомпонентные системы.
- •Диаграмма температура - состав.
- •Криогидратные смеси.
- •Двухкомпонентные системы
- •Равновесие в системах без твердой фазы.
- •Системы жидкостей с неограниченной взаимной растворимостью.
- •4.3. Состав пара растворов.
- •4.4. Диаграмма состояния. Температура кипения растворов.
- •4.5. Перегонка растворов.
- •Правило рычага.
- •Закон распределения.
- •4.8. Экстракция.
- •5. Трехкомпонентные системы.
- •5.1. Применение правила фаз к трехкомпонентным системам.
- •5.2. Взаимная растворимость трех жидкостей.
- •Примеры решения задач
- •Диаграммы состояния.
- •Исключив m тв, получаем
- •Перегонка. Состав смеси.
- •Закон распределения. Экстракция.
- •Л ед вода пар
- •Определить в этой системе число фаз, число независимых компонентов и
- •Диаграммы состояния
Л ед вода пар
Определить число степеней свободы в системе
C aCO3 CaO + CO2
В производстве серной кислоты известна реакция получения нитрозилсерной кислоты (NOHSO4) по схеме
N2O3(газ) + 2H2SO4(75% р-р-) = 2 NOHSO4 + H2O(жидк)
Применить к системе правило фаз
К
 арбид
кальция получают по уравнению CaO(тв)
+ 3С CaC2(тв)+
CO
арбид
кальция получают по уравнению CaO(тв)
+ 3С CaC2(тв)+
CO
Определить фазовый состав и число степеней свободы системы.
Определить фазовый состав и степень свободы системы
CaC2(тв)+2 H2O(ж) = С2H2(газ) +Ca(OH)2(ТВ)
7. Цианамид кальция разлагается водой по уравнению
CaCN2(тв)+3H2O = CaCO3(тв) + 2NH3(газ)
Определить фазовый состав и степень свободы системы.
8. Цианамид кальция получают нагреванием в печи карбида кальция в
атмосфере азота по реакции CaC2(тв)+N2 = CaCN2(тв) + C.
Определить фазовый состав и степень свободы системы.
9. Карбид кремния получают нагреванием до 2000С смеси песка и угля
SiO2(тв) + 3С(тв) = SiC(тв) + 2СO(газ) + 122 ккал/моль.
Определить фазовый состав и степень свободы системы.
10. Фосфор получают по реакции
2Ca3(PO4 )2(тв) + 10C(тв) = 6CaO(тв) + P4(тв) +10CO(газ)
которая протекает при 1 атм и 1385С с поглощением большого коли-
чества тепла (H = 837,7 кал). Определить фазовый состав и степень
свободы системы.
Определить вариантность системы, состоящей из раствора К2SO4 и
Na2SO4 в воде, в присутствии паров воды и кристаллов обеих солей.
Определить вариантность системы, состоящей из раствора К2SO4 и
NaCl в воде, в присутствии кристаллов обеих солей.
Какое максимальное число фаз может иметь система, состоящая из раствора хлористого кальция, хлористого стронция и хлористого бария в воде?
14. Какое максимальное число фаз может иметь сплав, состоящий из свинца, олова и висмута?
Из жидкого расплава свинца и сурьмы частично выпали кристаллы сурьмы. Сколько степеней свободы имеет такая система?
При 144С жидкий расплав, состоящий из 40 % кадмия и 60 % висмута находится в равновесии с твердыми кристаллами кадмия и висмута. Определить вариантность этой системы?
Методы очистки газов от сернистых соединений основаны на реакциях:
3H2S(г) + 2Fe(OH)3(тв) = Fe2S3(тв) + 6H2O(г)
2Fe2S3(тв) + 3О2(г) + 6H2O(г) = 4Fe(OH)3(тв) + 6S(тв)
Определить в этой системе число фаз, число независимых компонентов и
степень свободы.
При очистке воздуха активированным углем при 40С протекают реакции: 2H2S(г) + О2(г) = 2H2O(г) + S2(г)
СS(г) + О2(г) = CO2(г) + 2S(г)
Применить к этой системе правило фаз.
Приведите примеры однокомпонентных систем состоящих из одной , двух, трех фаз.
Приведенные равновесия при 500С смещены вправо
COS(г) + H2O(г) = CO2(г) + H2S(г)
CS2(г) + 2H2O(г) = CO2(г) + 2H2S(г)
Примените здесь правило фаз.
Возможно ли существование однокомпонентной системы, состоящей из четырех фаз?
Приведите примеры двухкомпонентных систем, состоящих из одной, двух, трех и четырех фаз.
Возможно ли существование пяти фаз в двухкомпонентной и трехкомпонентной системе?
Определить фазовый состав и степень свободы системы при 500С и 1500С.
2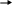
 FeS(тв)
2Fe(тв)
+
S2(г)
FeS(тв)
2Fe(тв)
+
S2(г)
При 500-600С в системе, состоящей из железа, его окислов и кислорода, возможно существование равновесий:
2 Fe3O4(тв) 6FeO(тв) + О2(г)
F e3O4(тв) 3Fe(тв) + 2О2(г)

2 FeO(тв) 2Fe(тв) + О2(г)
Применить к данной системе правило фаз.
В процессах водоочистки большую роль играет коагулирование коллоидных примесей, при этом протекает реакция
Al2(SO4)3(aq) + 3Ca(HCO3)2(aq) = 3CaSO4(тв) + 6CO2(г) + 2Al(OH)3(тв)
Определить фазовый состав и степень свободы системы.
Применить правило фаз к системе
NaCl(aq) + CO2(г) + NH3(г) + H2O(ж) = NH4Cl(aq) +NaHCO3(TB)
Фосфор получают восстановлением и возгонкой его в электрической печи из шихты, содержащей фосфорнокислый кальций (апатит или фосфорит), кокс и песок. Процесс протекает по уравнению
2Ca3(PO4)2(тв) + 10C(тв) + 6SiO2(тв) = P4(г) + 10СО(г) + 6СaSiO3(тв)
Определить число фаз, число независимых компонентов и степень свободы этой системы; какие из параметров можно изменять произвольно, не изменяя фазового состава системы?
Временная жесткость воды связана с наличием в ней растворимых солей
Сa(HCO3)2 и Mg(HCO3)2. При кипячении воды эти соли выпадают в осадок, при этом протекают реакции:
Сa(HCO3)2 = СaCO3(тв) + CO2(г) + H2О(ж)
2Mg(HCO3)2 = (MgOH)2CO3 (тв) + 3CO2(г) + H2О(ж)
Определить фазовый состав системы, число независимых компонентов и степень свободы.
В стеклоплавильных печах протекают реакции:
MgCO3(тв) + SiO2(тв) = MgSiO3(тв) +CO2(г) (450 - 700C)
Na2CO3(тв) + SiO2(тв) = Na2SiO3(тв) +CO2(г) (800 - 900C)
MgO(тв) + SiO2(тв) = MgSiO3(тв) (980 - 1150C)
Примените правило фаз к каждой реакции в отдельности.
В керамическом производстве при разных температурах протекают реакции:
MgCO3(тв) = MgO(тв) +CO2(г) (400 - 600C)
2CaSO4(тв) = 2CaO(тв) + 2SO2(г) + O2(г) (850 - 1100C)
CaCO3(тв) = CaO(тв) + CO2(г) (850 - 920C)
Na2SO4(тв) +C(тв) + CaCO3(тв) = Na2CO3(тв) + CaS(тв) + 2CO2(г) (1000C)
Fe2O3(тв) + C(тв) = 2FeO(тв) + CO(г)(1100C)
Примените правило фаз к каждой реакции в отдельности.
Кремний получают разложением силанов при 400-500С:
SiH4(тв) = Si(тв) + 2H2(г)
Si2H6(тв) = 2Si(тв) + 3H2(г)

SiH4(тв) + Si2H6(тв) = 3Si(тв) + 5H2(г)
Определить фазовый состав суммарной реакции в указанном интервале температур.
Аммиак и хлористый водород реагируют по уравнению
N H3 + HCl NH4Cl
Смешано 2 моль NH3 и 1 моль HCl. Cколько степеней свободы будет иметь система после наступления равновесия?
