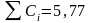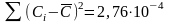- •Раздел 1
- •1.1.Химические, физические и физико-химические методы химического анализа
- •Организация работ по Международной стандартизации.
- •Государственная система стандартизации Российской Федерации (гсс рф)
- •Раздел 2
- •Раздел 3
- •Основы методов спектрального анализа.
- •1. Когерентное излучение – плоско поляризованная, монохроматическая волна с плоским фронтом волны.
- •2. Когерентное излучение - набор фотонов, обладающих одинаковой энергией и поляризацией и двигающихся в одном направлении.
- •1. Активная среда.
- •2. Источник накачки (возбуждения)
- •3. Резонатор.
Раздел 1
Обеспечение качества результатов химического анализа
Классификация методов химического анализа:
Химические, физические, физико-химические методы анализа;
Атомные и молекулярные методы химического анализа
В атомных опр-ем элементный состав
Молекулярном- молекулярный состав (опр-ие структуры молекулы ДНК)
Поляриметрический м.а. или колориметрия
Оптические, электрохимические методы анализа
Качественный и количественный химический анализ. Полный анализ и анализ на заданные элементы. Полуколичественный анализ.
Приведите примеры всех указанных методов химического анализа.
1.1.Химические, физические и физико-химические методы химического анализа
Основными задачами всех методов являются определение качественного, количественного химического состава образца или определение структур его молекул.
Химические методы химического анализа основаны на том, что при взаимодействии определяемого вещества (элемента) со специально подобранным химическим реактивом образуется новое вещество в виде осадка, окрашенного соединения, или соединения, изменяющего цвет индикатора.
Масса образовавшегося осадка эквивалентна содержанию определяемого вещества в анализируемом растворе.
Например, концентрацию бария в растворе можно определить гравиметрическим методом, добавив раствор сульфата натрия. Высушив и прокалив полученный осадок, взвешивают его и рассчитывают концентрацию бария.
Физические методы химического анализа основаны на том, что качественный и количественный химический состав определяют путем измерения физических параметров образца.
Например, концентрацию сахара в фруктовом соке можно определить, измерив вязкость или плотность сока.
Концентрацию натрия в морской воде можно определить атомно-эмиссионным методом спектрального анализа, возбудив атомы натрия в пламени.
Физико-химические методы анализа – методы, в которых измеряют физические параметры после или в процессе проведения химических реакций.
Например, концентрацию трехвалентного железа в растворе колориметрическим методом можно определить после того, как в анализируемый раствор будет добавлен реактив, образующий с ионами трехвалентного железа окрашенное соединение. 1.2
Атомный анализ- это элементный анализ. Анализ на заданные элементы. (из таблицы менделеева) атомно-эмиссионным атомно-абсорбциный.
Молекулярный
анализ - в основном
применяют для идентификации органических
и неорганических соединений,
установление структуры их молекул,
качественного и количественного
молекулярного состава.

АЭСА – атомно-эмиссионный спектральный анализ.
АФСА – атомно-флуоресцентный спектральный анализ.
ААСА – атомно-абсорбционный спектральный анализ.
МЭСА – молекулярный эмиссионный спектральный анализ.
МФСА – молекулярный флуоресцентный спектральный анализ.
МАСА – молекулярный абсорбционный спектральный анализ по Видимым, УФ и ИК спектрам.
КР – спектрометрия - анализ по спектрам комбинационного рассеяния
1.2.
качественный и количественный состав определяют по ИК, видимым или УФ спектрам называются оптическими методами анализа.
Стилоскопы - визуальной регистрацией (глаз)
Спектрографы – фотографической (пластинка фотографическая)
Спектрометры - фотоэлектрической ( фотоэлемент)
Фильтровые приборы - фотоэлектрической
В спектрометрах разложение в спектр - в монохроматоре, или в полихроматоре.
Приборы на базе монохроматора называются одноканальными спектрометрами.
Приборы на базе полихроматора – многоканальными спектрометрами.
Методика анализа – стандартизованный документ, в котором указаны:
- конкретный объект анализа (анализируемое вещество) и
определяемый компонент (аналит),
- метод анализа,
- этапы анализа и последовательность их выполнения
- используемые реактивы и их количество, посуда, приборы и т.д.
- метрологические характеристики анализа
- способы математической обработки результатов анализа
- требования к квалификации химика-аналитика
Аналит – компонент, анализируемого вещества, концентрацию которого надо определить.
Легирующие добавки – металлы (никель, кобальт, марганец, хром, титан, вольфрам, ниобий и другие) специально вводимые в сплав для обеспечения требуемых физических или механических свойств.
Анализируемое вещество (материал) – образец (материал), подлежащий анализу
Аналитический сигнал – физический параметр анализируемого образца простой зависимостью связанный с концентрацией аналита. Этот параметр можно легко измерить с помощью соответствующего прибора.
Результат анализа - значение, полученное выполнением аттестованной методики анализа, в которой указано:
- число единичных измерений,
- способы расчета концентрации
- представления результата анализа.
1.4. КАЧЕСТВЕННЫЙ И КОЛИЧЕСТВЕННЫЙ ХИМИЧЕСКИЙ АНАЛИЗ
Задача качественного анализа – обнаружение аналитов (элементов или соединений) в анализируемом веществе.
Задачей количественного анализа является определение концентрации аналитов в анализируемом образце.
ПОЛНЫЙ КАЧЕСТВЕННЫЙ И КОЛИЧЕСТВЕННЫЙ АНАЛИЗ
– обнаружение и определение концентрации всех химических элементов и веществ, содержащихся в пробе.
Задача полного качественного анализа, установить какие элементы (атомный анализ) или соединения (молекулярный анализ) входят в состав анализируемого объекта.
Такой анализ необходим в тех случаях, когда ничего не известно о происхождении образца. Например, анализ лунного грунта или другого космического объекта. КАЧЕСТВЕННЫЙ И КОЛИЧЕСТВЕННЫЙ АНАЛИЗ
НА ЗАДАННЫЕ АНАЛИТЫ
Полный анализ необходим не всегда. Чаще производят анализ на заданные компоненты (аналиты).
- задача качественного анализа на заданные аналиты – установить присутствует ли данный компонент (элемент или соединение) в анализируемом материале.
- задача количественного анализа на заданные элементы – определить концентрацию заданных аналитов.
ПОЛУКОЛИЧЕСТВЕННЫЙ АНАЛИЗ.
Иногда не требуется очень точного определения концентрации и можно довольствоваться результатом, содержащим значительную погрешность (30% и выше).
Например, заказчика может удовлетворить такой ответ: содержание кадмия в водоеме меньше ПДК. Такой вид анализа называют полуколичественным.
ФУНКЦИОНАЛЬНЫЙ (СТРУКТУРНЫЙ АНАЛИЗ) - установление структуры молекулы.
Особенно важен этот анализ в органической и биоорганической химии. Он позволяет установить наличие в молекуле функциональных и структурных групп атомов и их относительное расположение, определить какие связи содержатся в молекуле.

Метрологические характеристики в химическом анализе:
Правильность, прецизионность в условиях повторяемости, промежуточной прецизионности и воспроизводимости;
Точность, предел обнаружения и предел количественного определения. чувствительность, избирательность (селективность);
Градуировка, градуировочный график, градуировочное уравнение;
Линейность, робастность анализа;
Правильность - степень близости среднего значения из большого числа результатов измерений (30 и более) к истинному (принятому опорному) значению измеряемой величины (например, концентрации).
Метрология - наука об измерениях, методах достижения их единства и требуемой точности. Наука о погрешностях, возникающих в процессе измерений и способах их учета и минимизации.
Прецизионность (precision) - степень близости друг к другу независимых результатов измерений, полученных в конкретных регламентированных условиях.
Прецизионность зависит только от случайных погрешностей и не имеет отношения к истинному значению измеряемой величины.
Мерой прецизионности является стандартное отклонение результатов измерений.
Меньшая прецизионность соответствует большему стандартному отклонению.
Условия повторяемости (по старой терминологии - "сходимости") условия при которых результаты измерений получаются:
- одним и тем же методом,
- на идентичных объектах анализа,
- в одной и той же лаборатории,
- одним и тем же химиком-аналитиком,
- с использованием одного и того же оборудования,
- за короткий период времени (в один и тот же день).
Стандартное отклонение повторяемости Sr - стандартное отклонение, полученное в условиях повторяемости рассчитывают по формуле:
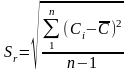 (1)
(1)
Если измерения производят в одной лаборатории, но в разное время (в разные дни) или разными химиками-аналитиками, то полученное стандартное отклонение называют - стандартным отклонением промежуточной прецизионности - Sпп. и рассчитывают по той, же формуле.
Чувствительность (коэффициент чувствительности) - способность метода анализа обнаружить разницу между близкими концентрациями аналита.
Если анализ проводится по градуировочному графику, то чувствительность определяется тангенсом угла наклона «» этого графика к оси абсцисс.

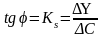 (3)
(3)
Рисунок 1.
Градуировочный график y = ax + b
Ks – коэффициент чувствительности;
Y – изменение аналитического сигнала;
С – изменение концентрации.
В случае линейной зависимости аналитического сигнала от концентрации аналита (Рис. 1), коэффициент чувствительности совпадает с коэффициентом «а» в уравнении: y = ax + b.
Условия воспроизводимости - условия, при которых результаты измерений получают
- одним и тем же методом,
- на идентичных объектах,
- в разных лабораториях,
- разными аналитиками,
- на разном оборудовании,
- в разное время (разные дни, месяцы).
Стандартное отклонение воспроизводимости SR - стандартное отклонение, полученное в условиях воспроизводимости.
Предел обнаружения (СLD) - минимальная концентрация, при которой аналитический сигнал будет значимо отличаться от аналитического сигнала холостого опыта (концентрация аналита равна нулю) при данной доверительной вероятности.
Предел обнаружения - наименьшая концентрация, при которой определяемое вещество может быть обнаружено, но не оценено количественно.
Теперь можно рассчитать минимальную концентрацию, которая может быть обнаружена (СLD):
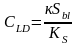 (4)
(4)
Где: Sbl – стандартное отклонение аналитического сигнала холостой пробы. Индекс «bl» – blank - пустой
Для расчета Sbl следует выполнить не менее 20 параллельных измерений аналитического сигнала фона.
В случае линейной зависимости среднее значение фона равно коэффициенту «в» в уравнении у = ах + в.
к – целое число, численная величина которого показывает, сколько стандартных отклонений Sbl взято для оценки предела обнаружения.
Значение «к» зависит от поставленной задачи и принятой доверительной вероятности. Опытным путем установлено, что для качественного анализа, при доверительной вероятности 99,9 % значение «к» равно 6.
Ks – коэффициент чувствительности.
В случае линейной зависимости аналитического сигнала от концентрации градуировочное уравнение имеет вид: у = ах + в.
Коэффициент чувствительности КS равен коэффициенту «а» градуировочного уравнения. Формула предела обнаружения в этом случае имеет вид:
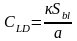
Селективность (избирательность, специфичность) - способность методики определять концентрацию заданного компонента в смеси сложного состава.
Например. Атомно-эмиссионный спектральный анализ обладает высокой селективностью. Каждый химический элемент имеет свои характеристические линии и поэтому можно обнаружить и определить количественно любой элемент, находящийся в смеси с большим количеством других элементов.
Линейность - диапазон концентраций, для которых соблюдается линейная зависимость аналитического сигнала от концентрации.
Робастность анализа – мера устойчивости методики к малым изменениям условий проведения анализа.
Построение градуировочного графика методом наименьших квадратов.
Проведение количественного анализа включает в себя построение градуировочных графиков, т.е. нахождение градуировочной функции экспериментальным путем.
Для этого измеряется аналитический сигнал для нескольких градуировочных образцов (ГО) или стандартных образцов, в результате получается массив данных: {xi,yi},
№ обр. |
Х |
У |
1 |
x1 |
y1 |
2 |
x2 |
y2 |
3 |
x3 |
y3 |
… |
|
|
n |
xn |
yn |
где: x - содержание определяемого компонента,
y - аналитический сигнал.
На плоскости каждое измерение можно представить точкой:
Н а
практике может наблюдаться значительный
разброс точек и возникает трудность в
определении правильного хода графика.
а
практике может наблюдаться значительный
разброс точек и возникает трудность в
определении правильного хода графика.
Прямо через точки проводить ломаную и считать ее градуировочной функцией нельзя, т.к. измеряемый сигнал содержит погрешность.
В АЭСА, градуировочный график отражает зависимость абсолютной или относительной интенсивности спектральной линии от концентрации:
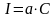
Графики строят в координатах i – С (фототок – концентрация); S – lgC (разность почернений – логарифм концентрации)
Построение градуировочного графика в ААСА опирается на закон Бугера-Ламберта-Бера.
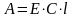
Наиболее часто используется линейная зависимость.
Как правило, для небольшого диапазона концентраций градуировочный график представляет собой прямую.
Известно, что уравнение прямой (линейная зависимость)
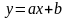 ,
где:
,
где:
a = tg - тангенс угла наклона прямой к оси абсцисс (х);
b - отрезок, отсекаемый прямой на оси ординат (у).
З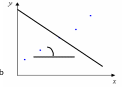 адача
метода наименьших квадратов сводится
к тому, чтобы найти такие значения a
и b
(в уравнении прямой), при которых сумма
квадратов отклонений экспериментально
полу-ченных точек от градуировочного
графи-ка была минимальной.
адача
метода наименьших квадратов сводится
к тому, чтобы найти такие значения a
и b
(в уравнении прямой), при которых сумма
квадратов отклонений экспериментально
полу-ченных точек от градуировочного
графи-ка была минимальной.
Коэффициенты а и b рассчитывают по формулам:
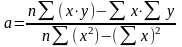
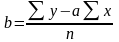
Рассчитав коэффициенты a и b составляют ГУ
Контроль качества градуировки
Для контроля качества градуировки используют безразмерную величину - коэффициент корреляции, который рассчитывают по формуле:
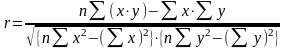
Коэффициент корреляции (r) служит количественной оценкой линейной зависимости и может принимать значения от -1 до +1. Если r = 0 - измеряемая величина не зависит от концентрации, и использовать ее в качестве аналитического сигнала не имеет смысла.
Если коэффициент корреляции r = 0,90 - 0,95 градуировка сделана удовлетворительно.
Если коэффициент корреляции r = 0,95 - 0,99 градуировка сделана хорошо.
Если коэффициент корреляции r ³ 0,99 градуировка сделана отлично.
5Стандартные образцы состава (СОС):
5.1.Классификация стандартных образцов СО: международные МСО, государственные – ГСО, отраслевые– ОСО, стандартные образцы предприятия – СОП.
5.2.Требования к стандартным образцам.
5.3. Выбор СО
5.4.Применение СО.
Образец сравнения - однородный материал, или вещество, химический состав которого установлен достаточно надежно для того, чтобы использовать его для титрования или построения градуировочных графиков в процессе рутинного анализа. Например, приготовленные в лаборатории растворы для выполнения лабораторных работ.
Стандартные образцы (СО) - специально приготовленные материалы, в которых содержание аналитов установлено с большой точностью. Существенным отличием стандартных образцов от образцов сравнения является то, что химический состав удостоверен в соответствии с официальной процедурой (аттестацией) о чем имеется соответствующий документ "аттестат"...
К материалу СО предъявляются высокие требования:
- равномерное распределение компонентов по всему объему;
- достаточно длительный срок, при котором состав остается постоянным;
- надежно установленное содержание всех компонентов.
Существуют международные стандартные образцы (МСО), государственные стандартные образцы (ГСО), отраслевые стандартные образцы (ОСО), стандартные образцы предприятия (СОП).
МСО – международные стандартные образцы. Могут быть использованы в любой лаборатории государств, участников Международной организации стандартов ИСО.
ГСО Р - общероссийский стандарт. Они могут быть использованы в любой лаборатории Российской Федерации. ГСО изготовляются специальными государственными институтами и предприятиями. В РФ эту работу выполняют Научно-исследовательский институт стандартных образцов ВНИИСО и институт метрологии РФ.
ГСО многих материалов металлических сплавов, минералов, горных пород и т.п. слишком дороги и дефицитны, чтобы использовать их для построения градуировочных графиков в рядовых анализах. Как правило, ГСО используют для проверки правильности методик анализа при их аттестации и аттестации отраслевых стандартных образцов (ОСО).
ОСО изготовляются и аттестуются головными НИИ соответствующей отрасли промышленности. (Например, ОСО сталей, чугунов для черной металлургии изготовляет центральный научно-исследовательский институт черных металлов ЦНИИЧЕРМЕТ.) ОСО являются стандартом только в пределах соответствующей отрасли промышленности. Их используют для аттестации СОП и проверки правильности методик, применяемых в данной отрасли промышленности.
СОП - стандартные образцы, изготовляемые в лаборатории предприятия (завода, НИИ). Эти образцы аттестуются и могут быть использованы только в лабораториях данного предприятия для построения градуировочных графиков. Их иногда называют градуировочными образцами (ГО)
По своей природе стандартные образцы состава делятся:
- чистые вещества и их смеси или растворы,
- материалы с матрицей известного состава.
Под матрицей понимают все вещества (элементы) кроме аналитов, входящие в состав анализируемого материала.
3.2.
1) приготовление материала СО;
2) исследование однородности материала
3) определение химического состава стандартных образцов.
4) аттестация стандартных образцов.
Принятое опорное значение μ (мю) - значение, которое служит для сравнения. За опорное значение может быть принято:
Погрешности химического анализа.
Погрешности: случайные, систематические, выбросы;
Кривая распределения случайных погрешностей, доверительный интервал, доверительная вероятность;
Способы выявления выбросов.
Стандартное отклонение повторяемости и воспроизводимости
Систематические погрешности
Абсолютная погрешность dабс – разность между измеренной и истиной концентрацией с учетом знака.
Абсолютная погрешность в аналитической химии выражается в единицах концентрации: мг/кг, мг/л, мкг/мл, моль/л и т.п.
Разность между результатом анализа и принятым опорным значением (истинным значением концентрации) и есть абсолютная погрешность измерения концентрации dабс.
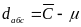
 -
абсолютная погрешность, допущенная при
измерении концентрации
-
абсолютная погрешность, допущенная при
измерении концентрации
 -
результат анализа (средняя концентрация
из n параллельных измерений)
-
результат анализа (средняя концентрация
из n параллельных измерений)
μ - действительная (истинная) концентрация (паспортное значение концентрации в стандартном образце или среднее значение концентрации, рассчитанное по большому числу измерений n≥30).
Абсолютная погрешность может быть положительной и отрицательной.
Если

μ , то dабс
– положительная,
μ , то dабс
– положительная,
Если μ , то dабс – отрицательная.
Относительная погрешность dотн. – выражается в процентах к измеряемой концентрации. Величина безразмерная.
При очень точных измерениях относительная погрешность может оказаться меньше 1%. В этих случаях принято использовать другие единицы. Например, в частях на тысячу (англ,– part per thousand. ppt), или в частях на миллион частей, ppm.
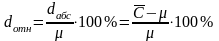
Например,
результат анализа при определении
концентрации нефтепродуктов в речной
воде (n=5)
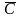 =
2,02 мг/л. Принятое опорное значение μ
= 2,00 мг/л, абсолютная погрешность
определения dабс
= 0,02 мг/л.
=
2,02 мг/л. Принятое опорное значение μ
= 2,00 мг/л, абсолютная погрешность
определения dабс
= 0,02 мг/л.
Относительная
погрешность будет равна:
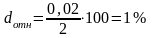
Относительная погрешность того же результата анализа выраженная в ppt:
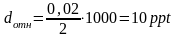
Если относительная погрешность рассчитывается на основе большого числа (30 и более) параллельных измерений, то ее численная величина служит показателем точности методики анализа.
Выброс - элемент совокупности значений, который несовместим с остальными элементами данной совокупности
Метод Q-критерия
При числе измерений n = 3..7 Q-критерий в общем виде вычисляется по формуле:
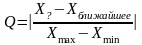
При n = 8…10 в знаменателе должна стоять разница между подозрительным значением и ближайшем к максимальному (или минимальному)
При числе измерений n = 3…7
Если минимальный результат - подозрительный
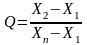
Если максимальный результат – подозрительный
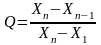
При числе измерений n = 8…10
Если минимальный результат - подозрительный
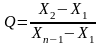
Если максимальный результат - подозрительный
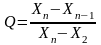
Рассчитанное значение Q сравнивают с табличным значением.
Если рассчитанное значение критерия больше табличного значения (Qрас > Qтаб), то подозрительный результат является выбросом и исключается
Например:
При АЭСА анализе стали на содержание никеля получены пять параллельных измерений концентрации. Расположили их по возрастанию %: 2,53; 2,55; 2,56; 2,58; 2,69.
Следует установить, есть ли среди этих измерений выбросы.
1. 2,53 Хmin
2. 2,55
3. 2,56
4. 2,58 Х ближайшее
5. 2,69 X? Хmax
Подозрение на выброс вызывает измерение - 2,69. Ближайшее к нему измерение - 2,58.
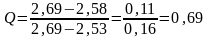
Табличное значение Q(5;0,95) = 0,64 для n = 5 Р = 95%.
Следует признать, что результат 2,69 является выбросом и его следует исключить из дальнейших расчетов.
Далее следует оценить наличие выбросов среди оставшихся измерений.
1. 2,53 Хmin
2. 2,55
3. 2,56 Х ближайшее
4. 2,58 X? Хmax
5.
2,69

Табличное значение Q(4;0,95) = 0,77 для n = 4 Р = 95%.
Следует признать, что результат 2,58 не является выбросом.
Дальнейших расчетов следует оставить четыре значения концентрации %: 2,53; 2,55; 2,56; 2,58.
Случайные погрешности (e).
Погрешности, причиной которых являются случайные, неконтролируемые изменения условий измерения, называются случайными погрешностями. Так как на условия измерения действует множество различных факторов, причины возникновения случайных погрешностей не всегда известны и часто непредсказуемы. Действие этих факторов приводит к тому, что отклонение результата измерения от истинного значения концентрации носит статистический, вероятностный характер.
При параллельных измерениях величина случайных погрешностей изменяется случайным образом. Какова будет погрешность каждого единичного измерения предсказать нельзя. Но можно оценить наиболее вероятную максимальную случайную погрешность методики анализа.
На практике при выполнении анализа по стандартизованной методике получают ограниченное число результатов. Совокупность ограниченного числа результатов измерений называют выборкой, а их количество - объемом выборки. Мерой случайной погрешности в этом случае является стандартное отклонение небольшого объема выборки S, которое часто называют среднеквадратичным отклонением (СКО)
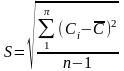

S - стандартное отклонение малой выборки (СКО)
Сi - результат единичного (и-того) измерения концентрации.
- среднее значение концентрации из n результатов измерений
n - количество параллельных измерений концентрации,
(n-1) - принято называть числом степеней свободы (В справочниках обозначается "f ")
Пример.
При определении концентрации хрома в стальном образце атомно-эмиссионным методом анализа выполнили четыре параллельных измерения и получили данные (Cr %): 1,44; 1,45; 1,43; 1,45. Рассчитаем стандартно отклонение малой выборки по формуле 4.5
№п/п |
Сi |
|
|
( )2 |
1 |
1,44 |
|
-0,002 |
0,04·10-4 |
2 |
1,45 |
|
0,008 |
0,64 10-4 |
3 |
1,43 |
1,442 |
-0,012 |
1,44 10-4 |
4 |
1,45 |
|
0,008 |
0,64 10-4 |
|
|
|
|
|
а)
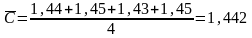 б)
б)

Если объем выборки достаточно велик - (не менее 30), то стандартное отклонение выборки "S" (среднее квадратичное отклонение) можно принять равным .
График, отражающий зависимость количества измерений с данной случайной погрешностью от величины этой погрешности, называется кривой распределения случайных погрешностей.
Относительное стандартное отклонение RSD - отношение стандартного отклонения к средней концентрации выборки.
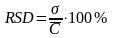 (при
аттестации методики анализа)
(при
аттестации методики анализа)
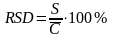 (для
малого объема выборки)
(для
малого объема выборки)
Систематическая погрешность - разность между средним значением результатов измерений (иначе, математическим ожиданием) и истинным (принятым опорным значением) μ.
По данной методике анализируют стандартный образец (сравнение по паспорту с найдено конц-ии).
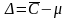
Чаще всего численная величина систематической погрешности остается неизменной при параллельных измерениях и не зависит от концентрации, такие погрешности называют постоянными.
Но встречаются систематические погрешности, величина которых изменяется пропорционально концентрации. Это - пропорциональные или линейные погрешности.
Систематические погрешности бывают положительными и отрицательными.
Систематическая погрешность - аддитивна, т.е. общая систематическая погрешность результата анализа равна сумме систематических погрешностей, возникающих на всех этапах в ходе анализа.
Систематическая погрешность в процессе выполнения количественного анализа не видна.
причиной систематической погрешности является недостаточное соответствие химического и минералогического состава стандартных образцов с составом анализируемых образцов.
Кривая распределения случайных погрешностей.
Как уже говорилось, случайные погрешности вызываются случайными причинами, действия которых неодинаково при параллельных измерениях. Случайная погрешность различна, даже в тех случаях, когда параллельные измерения производятся одним и тем же аналитиком, в один день, с одними и теми же реактивами, посудой, приборами.
Например, взвешивая одну и ту же навеску несколько раз на одних весах, с одними и теми же гирями можно получить заметно отличающиеся результаты. Причиной случайных погрешностей может оказаться колебания воздуха, неодинаково влияющее на чашки весов или нагревание одной чашки весов от приближения руки.
Абсолютные случайные погрешности изменяются от одного параллельного измерения к другому. Они могут быть и положительными и отрицательными, могут оказаться и очень маленькими и достаточно большими.
График, отражающий зависимость количества измерений с данной случайной погрешностью от величины этой погрешности, называется кривой распределения случайных погрешностей.
Случайные погрешности химического анализа обычно подчиняются нормальному (Гауссовому) закону распределения. (рис. 1)
Р исунок
1. Кривая нормального распределения
случайных погрешностей «e»
построенная по большому числу (n > 30)
параллельных измерений. (Кривая Гаусса)
исунок
1. Кривая нормального распределения
случайных погрешностей «e»
построенная по большому числу (n > 30)
параллельных измерений. (Кривая Гаусса)
Нормальному распределению случайных погрешностей соответствует симметричная кривая. Для нормального распределения характерно:
Одинаковые по абсолютной величине, но противоположные по знаку погрешности встречаются одинаково часто.
Большая часть измерений концентрируется вблизи нулевой погрешности, т.е. эти измерения близки к истинному значению измеряемой величины, если отсутствует систематическая погрешность.
Число измерений с большой погрешностью тем меньше, чем больше сама погрешность
Зная величину σ, можно с некоторой уверенностью определить возможный интервал случайных погрешностей единичного измерения. Эта уверенность называется - доверительной вероятностью и обозначается буквой «Р». Чем с большей доверительной вероятностью (уверенностью) мы хотим представить результат анализа, тем большим оказывается диапазон случайных погрешностей.
6Аналитический сигнал:
6.1.Аналитический сигнал в АЭСА, ААСА, РФСА.
6.2.Способы регистрации аналитического сигнала
6.3.Связь аналитического сигнала с концентрацией.
Аналитический сигнал – физический параметр анализируемого образца простой зависимостью связанный с концентрацией аналита. Этот параметр можно легко измерить с помощью соответствующего прибора.
На пламенном фотометре аналит. Сигнал-фототок
На спектометре- почернение
На стиллоскопе ( полуколичественный анализ)- яркость линий

Стандартизация и аттестация методик химического анализа
Цель и сущность аттестации и стандартизации методики.