
- •1Құрылыс материалдары химиясы пәні, мақсаты, міндеттері
- •Заттардың физика-химиялық қасиеттері олардың кристалдық торларының типтеріне тәуелді болады.
- •2) Изотермиялық дәптерде бар.
- •Термодинамиканың екінші заңы- кез келген процесс Ықтималдылығы төмен күйден Ықтималдылығы жоғары күйге қарай жүреді.
- •Диспесті жүйелердің жіктелуі.
- •Кремнийдің негізгі қосылыстары:
- •Күй диограммалары жайлы жалпы түсінік.
- •Диференциалды-термиялық талдау әдісі.
- •Рентгендік талдау әдісі.
- •Диференциалды-термиялық талдау әдісі.
- •Рентгендік талдау әдісі.
- •Титриметриялық анализ әдістерінің классификациясы (жіктелуі)
- •Титриметрлік талдау
- •Пластификаторларды қолданудың технико- экономикалық тиімділігі.
- •Ұялы бетондар үшін кешенді қоспалар.
- •Ұялы бетондар үшін кешенді қоспалар.
- •Битум мен қара майлардың негізгі қасиеттері
- •Битум мен қара майлардың негізгі қасиеттері
- •2 Эакты қасиет корсетеді он, сно
- •Полимерлер мономерлерден синтезделеді, полимердің қайталанып отыратын ең кіші бөлігін құрылым буыны, ал олардың санын полимерлену дәрежесі деп атайды.
9 – тақырып
1) Коллойдты жүйе фазаларының арасындағы кернеулілікті төмендету жолдары
Термодинамикадан белгілі болғандай, беттік бос энергияның қоры жоғары жүйелер, термодинамикалық тұрғыдан тұрақсыз, сондықтан ол жүйелерде беттік бос энергияны төмендетуге бағытталғын өздігінен жүретін процесстер болады.
Сондықтан барлық коллойдты және диспесті жүйелер термодинамикалық тұрақсыз, оларда өздігінен: коагуляция- бөлшектердің іріленуі, бөлшектердің жабысуы мен коалесценциясы (бірігу) сияқты процестер өздігінен жүреді. Коагуляция мен коалесценция нәтижесінде фазалар шекарасы бетінің ауданы S азаяды, соған сәйкес Fs = S×s беттік бос энергияның мөлшері төмендейді.
Коллойдты немесе дисперсті жүйенің тепе-теңдік күйіне, бұл жүйенің толық қабаттарға бөлінуі, яғни екі фазаға бөлініп, тұнуы сәйкес келеді.
Fs = S×s → min қатнасынан бос энергияның ең төменгі мәніне екі түрлі өздігінен жүретін процестердің нәтижесінде қол жеткізуге болатындығына көз жеткіземіз.
- фазалар шекарасы бетінің ауданын төмендету арқылы (S→ min)
- фазалар шекарасы ауданы тұрақты болған жағдайда, беттік кернеілілікті төмендету арқылы (s → min).
Яғни беттік кернеулілікті төмендету процесі де беттік бос энергияны төмендетуге бағытталған болғандықтан, өздігінен жүретін процесс болып табылады. Бұндай процеске фазалар шекарасы бетінде заттың концентрациялануына бағытталған, адсорбция процесі жатады.
Жоғарыда коагуляция термодинамикалық тұрғыдан өздігінен жүретін процесс екендігі айтылды. Бірақ коагуляцияның жылдамдығы әрқашан да бірдей бола бермейді. Егер жүйе беттік бос энергияның үлкен қорына ие болса, онда коагуляция процесі жылдам жүреді және ондай жүйелер агрегатты тұрақсыз жүйелер деп аталады. Бірақ кейбір жүйелерде, меншікті бетінің ауданы жоғары болуына қарамастан, коагуляция жай жүреді. Мұндай агрегативті тұрақты деп аталатын жүйелерде, фазалар шекарасындағы беттік кернеулілік төмен болуы мүмкін. Бұдан жүйелердің тұрақтылығын арттыру үшін беттік бос энергияны, бөлшектердің бетіне беттік белсенді заттарды адсорбциялау арқылы төмендетуге болатындығы жайлы қорытынды шығады.
9 – тақырып
1) Диффузия құбылысы
Диффузия[1](лат. dіffusіo – таралу, жайылу) – нақтылы дене бөлшектерінің жылулық қозгалыстарга ұшырай отырып, сол дене конңентрациясының селдір аудандарына қарай жылжуы;молекулалардың жылулық қозғалысы салдарынан шеқаралас орналасқан әр түрлі заттардың бір-біріне өту құбылысы. Диффузия дененің бүкіл көлеміндегі концентрация мөлшерінің бірте-бірте теңелуін, сөйтіп оның бірқалыпты сипат алуын қамтамасыз етеді. Кейбір денелердің өте шағын бөлшектері ғана емес (атомдар,молекулалар, иондар), біршама ірі түйіршіктері де диффузиялық қасиетті иемденуі мүмкін.
Диффузия жылдамдығы температураға тікелей байланысты, алайда бүл процесс газдарда өте тез, сүйықтарда одан гөрі баяу, ал қатты заттарда өте баяу өтеді.[2]
Диффузия құбылысы барлық агрегаттық күйде, диффузияланатын заттың сол ортадағы шоғырлануы теңелгенге дейін жүре береді. Газ немесе сұйықтың молекулаларының бір орыннан екінші орынға ауысуы арқылы өз ішінде диффузиялануы өздік диффузия деп аталады. Диффузияның өту шапшаңдығы — диффузияланатын заттың тегіне және оның қандай жағдайда болуына байланысты анықталатын шама — диффузия коэффициентімен сипатталады. Диффузия коэффициентінің халықаралық бірліктер жүйесіндегі өлшеу бірлігі — м2/сек. Диффузия құбылысы табиғатта маңызды роль атқарады: атмосфераның жер бетіне жақын орналасқан қабаттарындағы ауа құрамының біркелкі болуына ықпал етіп, өсімдіктердің дұрыс қоректенуіне жағдай туғызады.[3]
Диффузия - бір кезде игерілген және пайдаланылған инновацияның жаңа жағдайда, жаңа орындарда таралуы.
9 – тақырып
1) Коагуляция және коалесценция
Коллалдтардың тұрақтығы, олардың бөлшектерінде адсорбцияланған зарядтың болуынан және су молекулаларының қоршауынан екендігі жоғарыда айтылды, ол осы себептерді жойса, коллоидтардың тұрақтылығы кемиді. Бөлшектер біріне-бірі жабысып, бірігісіп, ірірек агрегат түзеді, оның ақтық нәтижесі олар ауырлап тұнба болып шөгеді. Осы процесті ұю, немесе коагуляция дейді.
Коагуляция (лат. "ұйып қалу" ) - Коллоидты ерітінділердің золь не гель күйіне көшуі, тканьдердің "ұюы". Бұл олардың некрозын тудырады. Жоғары молекулалы заттардың коллойдты ерітінді жағдайынан гелдерге айналуы. Еріген затты коагуляциялауға жеткілікті электролиттің ең аз мөлшері сол заттың дисперсиялық өлшемін анықтайды, бұл өлшем "коагуляциялану табалдырығы" деп аталады.[2]
Коалесценция - шашыранды-көлкімелі (дисперсиялы) жүйелердегі эмульсия, тұман және көбік көпіршіктері түріндегі сұйық тамшыларының қосылу үрдісі. Коалесценция биологиялық зерттеулерде пайдаланылады.
9 – тақырып
1) Қатты – сұйық шекарасындағы жұғу шамасы, оны төмендету жолдары
Жалпы жоғарыда айтылғандай қатты заттардың беттік кернеулілігін өлшеу мүмкін емес, себебі қатты заттар үшін фазаның жаңа бетінің түзілуі қайтымсз процесс. Сондықтан қатты заттар үшін бетттік кернеулілікті қосалқы әдіспен анықтайды. Әр түрлі қатты заттардың беттік кернеулігі, түрліше және барлық жағдайда сұйықтардың беттік кернеулілігінен жоғары және бір шаршы сантиметр үшін жүздеген және мыңдаған эргпен өлшенеді.
Қатты заттардың беттік кернеулілігін де төмендетуге болады. Бұл құбылыспен біз қатты заттың сұйықпен шайылу және адсорбциялануы кезінде іспеттес боламыз.
Жұғудың периметрі үш орта: 1) ауа, 2) сұйық, 3) қатты дене әсерлерінің шекарасы болатындығы анық. Бұл орталар оларды шекаралайтын беттерге ие: 1–2 беттік кернеулікке ие сұйық-ауа беті; 1–3 беттік кернеулікке ие ауа-қатты дене беті; 2–3 беттік кернеулікке ие сұйық-қатты дене беті.
а) с.г.
Г қ с к.с.
|
б) с.г.
қ с к.с.
|
а - жұғу бұрышы 900 кем болған, б – жұғу бұрышы 900 артық болған жағдай;
Осыған сәйкес жұғу периметрінің 1 см-не 1-суретте сәйкес векторлар-мен белгіленген үш күш әсер етеді: 1–2; 1–3; 2–3. Олар сәйкес шекараланатын бетке жанамалы орналасқан дөңгелектің жеке элементтеріне перпендикуляр бағытталған. тепе-теңдік шеттік бұрышын түзгенде барлық күштер бірін-бірі теңестіруі қажет. Бұл жағдай үшін қатты дене беті жазықтығы осіне векторлар проекциясы қосындысынан шығатын Дюпре-Юнг қатынасы дұрыс болады:
2–3 = 1–3 + 1–2 немесе 2–3 – 1–3 = 1–2 ,
бұдан = (2–3 – 1–3) / 1–2 = В.
Мұндағы шамасы В жұғу деп аталады. Жұғу жағдайы өзгергенде бұл бұрыш өзгереді. Толық жұғуға ( = 0) В=1 жауап беретіні анық. Сұйық қатты денеге олардың молекулаларының арасындағы әсер аз болған сайын жақсы жұғады. Аз беттік кернеулікке ие болған полярсыз сұйықтар, негізінде беттерге жақсы жұғады. Бұл жағдайда алынған екі сұйықтықтан дененің бетіне, қайсысының қатты денемен полярлық айырмашылығы аз болса сол жақсы жұғады.
Су ауа
атмосферасында көптеген жіңішке сүйір
беттерде шеттік бұрыш, яғни
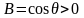 жұғудың оң мәнін түзетіні белгілі. Осы
көзқарас тұрғысынан барлық беттерді
гидрофильді деп қарауға болады. Полярсыз
сұйықтардың қатысуында судың беттік
талғамды жұғуы кезінде жағдай өзгеше.
Бұл жағдайда су барлық уақытта да сүйір
шеттік бұрыш түзе бермейді. Бұндай
жағдайда гидрофильді беттерге су
талғамды жұғады. Бұл кезде шеттік бұрыш
< 900,
бірақ бет гидрофобты болса көміртегі
суды біржақты ығыстырып су үшін
> 900
болады.
жұғудың оң мәнін түзетіні белгілі. Осы
көзқарас тұрғысынан барлық беттерді
гидрофильді деп қарауға болады. Полярсыз
сұйықтардың қатысуында судың беттік
талғамды жұғуы кезінде жағдай өзгеше.
Бұл жағдайда су барлық уақытта да сүйір
шеттік бұрыш түзе бермейді. Бұндай
жағдайда гидрофильді беттерге су
талғамды жұғады. Бұл кезде шеттік бұрыш
< 900,
бірақ бет гидрофобты болса көміртегі
суды біржақты ығыстырып су үшін
> 900
болады.
Тек суды қолданған жағдайда барлық бейорганикалық құрылыс материалдарына, соның ішінде ұялы бетонға да су жақсы жұғады. Олардың моле-кулаларында құрылыс материалдарының бетін сумен әрекеттестіре алатын жеткілікті мөлшердегі полярлы топтар болғандықтан, бұл түсінікті де. Сондықтан бөгде қоспалармен ластанбаған құрылыс материалдарында сумен жанасу кезінде жұғу өздігінен және тез жүреді.
Қатты заттың бетінің гидрофильдігі мен гидрофобтығын өзгертуге болады. Мәселен бетонның гидрофильді бетін, оған органикалық беттік белсенді заттарды адсорбциялау арқылы гидрофобты етуге болады. Сол сияқты алюминий ұнтағының бетін арнайы беттік белсенді заттарды ендіру арқылы гидрофильді етіп, сумен шайылуын жақсартуға болады.
9 – тақырып
1) Коллойдты жүйелердегі осмос қысымы
Молекула-кинетикалық теория коллойдты жүйелерді нағыз ерітіндінің жеке жағдайлары ретінде қарастырады: яғни, диперсті ортаны еріткіш ретінде, ал диперсті фазаны еріген зат ретінде. Бұл коллойдты жүйелердегі осмос, диффузия және седиментация құбылыстарын түсіндіруге мүмкіндік береді.
Нағыз ерітінділер мен коллойдты жүйелердің негізгі қасиеттері арасындағы ерекшелік, сапалық емес, тек сандық мәнге ие.
Осмос қысымы:
Ерітінділер теориясынан белгілі болғандай, сұйылтылған ерітіндідегі осмос қысымы, Вант-Гофф теңдеуімен анықталады:
π=RTс
мұндағы с- мольдік концентрация.
Егер концентрацияны төмендегідей өрнектесек:
с=n/N
онда
π=RT n/N болады
Яғни осмос қысымы молекулалық-жылулық қозғалысқа қатысатын жеке бөлшектердің санына тура пропарционалды болады.
10 – тақырып
1) Силикатты жүйелердің күй диаграммасы жайлы негізгі түсініктер
Жер қыртысында ең көп таралған элементтердің бірі кремний (жер массасыың шамамен 28%), сонымен бірге кремний барлық космос денелерінің құрамына енеді. Айдан алып келінген жыныстарға талдау жасау, ол жыныстардың құрамында шамамен 19% Si немесе 41% SiO2 бар екендігін көрсетті.
Кремнийдің негізгі қосылыстары:
кремнийдің сутегімен қосылыстары- кремнийсутектер(силандар- SiН4);
кремнийдің галогендермен қосылысы – кремнийгалогенидтер:
(SiҒ4; SiСI4; SiBr4; SiI4)
газ сұйық сұйық кристалл
силицидтер - өте жоғары температурада элементтік кремний балқымада металдармен әрекеттесіп, МехSiу типтегі қосылыстар түзеді. Бұл заттар металдық жылтыры бар, тез үгітілетін зат.
кренмний карбиді – (корборунд, көміртекті кремний) SiС;
кремний боридтері – кремнийдің бормен қосылысы В3Si; В6Si;
кремний нитридтері - Si3N4;
кремнийорганикалық қосылыстар;
Күй диаграммасы (тепе-теңдік диаграммасы, фазалар диаграммасы) дегеніміз – физика-химиялық жүйелер күйі параметрлерінің арасындағы қатынастың графикалық бейнесі.
Қарапайым біркомпонентті жүйелер күйінің диаграммасы негізгі үш параметрмен – температра, қысым және көлеммен сипатталып, кеңістіктік үшөлшемді геометриялық фигуралар болып табылады. Бірақ үшөлшемді кеңістіктік фигураларды практикада қолдану өте қиын, сондықтан ол фигураларды белгілі бір координаталық жазықтыққа (негізінен р-Т жазықтығына) проекциялайды. Алынған жалпақ фигура тұрақты көлем кезіндегі жүйе температурасы мен қысымының арасындағы тәуелділікті сипаттайды.
Нақты жүйелер күйінің диаграммалары, физика-химиялық, рентгенографиялық, электронды микроскоптық талдау әдістері мен жүйенің физикалық қасиеттерін зерттеу нәтижелерінде алынған эксперименттік мәліметтер негізінде құрылады.
Диаграммаларды құрастырудың дұрыстығы фазалар ережесі мен үздіксіздік және сәйкестік принциптері негізінде тексеріледі.
Күй диограммалары жайлы жалпы түсінік.
Гетерогенді жүйелер деп жүйенің құрам бөліктерінң арасында беттік айырмашылық болатын жүйелерді айтамыз.
Гетерогенді реакция деп әр түрлі фазада болатын компоненттердің арасында, гетерогенді ортада өтетін процестерді айтамыз.
М: СаСО3 → СО2 + СаО
Компоненттер деп термодинамикалық жүйенің барлық фазаларын түзуге мүмкіндік беретін, химиялық заттардың ең аз санын айтады. Компонентердің саны жүйенің тәуелсіз құрам бөліктерінің санына тең.
Құрам бөліктері бір бірімен химиялық байланысқа түспейтін жүйелерді бірінші кластағы немесе физикалық жүйелер деп атайды (су-мұз-бу жүйесі). Бұндай жүйелердегі компонентер саны жүйенің құрам бөліктерінің санына тең.
Құрам бөліктері бір бірімен химиялық байланысқа түсетін жүйелер, екінші кластағы немесе химиялық жүйелер деп атайды. Бұндай жүйелердегі компоненттердің саны, жүйенің тәуелсіз құрам бөліктері санынан, жүйеде жүретін тәелсіз химиялық реакциялардың санын алып тастағанға тең.
М: СаСО3 → СО2 + СаО
Бұл жүйедегі құрам бөліктердің саны 3, ал тәелсіз реакцияның саны 1тең. Демек тәуелсіз компоненттердің саны К=3-1=2 тең.
Мәселен кальций оксиді мен кремний оксиді әрекеттесетін жүйеде, тәуелсіз жүретін химиялық процестердің саны 4:
3СаО + SiO2 → 3СаО SiO2
2СаО + SiO2 → 2СаО SiO2
3СаО + 2SiO2 → 3СаО 2SiO2
СаО + SiO2 → СаО SiO2
Жүйенің құрам бөліктерінің саны – 6, ал реакциялардың саны – 4. компоненттер саны К=6-4=2 (СаО, SiO2).
Компоненттер санына байланысты жүйелер біркомпонентті, екікомпонентті, көпкомпонентті болуы мүмкін.
Жүйенің еркіндік дәрежелерінің сны деп – жүйе күйін сипаттайтын ең аз параметрлер саны айтылады.
Варианттылық деп – жүйенің фазалар санын өзгертпестен, белгілі бір интервалда өзгертуге болатын жүйе күйінің параметрлері снын айтамыз.
Егер жүйедегі фазалардың тепе-теңдігі жүйе параметрлерінің нақты бір бір мәнінде ғана болуы мүмкін болса, онда жүйе вариантсыз деп аталады.
10 – тақырып
Гибстің фазалар ережесі
Гиббстік фазалар ережесі тепе-теңдіктегі жүйелердің, компоненттері, фазалары және еркіндік дәрежесі сандарының арасындағы қатнасты сипаттайды. Бұл фазалар ережесіне сәйкес, тепе-теңдіктегі физикалық жүйелер үшін еркіндік дәрежесі сандарының қосындысы мен фазалар саны, компоненттер санын екіге көбейткенге тең.
Ғ + n =K * 2
Бұндағы Ғ – еркіндік дәрежесі сандары;
n – фазалар саны;
К – компоненттер саны.
10 – тақырып
Күй диаграммаларын техникалық мәселелерді шешуде пайдалану
Күй диаграммаларын техникалық мәселелерді шешуде пайдалану
Теория мен практика үшін силикатты жүйелерде өтетін фазалар өзгерісінің физика-химиялық табиғаты жайлы және зерттелетін жүйелердегі жеке фазалардың болу мүмкіндігін, оларды жеке бөліп алмастан және химиялық талдамастан нақты көзқарас қалыптастырудың маңызы ерекше. Бұл мәселе нақты бір практикалық мәселелерді шеуге мүмкіндік беретін силикатты жүйлердің күй диаграммалары арқылы шешілуі мүмкін. Практика үшін силикатты жүйелердің химиялық қоспалар қатысында, өте кең температуралық интервалда, өздерін қалай ұстайтындығының (М: өңделетін өнімнің пештің отқатөзімді қабатымен қажетсіз, оңайбалқитын қосылыстар немесе қатты ерітінділер түзу мүмкіндігі жайлы мәліметке ие болу қажет) маңызы зор. Сұйық шлакты балқыманың кристалдануы нәтижесінде алынған дайын өнімнің құрылымы мен қасиеттерінің қандай болатындығын алдын ала болжау, жүйенің құрам бөліктерінің болу мүмкіндігінің белігілі бір шекараларын білудің маңызы зор.
Отқа төзімді бұйымдарды өндіру мен оларды қолдану кезінде полиморфты өзгертулер нәтижесінде кристалдардың көлемдік өзгеруін ескеретін температуралық режимді дұрыс таңдау қажет. Сонымен бірге құю әдісімен бұйымдарды өндірудегі кристалдану процесі кезіндегі балқыманың көлемдік өзгерісінің шамасын білудің де маңызы зор. Көптеген технологиялық мәселелерді шешу кезінде, араласпаның қажетті құрамын таңдау, әр түрлі температурадағы бір компонентпен қанықтырылған екінші компоненттің концентрациясын білу қажет болады.
10 – тақырып
1) Полиморфизм құбылысы
Полиморфизм – дегеніміз заттың сыртқы жағдайлар өзгергенде, өзінің кристалдық құрылымын өзгерту мүмкіндігін айтамыз. Бір заттың әр түрлі модификацияларының физикалық қасиеттері түрліше болуы мүмкін. Егер полиморфизм кезінде, заттың құрылымы аз өзгеретін болса, онда оның қасиеті де аз өзгереді. Заттың полиморфты модификациялары бірнешеу болуы мүмкін. М: кремнеземнің табиғатта кварц, тридимит және кристоболит деп аталатын модификациялары кездеседі.
Полиморфты өзгерулердің екі түрі болады. Егер заттың әр бір модификациясы қысым мен температураның белгілі бір мәндеріндегі өзінің тұрақтылық аймағы болса, онда ондай модификациялар энантропты деп аталады.
11 – тақырып
1) Жаңа фаза кристалдануының негізгі кинетикалық заңдылықтары
Кез- келген дене үш түрлі агрегаттық күйде болады: қатты, сұйық, газ тәрізді. Бір күйден екінші күйге өтуі мумкін, егер жаңа жағдайдағы жаңа күй тұрақты болып келсе және де энергияның аз қорына ие болса.
Сыртқы орта жағдайлардың өзгеруіне байланысты бос энергия, сұйық және кристалдық күйлері үшін күрделі заңдылықпен өзгереді.Температураның өзгеруіне байланысты сұйық және қатты күйлер үшін бос энергияның өзгеру сипаты
Кристалдану үшін алғашқы (аналық) ортаның термодинамикалық тепе-теңдігі бұзылуы, яғни ерітіндінің немесе будың аса құрғауы, балқыманың асқын суынуы және т.б. жағдайлар орындалуы тиіс. Кристалдануға қажетті аса құрғау немесе аса суыну температураның, концентрацияның, қысымның, фазааралық электр потенциалыныңтепе-теңдік мәндерінен ауытқуымен сипатталады.
Жаңа фазаның кристалдану кинетикасының негізгі заңдылықтары:
Жаңа фазаның кристалдануы жаңа фаза негізінің пайда болуы мен оның өсу сияқты кезекті жүретін үрдістерден тұрады.
Қаныққан ерітіндіден кристалдану кезінде түзілген цемент тасының құрамына оның беріктігі мен ұзақтұрақтылығын қамтамасыз ететін кальций гидросиликаттары кіреді: олар
5СаОSiO2 5H2O; СаОSiO2H2O; 3СаО2SiO3 3H2O; және негізділігі төмен және негізділігі жоғары тоберморит тәрізді фазалар, сонымен бәрге СаО : SiO2 = 1,7 -2 қатынастағы гидросиликаттар.
Тоберморит тәрізді гидроксикаттар шамамен 100ºС температураға дейінгі температурада түзіліп, олардың өсуі тек қана бір бағытта жүретіндігімен ерекшеленеді, ал талшықтардың орташа қалыңдығы өзгермейді және 10 м шамасында қалады.
11 – тақырып
1) Тұтқыр зат еру процесінің химиялық негізі
Тұтқыр заттардың еруі, басқа қатты заттардың еруіне, соның ішінде бейорганикалық тұздардың еруіне ұқсас. Барлық басқа қатты заттардың еруі сияқты бұл гетерогенді үрдістің материалдың дисперстілік дәрежесінің өсумен және температураның жоғарылауымен жылдамдығы артады. Сонымен бірге бұл үрдіске химиялық қоспаларды қосу арқылы әсер етуге болады.
Тұтқыр заттар, барлық бейорганикалық тұздар сияқты суда ерігенде иондарға ыдырайды. Бірақ барлық тұтқыр заттар аз диссоциацияланатын заттар қатарына жатады. Портландцементтік барлық құрам бөліктері суда ерігенде диссоциацияланады:
а) алит Ca3SiO5 немесе 3CaО ∙ SiO2 (С3S)
Ca3SiO5 ↔ 3Са2+ + SiO32-
в) белит Ca2SiO4 немесе 2CaО ∙ SiO2 (С2S)
Ca2SiO4 ↔ Са2+ + SiO32-
г) үш кальцийлі алюминат Ca3 (АlO3)2 немесе 3СаО ∙ Аl2 O3
Ca3 (АlO3)2 ↔ 3Са2+ + 2АlO33-
д) төрт кальцийлі алюмоферрит Ca3 (АlO3)2 ∙ Са FeO3 немесе
4СаО ∙ Аl2 O3 ∙ Fe2 O3 (Cа АF)
Ca3 (АlO3)2 ∙ Са FeO3 ↔ 4СаО2+ + 2АlO33- + FeО3-2
Жалпы тұтқыр заттарды алу кезіндегі өте жоғары температурада жүретін үрдістер тұрақсыз, яғни метастабильді фазалардың түзілуіне алып келеді. Метостабильділік тұтқыр заттардың көптеген қасиеттерін айқындайды. Мұндай метастабильді , тұрақсыз материалдар сумен әрекеттесу кезінде, соңғы өніммен салыстырғанда қаныққан гидраттар түзеді.
Еру нәтижесінде тұтқыр затпен массасы ерітінді арқылы кристалдану нәтижесінде гидратты жаңатүзілімдер түзе отырып жүйелі түрде азаяды.
Жаңа фазаның кристалдану кинетикасының негізгі заңдылықтары:
Жаңа фазаның кристалдануы жаңа фаза негізінің пайда болуы мен оның өсу сияқты кезекті жүретін үрдістерден тұрады.
Қаныққан ерітіндіден кристалдану кезінде түзілген цемент тасының құрамына оның беріктігі мен ұзақтұрақтылығын қамтамасыз ететін кальций гидросиликаттары кіреді: олар
5СаОSiO2 5H2O; СаОSiO2H2O; 3СаО2SiO3 3H2O; және негізділігі төмен және негізділігі жоғары тоберморит тәрізді фазалар, сонымен бәрге СаО : SiO2 = 1,7 -2 қатынастағы гидросиликаттар.
Тоберморит тәрізді гидроксикаттар шамамен 100ºС температураға дейінгі температурада түзіліп, олардың өсуі тек қана бір бағытта жүретіндігімен ерекшеленеді, ал талшықтардың орташа қалыңдығы өзгермейді және 10 м шамасында қалады.
Алит гидратациялану кезінде гидроксиликаттармен қоса кальций гидроксидін түзеді
2 (3СаО ∙ SiO2) + 6 H2O → 3СаО SiO23 H2O + 3Са(ОН)2
Цементтің құрамында міндетті түрде 3-5% мөлшерде гипстің, цементтің құрамындағы темірі бар фазаларымен әрекеттесуі кезінде 100ºС дейінгі температурада кальций гидросульфалюминатының жоғары сульфатты формасы түзіледі
3СаО ∙ Аl2 O3 + 3Са SO4 + 30 Н2О → 3СаО ∙ Аl2 O3 · 3Са SO4 ·30 Н2О
Бұл гидраттың кристалдары ине тәріздес, ұзарған пішінде болып келеді. Жоғары температурада өте тез, ал қалыпты температура мен гипс тапшылығы жағдайында кальцидің гидросульфоалюминаты аз сульфатты формасына ауысуы мүмкін.
3СаО ∙ Аl2 O3 ∙ 3Са SO4 ∙ 30 Н2О → 2 (3СаО ∙ Аl2 O3) + 6 Н2О → 3 (3СаО ∙ Аl2 O3 ∙ Са SO4 ∙ 12 Н2О)
Жоғарыда аталған үрдістер қаныққан ерітіндіден сәйкес иондардың кристалдануы нәтижесінде түзіледі. Кальций гидроалюминаты да осыған ұқсас түзіледі.
Кальций гидроксидінің қатысында үшкальцийлі алюминат цементтің гидратациясы кезінде мына жолмен әрекеттесуі мүмкін.
Са3 (Аl O2)2 + Са (OН)2 + 12Н2О → Са3 (Аl O2)2 · Са (OН)2 · 12Н2О
Бұлардан басқа цемент тасында кальций гидроалюминатының пластинка, куб, октаэдр пешіндегі басқа түрлері және жоғары дисперсті Ca (FeO2)2 ∙ 4H2O кальций гидроферраттары болуы мүмкін.
11 – тақырып
1) Тұтқыр заттың гидратациялық қатаюының кинетикасы
Тұтқыр заттың қатаюы бір-біріне тәуелді бірнеше сатылардан тұрады: тұтқыр заттың қатаю суында еруі, гидратациялану реакциясының нәтижесінде кристалогидраттардың түзілуі және қатаю үрдісі. Гидратациялық қатаю үрдісінің жылдамдығы ең төмен саты жылдамдығына тәуелді болады.
Тұтқыр заттарды негізгі екі типке бөлуге болады:
а ) Бірінші типтен тұтқыр заттарда, атап айтқанда тез қатаятын гипстік тұтқыр заттарда жылдамдығы ең төмен саты гипстік кристалдану үрдісі болып табылады.
б) Екінші типтегі тұтқырлар, цементтің силикатты құраушыларында жылдамдығы ең төмен саты, еру сатысы.
Әр типтегі тұтқыр заттардың гидратациялық қатаюының кинетикасын біле отырып, ол үрдісті басқаруға болады. Мысалы: бірінші типтегі тұтқыр заттардың қатаюын жылдамдату үшін кристалдардың пайда болуы мен өсуін тездететін кристалданудың дайын орталықтарын қосуға болады. Біршама баяу қатаятын екінші типтегі тұтқыр заттардың ең баяу сатысы, олардың еруі болғандықтан, қатаюды жылдамдату үшін: цементтің дисперстілік дәрежесін арттыру, температураны жоғарлату және қоспа қосу арқылы қол жеткізу мүмкін.
Тұтқыр заттардың қатаюы бастапқы зат дәндерінің жоғары дисперсті жаңатүзілімдер қабықшаларымен экрандалуына да тәуелді болады. Ол қабықшалар тұтқыр зат дәндерін жұқа қабықшамен қаптап олардың сумен жанасуын болдырмайды. Мысалы цементте қатаю үрдісін тежейтін, осындай қабықша түзуші зат гидросульфоалюминат және кальций гидроксиді болып табылады.
Тұтқыр заттың қатаю кинетикасын ескере отырып жалпы тұтқырларға және цемент тасына мынандай талаптар қойылады:
1)Бастапқы заттар гидротациялық қатаятын тұтқыр зат болуы ұшін, суда еруі және осы еру нәтижесінде соңғы өнім гидраттық жаңатүзілімдерге қарағанда басым қаныққан ерітінді түзулері қажет.
2)Тұтқыр заттың еру жылдамдығы және басым қаныққан ерітінді түзуі, пайда болатын жаңа фазаның сәйкес дисперстілігі мен қатаюының қажетті жылдамдығын қамтамасыз етуі тиіс. Себебі осы үрдістерге цемент тасының физика және құрылымдық-механикалық қаиеттері тәуелді болады.
3)Түзілген гидратты жаңатүзілімдердің судағы ерігіштігі мүмкін болған дәрежеде төмен болуы тиіс, кері жағдайда материалдың суғатөзімділігі төмен болады.
4)Тұтқыр заттар қатаю суының аз мөлшерде қажетті пластикалық масаны қалыптастыруы тиіс, сондай жағдайда қалыптасқан материал қажетті тығыздыққа және соған сәйкес беріктік пен өткізбейтін қабілетке ие болады.
Тұтқыр заттың гидратациялық қатаюуы
еру
 С3S
+ n H2O
→ С3S
· n H2O
→
С3S
+ n H2O
→ С3S
· n H2O
→
А → Б→ В
А-еріген тұтқыр зат
Б-пайда болған аралық кристалдар
В-қатайған цемент тасы,соңғы өнім.
11 – тақырып
1) Әрекеттесуші фазалар концентрациясының процестің жылдамдығына әсері
Химиялық кинетиканың негізгі заңы бойынша химиялық реакцияның жылдамдығы әрекеттеуші заттар концентрацияларының көбейтіндісіне тура пропарционал
RCna*Cmb
Мұндағы R- химиялық реакция константасы
Са *Св-әрекеттеуші заттардың концентрациясы
n* m коэфициент
м: R C(H2 SO4)*С2(NaOH)
яғни химиялық реакцияның жылдамдығы әрекеттесуші заттардың концентрациясы жоғары болған сайын артады. Ал реакция константасы R заттардың концентрациясына тәуелді емес, тек олардың бір-бірімен әрекеттесу қабілетін сипаттайды.
12 – тақырып
1) Гомогенді реакция жылдамдығы
Гомогенді химиялық реакцияның жылдамдығы уақыт бірлігінде әрекеттеуші заттардың біреуінің концентрациясының өзгерісімен анықталады.
ортСt
Мұндағы: СС1-С2
tt1-t2
Реакцияға қатысушы заттардың концентрацияларының өзгерісі арасында байланыс болғандықтан реакция жылдамдығын анықтау кезінде компоненттердің біреуінің концентрациясын өзгеруін анықтау жеткілікті.
Мысалы:
Н2SO4+2NaOHNa2SO4+2H2O
2H++SO2-4+2Na++2OH2Na++SO2-4+2H2O
2H++2OH-2H2O
Химиялық кинетиканың негізгі заңы бойынша химиялық реакцияның жылдамдығы әрекеттеуші заттар концентрацияларының көбейтіндісіне тура пропарционал
RCna*Cmb
Мұндағы R- химиялық реакция константасы
Са *Св-әрекеттеуші заттардың концентрациясы
n* m коэфициент
м: R C(H2 SO4)*С2(NaOH)
яғни химиялық реакцияның жылдамдығы әрекеттесуші заттардың концентрациясы жоғары болған сайын артады. Ал реакция константасы R заттардың концентрациясына тәуелді емес, тек олардың бір-бірімен әрекеттесу қабілетін сипаттайды.
12 – тақырып
1) Гетерогенді реакция жылдамдығы
Гетерогенді реакция деп әр түрлі фазада болатын компоненттердің арасында, гетерогенді ортада өтетін процестерді айтамыз.
М: СаСО3 → СО2 + СаО
гетерогенді реакциялардың жылдамдығы бұл айтылғандардан басқа фазаның жүктелген жеке бөліктерінің күйіне, жылу және масса алмасу жағдайларына, т.б. тәуелді.
12 – тақырып
1) Тізбекті реакциялар жылдамдығы
Тізбекті реакцияларды сипаттау үшін бос радикал деп құрамында жұптаспаған бос электрондары бар атом немесе атомдар тобын айтады.
Тізбекті реакциялар үш сатыдан тұрады: белсенді орталықтың пайда болуы, дамуы және тізбектің үзілуі.
Яғни тармақталған тізбекті реакция типінде әрбір белсенді орталық реакцияның кейінгі сатысында бір немесе бірнеше белсенді орталықтардың пайда болуына алып келуі мүмкін.
12 – тақырып
Параллельді реакциялар жылдамдығы
Химиялық реакциялар жүру механизмінде байланысты бірізді және параллельді болуы мүмкін:
- бірізді А В Г С. яғни үрдістің бастапқы сатысында түзілген өнім оның кейінгі сатысына жұмсалады. М: тұтқыр заттың еруі мен жаңатүзілімдердің кристалдануы. Мұндай реакциялардың жылдамдығы ең баяу сатының жылдамдығымен анықталады. Негізгі қорытынды бастапқы заттар бірден әрекеттесіп соңғы өнімге айналмайды, олар бірнеше аралық сатылардан өтеді.
- параллельді реакциялар: бастапқы заттар екі немесе бірнеше бағытта бірдей жүретін реакцияларды айтады
Параллельді реакциялардың жылдамдығы мына формуламен анықталады.
R1С+R2C+R3C+...RnC(R1+R2+...Rn)С
Яғни параллельді реакцияның жылдамдығы оны құрайтын құрам бөліктердің жылдамдықтарының қосындысына тең. Егер кейбір реакцияның жылдамдығы төмен болса, онда параллельді реакцияның жылдамдығы ең жылдам реакция жылдамдығымен анықталады.
12 – тақырып
Химиялық реакция жылдамдығына әсер етуші факторлар
Концентратция, температура.
Катализатор қатысында жүретін үрдістерді катализ деп атайды. Катализатор химиялық реакцияның белгілі бір сатысына қатыса отырып оның белсендіру энергиясын төмендетіп, жылдамдығын арттырады.
Химиялық кинетикада химиялық процесстердің механизмі мен жылдамдығын қарастыру кезінде бір-бірімен байланысты екі құбылыс қарастырылады:
-сыртқы факторларға (температура, қысым, концентрация) тәуелді болған химиялық реакция кезіндегі мокроскопиялық өзгерістер, сонымен бірге бұл өзгерістер белгілі-бір химиялық сатылардан тұрады
-химиялық реакцияларға алып келетін нақты элементарлық актілер, яғни микродүниеде жүретін құбылыстар
13 – тақырып
1) Құрылыс материалдарындағы коррозия үрдісі
Кез келген құрылыс материалдары немесе құрылыс ғимараттары қызмет ету үрдісі кезінде қоршаған ортамен үнемі байланыста болады, яғни бұл ғимаратты тұрғызуда істетілген материалда сыртқы орта компоненттерімен әрекеттеседі. Егер мұндай әрекеттесу құрылыс конструкциясының беріктігінің төмендеуіне немесе жұмыс істеу мерзімінің азаюына алып келсе, онда сыртқы орта факторлары осы материалға байланысты агрессивті деп аталады.
Материал мен орта факторларының әрекеттесуі физикалық жағдайларға: температураға, агрессивті ортаның фазалық құрамына, жанасу жағдайларына, сұйық немесе газ тәрізді ортаның қысымына, т.б. факторларға тәуелді болады. Материалдың бұзылуына алып келетін химиялық немесе физика-химиялық үрдістер коррозия үрдісі деп аталады.
М.Москвин бетонда жүретін коррозиялық үрдісті негізгі үш типке жіктейді:
1.Цемент тасы құрамындағы компоненттердің, әсіресе Са(ОН)2 кальций гидроксидінің суда еруі нәтижесінде жүретін коррозиялық үрдіс.
2. Цемент тасының компоненттері мен орта компоненттері арасында суда еритін өімдер түзу арқылы жүретін коррозиялық үрдіс.
3.Коррозияның үшінші типті бетонның кеуетері, капилярлары мен сызаттарында жинақталған тұздардың агрессивті әсері нәтижесінде жүретін үрдістер.
Негізі құрылыс-конструкциялық материалдары газдау ортасының компоненттерімен, сумен және суда еріген заттармен химиялық әрекеттесу қабілетіне ие. Химиялық тұрғыдан алғанда бұлар бейтараптану немесе алмасу реакциялары. Коррозиялық үрдістің бағыты әрекеттесуші заттардың қасиеттері мен реакция өнімдеріне тәуелді болады. Егер коррозиялық реакциялардың нәтижесінде суда еритін өнімдер түзілсе, онда үрдістің қарқындылығы артады. Егер реакция нәтижесінде суда ерімейтін зат түзілсе, онда коррозиялық үрдістің қарқыны төмендеп материалға кері әсері азаяды.
13 – тақырып
1) Құрылыс материалдарын коррозиядан қорғау әдістері тығыздықты арттыру, суда ерігіштігін азауту.
В.М.Москвин бетонда жүретін коррозиялық үрдісті негізгі үш типке жіктейді:
Цемент тасы құрамындағы компоненттердің, әсіресе Са(ОН)2 кальций гидроксидінің суда еруі нәтижесінде жүретін коррозиялық үрдіс. Жалпы қатты фаза мен сұйық фазаның фазалар бөлінуінің шекарасында жүретін гетерогенді реакцияның жылдамдығы агрессивті компоненттердің цемент тасы ішіне немесе Са(ОН)2 –нің агрессивті компонентіне қарсы диффузиялану жылдамдығына тәуелді болады. Жалпы қалыпты жағдайда Сa(ОН)2 суда ерігіштігі 1,3г/л (СаО –ға есептегенде) құрайды.
Ең алдымен бетонның сыртқы қабатындағы Са(ОН)2 суда ери бастайды, содан соң біртіндеп кальцийдің гидросиликаттары мен гидроалюминаттары гидролиздене бастайды. Осылайша бетонның бетінде коррозия өнімдерінен тұратын қабат пайда болады. Егер бұл қабат сақтанатын болса, онда коррозия өнімдерінің диффузиялық қарсылығына байланысты коррозия үрдісінің жылдамдығы күрт төмендейді. Ал егер коррозия өнімдері бетон бетінен шайылып алып кетілетін болса, онда Са(ОН)2 диффузиялану жылдамдығына байланысты коррозия үрдісі одан әрі қарқынды дами бастайды. Зерттеулер егер Портландцементтегі Са(ОН)2 мөлшері оның алғашқы мөлшерінен 20 % төмендесе, онда цемент тасының беріктігінің негізін құрайтын кальций гидросиликаты гидролизінің ыдырауы басталады. Әсіресе бұзылу цемент тасының ең кернеуленген бөліктерінде қарқынды жүреді. Практикада бірінші типтегі коррозия бетонға жұмсақ сулар әсер еткенде жүреді.
2. Цемент тасының компоненттері мен орта компоненттері арасында суда еритін өімдер түзу арқылы жүретін коррозиялық үрдіс. Жалпы цемент тасы сілтілі ортаға ие, сондықтан олар қышқылдармен цемент тасының құрамындағы Са(ОН)2 мен әрекеттесу нәтижесінде түзілетін өнімдердің әр түрлілігіне байланысы оларды агрессивті әсері де әр түрлі болады. Егер қиын еритін тұздар түзілсе, онда олар цемент тасының кеуектеріне тұнып коррозия үрдісінің кедергі жасайды, ал егер жақсы еритін тұздар түзілсе, үрдіс қарқынды жүре бастайды.
а) Н2SiF6+3Ca(OH)2→3CaF2↓+SiO2↓+H2O
Реакция нәтижесінде түзілген СaF2 және SiO2 гелі нашар еритін заттар, сондықтан бұл қышқылдардың әсер коррозияның қарқындылығын төмендетеді
б) 2HCl + Ca(OH)2 → CaCl2 + H2O
в) СH3COOH + Ca(OH)2 → (CHCOO)2Ca + 2H2O
бұл екі қышқылдың Ca(OH)2 әрекеттесуші нәтижесінде суда жақсы еритін зат түзіледі, сондықтан бұл қышқылдар бетондар үшін өте агрессивті.
г) Табиғатта көп таралған көмір қышқылы, ол барлық ғимараттардағы бетондарға суда да, ауада да әсер етеді. Егер оның мөлшері аз болса, онда ол
Са(ОН)2 + СО2 → СаСО3↓ + Н2О
бірақ СО2 –нің мөлшері артса онда реакция мына бағытта жүреді:
СаСО3 + СО2 + Н2О ↔ Са(НСО3)2
Онда СаСО3; СО2; Са(ОН)2 тұратын жүйеде тұрақсыз тепе-теңдік қалыптасады және ол СО2 концентрациясына тәуелді болады.
Сонымен бірге табиғи суларда әр түрлі тұздардың ерітіндісі болады. Олардың кейбіреулерінің бетонға агрессивті әсер жоқ, ал кейбіреулері өте агрессивті. Бірінші топтағы тұздарға, мысалы NaCl ерітіндісі жатады.
NaCl + Ca(OH)2↓ ↔ NaOH + CaCl2
яғни мұндай тұздар цемент тасының компоненттерімен белсенді әрекеттеспейді.
Бетонға әсіресе күкірт қышқылы тұздары болатын сулар өте қауіпті. Мұндай агрессивті әсер нәтижесінде бетон ісініп, конструкцияда сызаттар пайда блады.
3СаО∙Al2O3 + 3CaSO4 + 30H2O = 3CaO∙Al2O3∙3CaSO4 ∙30H2O
Кальций гидросульфоалюминатының түзілуі нәтижесінде қатты фазаның көлемі 2,6 есеге артады. Соның нәтижесінде бетонда сызаттар пайда болып, ол бұзылады. Цементтің сульфатты төзімділігі оның құрамындағы үшкальцийлі алюминаттың мөлшеріне тәуелді болады. Ондай цементтердің құрамындағы үшкальцийлі алюминаттың мөлшері 5% артпауы тиіс.
3.Коррозияның үшінші типті бетонның кеуетері, капилярлары мен сызаттарында жинақталған тұздардың агрессивті әсері нәтижесінде жүретін үрдістер.
а) карбонизация
Са(ОН)2 + СО2 → СаСО3↓ + Н2О
б) ократация
Са(ОН)2 + SiF4 → 2CaF2↓ + SiO2↓ + 4H2O
в) флюотация
Н2SiF6 + 3Ca(OH)2 → 3CaF2↓ + SiO2 + 4H2O
13 – тақырып
1) Құрылыс материалдарындағы коррозияның негізгі түрлері
.М.Москвин бетонда жүретін коррозиялық үрдісті негізгі үш типке жіктейді:
Цемент тасы құрамындағы компоненттердің, әсіресе Са(ОН)2 кальций гидроксидінің суда еруі нәтижесінде жүретін коррозиялық үрдіс.
2. Цемент тасының компоненттері мен орта компоненттері арасында суда еритін өімдер түзу арқылы жүретін коррозиялық үрдіс.
3.Коррозияның үшінші типті бетонның кеуетері, капилярлары мен сызаттарында жинақталған тұздардың агрессивті әсері нәтижесінде жүретін үрдістер.
13 – тақырып
1) Қоршаған орта факторларының коррозия үрдісіне әсері
Кез келген құрылыс материалдары немесе құрылыс ғимараттары қызмет ету үрдісі кезінде қоршаған ортамен үнемі байланыста болады, яғни бұл ғимаратты тұрғызуда істетілген материалда сыртқы орта компоненттерімен әрекеттеседі. Егер мұндай әрекеттесу құрылыс конструкциясының беріктігінің төмендеуіне немесе жұмыс істеу мерзімінің азаюына алып келсе, онда сыртқы орта факторлары осы материалға байланысты агрессивті деп аталады.
Цемент тасының компоненттері мен орта компоненттері арасында суда еритін өімдер түзу арқылы жүретін коррозиялық үрдіс. Жалпы цемент тасы сілтілі ортаға ие, сондықтан олар қышқылдармен цемент тасының құрамындағы Са(ОН)2 мен әрекеттесу нәтижесінде түзілетін өнімдердің әр түрлілігіне байланысы оларды агрессивті әсері де әр түрлі болады. Егер қиын еритін тұздар түзілсе, онда олар цемент тасының кеуектеріне тұнып коррозия үрдісінің кедергі жасайды, ал егер жақсы еритін тұздар түзілсе, үрдіс қарқынды жүре бастайды.
а) Н2SiF6+3Ca(OH)2→3CaF2↓+SiO2↓+H2O
Реакция нәтижесінде түзілген СaF2 және SiO2 гелі нашар еритін заттар, сондықтан бұл қышқылдардың әсер коррозияның қарқындылығын төмендетеді
б) 2HCl + Ca(OH)2 → CaCl2 + H2O
в) СH3COOH + Ca(OH)2 → (CHCOO)2Ca + 2H2O
бұл екі қышқылдың Ca(OH)2 әрекеттесуші нәтижесінде суда жақсы еритін зат түзіледі, сондықтан бұл қышқылдар бетондар үшін өте агрессивті.
г) Табиғатта көп таралған көмір қышқылы, ол барлық ғимараттардағы бетондарға суда да, ауада да әсер етеді. Егер оның мөлшері аз болса, онда ол
Са(ОН)2 + СО2 → СаСО3↓ + Н2О
бірақ СО2 –нің мөлшері артса онда реакция мына бағытта жүреді:
СаСО3 + СО2 + Н2О ↔ Са(НСО3)2
Онда СаСО3; СО2; Са(ОН)2 тұратын жүйеде тұрақсыз тепе-теңдік қалыптасады және ол СО2 концентрациясына тәуелді болады.
Сонымен бірге табиғи суларда әр түрлі тұздардың ерітіндісі болады. Олардың кейбіреулерінің бетонға агрессивті әсер жоқ, ал кейбіреулері өте агрессивті. Бірінші топтағы тұздарға, мысалы NaCl ерітіндісі жатады.
NaCl + Ca(OH)2↓ ↔ NaOH + CaCl2
яғни мұндай тұздар цемент тасының компоненттерімен белсенді әрекеттеспейді.
Бетонға әсіресе күкірт қышқылы тұздары болатын сулар өте қауіпті. Мұндай агрессивті әсер нәтижесінде бетон ісініп, конструкцияда сызаттар пайда блады.
3СаО∙Al2O3 + 3CaSO4 + 30H2O = 3CaO∙Al2O3∙3CaSO4 ∙30H2O
Кальций гидросульфоалюминатының түзілуі нәтижесінде қатты фазаның көлемі 2,6 есеге артады. Соның нәтижесінде бетонда сызаттар пайда болып, ол бұзылады. Цементтің сульфатты төзімділігі оның құрамындағы үшкальцийлі алюминаттың мөлшеріне тәуелді болады. Ондай цементтердің құрамындағы үшкальцийлі алюминаттың мөлшері 5% артпауы тиіс.
13 – тақырып
Карбонизация үрдісі, оның құрылыс материалдарының тұрақтылығына әсері
а) карбонизация
