
- •1Құрылыс материалдары химиясы пәні, мақсаты, міндеттері
- •Заттардың физика-химиялық қасиеттері олардың кристалдық торларының типтеріне тәуелді болады.
- •2) Изотермиялық дәптерде бар.
- •Термодинамиканың екінші заңы- кез келген процесс Ықтималдылығы төмен күйден Ықтималдылығы жоғары күйге қарай жүреді.
- •Диспесті жүйелердің жіктелуі.
- •Кремнийдің негізгі қосылыстары:
- •Күй диограммалары жайлы жалпы түсінік.
- •Диференциалды-термиялық талдау әдісі.
- •Рентгендік талдау әдісі.
- •Диференциалды-термиялық талдау әдісі.
- •Рентгендік талдау әдісі.
- •Титриметриялық анализ әдістерінің классификациясы (жіктелуі)
- •Титриметрлік талдау
- •Пластификаторларды қолданудың технико- экономикалық тиімділігі.
- •Ұялы бетондар үшін кешенді қоспалар.
- •Ұялы бетондар үшін кешенді қоспалар.
- •Битум мен қара майлардың негізгі қасиеттері
- •Битум мен қара майлардың негізгі қасиеттері
- •2 Эакты қасиет корсетеді он, сно
- •Полимерлер мономерлерден синтезделеді, полимердің қайталанып отыратын ең кіші бөлігін құрылым буыны, ал олардың санын полимерлену дәрежесі деп атайды.
Сондықтан жүйенің ішкі энергиясын сипаттау үшін оның әр түрлі күйлердегі ішкі энергиясының мәнін білу жеткілікті. Жүйенің бастапқы күйіне қайтып әкелетін тұйық үрдістер үшін Δ U мәні нольге тең.
4 – тақырып
1) Жылу және жұмыс
2) Изотермиялық процесс кезіндегі термодинамиканың бірінші заңы
Жылу дегеніміз микробөлшектердің ретсіз қозғалысы негізінде берілетін қозғалыс. Термодинамиканың бірнеше бастамасының теңдеуі энергияның сақталу заңының математикалық бейнелеуі болып табылады:
Q=ΔU+A
яғни жүйеге берілген жылу оның ішкі энергиясының өсуі мен жүйенің жұмыс жасауына жұмсалады.
Бұдан өзгеше жұмыс, бөлшектердің өте үлкен санынан тұратын макроскопиялық массалардың белгілі бір күштің әсерінен болатын ретті қозғалыс формасы болып табылады.
Q жылу мен А жұмыс жүйе күнінің функциясы бола алмайды, себебі ол өзгерістің жүру жолына тәуелді болады. Мысалы: газдың ұлғаюы, оның қысымы Р мен көлемі өсуінің көбейтіндісіне тең.
A=pΔV
Жылу да жұмыс сияқты жүйе күйінің функциясы бола алмайды, бұл екі шама жүйеге емес, үрдіске тиісті.
2) Изотермиялық дәптерде бар.
Тұрақты
температурада жүретін процессті
изотермиялық деп атайды (грекше
«термос»-жылу). (Т=const) болғандықтан,
газдың ішкі энергиясы өзгермейді,яғни
dW=0.
Онда
термодинамиканың бірінші заңы Q=
A болады,яғни
газды
изотермиялық қыздырғанда оған берілген
барлық жылу сыртқы күштерге қарсы жұмыс
істеуге кетеді. Газдың
шексіз аз ұлғайған кезіндегігі жұмысын
dA
табайық,
өйткені бұл кезде қысымның өзгерісін
ескермей тұрақты деп алуға болады, (7,7)
бойынша dA=PdV.
газдың
кез-келген массасы үшін жазылған
Клапейрон-Менделеев теңдеуіне қысымды
тауып, жоғарыдағы формулаға қоямыз: PV=![]() RT
бойынша
RT
бойынша ![]()
Газдың V1-ден V2-ге ұлғайған кездегі толық жұмысын табу үшін, соңғы өрнекті интегралдаймыз:
A=
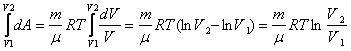 (7,10)
(7,10)
Бойль-Мариотт
заңы бойынша ![]() болғандықтан
болғандықтан ![]()
Немесе dQ= dA ескерсек
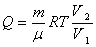 (7,11)
(7,11)
формулаларды салыстыра отырып мынадай физикалық қорытынды жасауға болады:
4 – тақырып
1) Термодинамиканың бірінші заңы
2) Изохоралық процесс кезіндегі термодинамиканың бірінші заңы
Термодинамиканың бірнеше бастамасының теңдеуі энергияның сақталу заңының математикалық бейнелеуі болып табылады:
Q=ΔU+A
яғни жүйеге берілген жылу оның ішкі энергиясының өсуі мен жүйенің жұмыс жасауына жұмсалады.
Жылу екі түрлі жағдайда жүйе күшінің функциясына айналуы мүмкін:
Изохоралық үрдіс, яғни көлем тұрақты болған үрдіс кезінде:
V=cons A=pΔV=0 болады
соған сәйкес 4.3 теңдеу мынандай түрге ие болады:
Q=ΔU (4.4)
яғни барлық жылу ішкі энергияның өзгерісіне жұмсалады.
4 – тақырып
1) Ішкі энергия және оның өзгерісі
2) Энтальпия және оның өзгерісін анықтау
Ішкі энергия дененің (жүйенің) тек ішкі күйіне байланысты энергия. Ішкі энергияға дененің барлық микробөлшектерінің (молекулалардың, атомдардың, иондардың, т.б.) ретсіз (хаосты) қозғалыстарының энергиясы, микробөлшектердің өзара әсерлесу энергиясы, атомдар мен молекулалардың ішкі энергиясы, т.б. жатады. Ішкі энергия ұғымын 1851 жылы У.Томсон енгізген.
Дененің бір күйден екінші күйге ауысу барысындағы Ішкі энергиясының өзгерісі (ΔU) мынаған тең: ΔU=ΔQ–A, мұндағы Q – жүйенің қоршаған ортамен алмасқан жылу мөлшері, А – істелген жұмыс. Бұл теңдеу жылу алмасу процесі басты рөл атқаратын жүйелердегі энергияның сақталу және айналу заңын (термодинамиканың бірінші бастамасын) өрнектейді. Энергияның сақталу заңына сәйкес Ішкі энергия физикалық жүйе күйінің, яғни осы күйді анықтайтын тәуелсіз айнымалылардың (мысалы, температура, көлем не қысым), бір мәнді функциясы болады. Q және А шамаларының әрқайсысы жүйені Ішкі энергиясы U1-ге тең күйден U2-ге тең күйге ауыстыратын процестің сипатына тәуелді болады, ал ΔU=U2–U1.
Энтальпия дегеніміз- жүйенің меншікті жылу сиымдылығы
Q= H2 – H1 =ΔH
Гесс заңы бойынша химиялық реакциялардың жылу эффектісі үрдістің аралық сатыларына емес, тек әрекеттеуші заттардың бастапқы және соңғы күйіне ғана тәуелді болады.
Энтальпия мен реакция жылуының арасында мынадай тәуелділік бар:
ΔH = - Q
ΔH=0 болатын стандартты күй ретінде элементтерден 1 атом қысым және 25оС температура кезіндегі энтальпия мәні алынған.
4 – тақырып
1) Гесс заңы және оның салдары
2) Изобаралық процесс кезіндегі термодинамиканың бірінші заңы
Гесс заңы бойынша химиялық реакциялардың жылу эффектісі үрдістің аралық сатыларына емес, тек әрекеттеуші заттардың бастапқы және соңғы күйіне ғана тәуелді болады.
Термодинамиканың бірінші заңы, термохимияның негізін құрайтын, оның маңызды салдары — Гесс заңы. Термохимия әр түрлі заттардың жылу сыйымдылығын, жану жылуын, реакцияның жылу эффектісін, түзілу жылуын, еру жылуын, т.б. зерттейді.
Изоборалық үрдіс, яғни тұрақты қысым жағдайында жүретін үрдіс кезінде:
p=const A=p(V2 – V1)
яғни жұмыс өзгеріс жолына емес, оның бастапқы және соңғы күшіне тәуелді болады. Бұл жағдайда 4.3. теңдеу мынандай түрге ие болады.
Qp = U2 – U1 + pV2 – pV1
U+pV=H бұл жүйе күшінен жаңа функциясы, энтальпия деп аталады. Сонда:
Q= H2 – H1 =ΔH
4 – тақырып
1) Қайтымды және қайтымсыз процестер
2) Энтропия және оның өзгерісін анықтау
Қайтымды процестер жане химиялық тепе тең қайтымды процесс деп- бір мезігілде бірдей жүретін процесстерді айтамыз.
Термодинамиканың екінші заңымен негізгі мазмұны нақты қайтымды үрдіс жағдайында да жұмысқа тек жылудың белгілі бір бөлігі ғана айналуы мүмкін, ал қалған бөлігі жұмыс жасамай жоғалады.жүйе энтропиясының артуы жүйенің ықтималдылығы төмен күйден, ықтималдылығы жоғары күйге өтуін сипаттайды.
Қайтымсыз үрдістер үшін:
dSdQT (11)
Химиялық реакциялардың энтропиясын анықтау үшін мына теңдеу қолданылады:
SS р. ө. -S б. з. (12)
М: Ca (OH)2 (қ)+ Са 2 (т) Са СО3 (қ) +Н2О(с)
S Ca (ОН)2 (қ)+76,86 кДж(моль*град)
S Co2 г213,94Дж(моль*град)
S Ca CO3 (қ)39,81Дж(моль*град)
S H2O(с)70,06Дж(моль*град)
S(76,86+213,94)-(39,81+70,06)290,8-109,87180,93Дж(моль*град)
Яғни үрдіс өздігінен жүреді.
Больцман жүйе күйінің басқа функциясы S-энтропияны енгізді. Энтропия ықтималдылық пен қарапайым қарым-қатынаспен байланысқан.
SR Ln w
Яғни энтропия Болбцман тұрақтысына көбейтілген логарифмделген ықтималдылық. Энтропияны жүйедегі ретсіздіктің өлшемі ретінде қарастыруға болады.
Термиялық шамалар мен энтропия мына тәуелділікпен байланысқан.
SQT (9)
Жүйе энтропиясының өзгерісі арқылы үрдістің жүру бағытын анықтауға болады. Оқшауланған жүйелерде S0 энтропияның артуы бағытындағы үрдістер өздігінен жүреді. Тепе-теңдік орнағанда энтропия ең жоғары мәнге ие болып, он үрдісі нолге тең болады (S).
5– тақырып
1) Термодинамиканың екінші заңы, оның мәні
2) Төмендегі реакция үшін бос энергияның өзгерісін анықтаңдар:
Сa (OH)2(k) + Na2 SiO3 (к) → Ca SiO 3(к) +2Na OH(с)
Термодинамиканың екінші заңын тұжырымдау үшін, үрдістердің неліктен нақты осы бағытта жүретіндігін, неге тепе-теңдік күй болатындығын сипаттайық.
Термодинамиканың екінші заңы- кез келген процесс Ықтималдылығы төмен күйден Ықтималдылығы жоғары күйге қарай жүреді.
5 – тақырып
1) Изотермия-изобаралық потенциал
2)Төмендегі реакцияның жылуын анықтаңдар:
Сa(OH)2(k) + CO2(г) Ca CO3(г) + H2O(с)
Изобаралық-изотермиялық потенциал — тұрақты температура мен қысымдағы процестердің теңсалмақтылығы мен бағыттылығының критерийі. Тұрақты температура мен көлемде өтетін процестердің теңсалмақтылығы мен бағыттылығының критерийі изохоралық-изотермикалық потенциал-Ғ (синонимі: изохоралық потенциал, еркін энергия), ол энтропияның-S абсолют температураға-Т көбейтілген шамасына азайтылған ішкі энергияға-U тең.
6 – тақырып
1) Фазалар шекарасындағы құбылыстар
Адсорбция, абсорбция, жұғу т.б
Кез келген фазалардың шекарасы, шекараланатын фазаларың ішкі бөлімдерінен өздерінің физика химиялық қасиеттері бойынша ерекшеленеді. Бұл ерекшелік фазалар шекарасындағы беттік бос энергияның артық мөлшерде болуымен сипатталады.
Мәселен сұйықтықтың ортасында орналасқан молекулаларға оның жан-жағында орналасқан молекулалардың тарту күші әсер етеді. Молекулааралық тарту күші өте жақын қашықтықтарға әсе ететін болғандықтан, молекулалар тек өзінің айналасында орналасқан молекулалардың ғана, әсерін ғана сезеді. Ал бұл жағдайдағы молекулалардың жалпы әсер күші нөлге тең болады, сондықтан молекланың сұйықтың ішінде орын ауыстыруы үшін, жұмыс жасаудың қажеті болмайды.
Ал молекуланы сұйықтың бетіне алып шықсақ, онда молекулалардың теңәсерлі күші теңеспей қалады. Бұл газ тәрізді фазадағы молеклалардың бір-бірінен өте алыс қашықтықта орналасқандығынан, олардың арасындағы әсерлесу күші мардымсыз болуына байланысты болады. Сондықтан сұйық-газ фазалар шекарасында орналасқан молекулаға тек қана сұйық фаза жағынан ғана тарту күші әсер етіп, ал газтәрізді фаза жағынан оны теңестіретін күш болмайды. Демек сұйық фаза мен газтәрізіді фаза шекарасында орналасқан молекулалар, тек сұйық фаза жағынан ғана тарту күшін сезінеді. Олар үшін молекуларалық тарту күшінің жалпы жиынтығы нөлге тең емес және ол сұйық фазаға қарай бағытталған.
Барлық молекулалардың 1см2 сұйықтықтың бетіне әсер етуші теңәсерлі күші, молекулярлы немесе ішкі қысым деп аталады. Судың ішкі қысымы 15000 атм., ал бензолда 4000 атм. тең. Демек кез келген сұйықтың бетіне, молеклааралық әсерлесуші күштердің теңеспегендігіне байланысты пайда болатын және молекулаларды сұйық фазаның ішіне қарай тартуға тырысатын үлкен қысым әсер етеді. Яғни жаңа фазалар шекарасын қалыптастыру үшін, молекулалардың тарту кұшіне қарсы жұмыс жасау қажет.
Фазалар шекарасының 1см2 бетін түзу үшін жасалатын жұмыс немесе соған эквивалентті болған 1см2 бетік бос энергия бетттік кернеулілік деп аталады. Ол σ таңбасымен белгіленіп, эрг/см-2 шамасымен өлшенеді.
Беттік кернеулілілікті анықтаудың бірнеше әдістері бар:
- көпіршіктердің пайда болуының ең үлкен қысымы әдісі (Ребиндер приборы);
- тамшыларды есептеу әдісі (сталагмометр);
- сұйықты капиллярлық көтеру әдісі.
Заттардың фазалар шекарасында концентрациялануы адсорбция деп аталады.
Адсорбцияланушы зат адсорбтив, ал адсорбциялағыш зат адсорбент деп аталады.
Адсорбция – бұл беттік бос энергияны төмендету арқылы өздігінен жүретін процесс. Белгілі концентрациядағы ерітіндінің беттік кернеулілігін біле отырып, фазалар шекарасындағы адсорбцияны есептеуге болады. Беттік кернеуліліктің төмендеуімен жүретін адсорбция үрдісінің теңдеуін Гиббс енгізген:
Г=- dσ| dc ∙ c| RT
Гиббс теңдеуін төмендегідей жолмен шығаруға болады. Белгілі С (моль/л) конйентрациядағы және σ (эрг/см2) беттік екрнеуліліктегі ерітіндіні алайық. Ерітіндінің өзінің буымен фазалар шекарасы S меншікті беттік ауданға және 1моль еріген затқа ие болсын. Онда:
Г= 1| S моль/ см2
болады.
Егер фазалар шекарасына заттың өте аз мөлшерін өткізсек, онда беттік кернеулілік dσ мәніне өзгереді. Сонда беттік энергияның өзгерісі мынаған тең болады: dFs = dsS. Бұл өзгеріс осмостық қысымның, затты ерітіндінің көлемінен фазалар шекарасына алып өтуі нәтижесінде жасалған жұмыс нәтижесінде алынған. Егер ерітіндінің көлемі V, ал осмостық қысымның өзгерісі dπ тең болса, онда атқарылған жұмыс:
V dπ = RT dc тең болады.
Демек dsS =─ RT dc/c болады. Г орнына 1| S қою арқылы,
ds/Г =─ RT dc/c аламыз, одан
Г=- dσ| dc ∙ c| RT шығады.
Гиббс теңдеуінен dσ| dc туындысының мәні теріс болғанда, яғни беттік кернеулілік төмендегенде, Г адсорбция оң мәнге ие болатындығы көрінеді. Беттік кернеуліліктің мәні, ерітіндінің концентрациясы артқан сайын төмендейді.
Флотация – дегеніміз заттың талғамды түрде шайылуы болып табылады. Бұл құбылыс негізінен рудаларды байыту кезінде кеңінен қолданылады. Флотация түрлі сұйықтардың, әр түрлі ұнтақтарды талғамды шайу мүмкіндігіне негізделген.
Газ тәрізді заттардың қатты бетке сорбциялану төрт түрлі жағдайда жүруі мүмкін:
1.Біріншіден газтәрізді заттардың қатты затқа сорбциялануы беттік құбылыс адсорбция арқылы жүруі мүмкін. Газдың немесе будың адсорбциялануының бірнеше ерекшеліктері бар: олардың үлкен жылдамдықпен жүруі; қайтымдылығы; температураның көтерілуімен адсорбцияның төмендеуі.
2.Газтәрізді заттардың қатты немесе сұйық заттарға жалпы көлемі бойынша сорылу үрдісі, абсорбция деп аталады.
3.Газдар мен су буын кеуекті материалдар сорбциялаған кезде, капиилярлық конденсация құбылысы байқалады. Бұл жағдайда су буының адсорбциялық қабаты сұйықтыққа конденсацияланады. Егер сұйықтық адсорбенттің бетін жақсы шаятын болса, онда капиллярларда ойыс мениск пайда болады. Содан соң, осы менискінің бетінде қалған бу конденсациялана бастайды да, соның нәтижесінде адсорбенттің барлық кеуектері сұйықпен толады. Капиллярлық конденсация бұл екінші реттік құбылыс. Бұл адсорбциялық күштердің есебінен емес, су буының ойыс мениске тартылу күшінің есебінен жүреді.
4. сорбциялық процестің төртінші түрі хемеосорбция, яғни газдардың қатты адсорбенттермен химиялық әрекеттесуі. Хемеосорбция негізінен жаңа фазаның түзілуімен жүреді. Хемеосорбция негізінен қайтымсыз процесс.
6 – тақырып
1) Беттік кернеулілік, оның мәні
Фазалар шекарасының 1см2 бетін түзу үшін жасалатын жұмыс немесе соған эквивалентті болған 1см2 бетік бос энергия бетттік кернеулілік деп аталады. Ол σ таңбасымен белгіленіп, эрг/см-2 шамасымен өлшенеді.
Беттік кернеулілілікті анықтаудың бірнеше әдістері бар:
- көпіршіктердің пайда болуының ең үлкен қысымы әдісі (Ребиндер приборы);
- тамшыларды есептеу әдісі (сталагмометр);
- сұйықты капиллярлық көтеру әдісі.
6 – тақырып
1) Жұғу құбылысы, жұғу шамасы
Жұғу – сұйықтықтың қатты денемен немесе басқа сұйықтықпен жанасуы кезінде пайда болатын құбылыс.
Жұғу құбылысы, көбінесе, үш фазаның жанасу аймағындағы молекулааралық өзара әсерлесу нәтижесі деп қарастырылады. Жұғу құбылысының өндірісте де, күнделікті өмірде де айтарлықтай маңызы бар. Сабындардың және синтетикалық ұнтақтардың жуғыштық касиеті де осы жұғу құбылысына негізделген. Ағаш, былғары, резеңке және т.б. материалдарды желімдеу жұғу құбылысын қолданудың мысалы бола алады. Суда жүзетін кұстардың (аққу, қаз, үйрек, т.б.) терілері мен қауырсындарына су жұқпайтын зат сіңген, сондықтан да ол құстарға су жұқпайды, ал басқа үй хайуанаттары туралы біз олай деп айта алмаймыз.
Жұғудың периметрі үш орта: 1) ауа, 2) сұйық, 3) қатты дене әсерлерінің шекарасы болатындығы анық. Бұл орталар оларды шекаралайтын беттерге ие: 1–2 беттік кернеулікке ие сұйық-ауа беті; 1–3 беттік кернеулікке ие ауа-қатты дене беті; 2–3 беттік кернеулікке ие сұйық-қатты дене беті.
а)
Г қ с к.с.
|
б)
қ с к.с.
|
а - жұғу бұрышы 900 кем болған, б – жұғу бұрышы 900 артық болған жағдай;
Осыған сәйкес жұғу периметрінің 1 см-не 1-суретте сәйкес векторлар-мен белгіленген үш күш әсер етеді: 1–2; 1–3; 2–3. Олар сәйкес шекараланатын бетке жанамалы орналасқан дөңгелектің жеке элементтеріне перпендикуляр бағытталған. тепе-теңдік шеттік бұрышын түзгенде барлық күштер бірін-бірі теңестіруі қажет. Бұл жағдай үшін қатты дене беті жазықтығы осіне векторлар проекциясы қосындысынан шығатын Дюпре-Юнг қатынасы дұрыс болады:
2–3
= 1–3
+ 1–2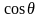 немесе 2–3
– 1–3
= 1–2
,
немесе 2–3
– 1–3
= 1–2
,
бұдан = (2–3 – 1–3) / 1–2 = В.
Мұндағы шамасы В жұғу деп аталады. Жұғу жағдайы өзгергенде бұл бұрыш өзгереді. Толық жұғуға ( = 0) В=1 жауап беретіні анық. Сұйық қатты денеге олардың молекулаларының арасындағы әсер аз болған сайын жақсы жұғады. Аз беттік кернеулікке ие болған полярсыз сұйықтар, негізінде беттерге жақсы жұғады. Бұл жағдайда алынған екі сұйықтықтан дененің бетіне, қайсысының қатты денемен полярлық айырмашылығы аз болса сол жақсы жұғады.
6 – тақырып
1) Адсорбция, оның мәні
Адсорбцияланушы зат адсорбтив, ал адсорбциялағыш зат адсорбент деп аталады.
Адсорбция – бұл беттік бос энергияны төмендету арқылы өздігінен жүретін процесс. Белгілі концентрациядағы ерітіндінің беттік кернеулілігін біле отырып, фазалар шекарасындағы адсорбцияны есептеуге болады. Беттік кернеуліліктің төмендеуімен жүретін адсорбция үрдісінің теңдеуін Гиббс енгізген:
Г=- dσ| dc ∙ c| RT
Гиббс теңдеуін төмендегідей жолмен шығаруға болады. Белгілі С (моль/л) конйентрациядағы және σ (эрг/см2) беттік екрнеуліліктегі ерітіндіні алайық. Ерітіндінің өзінің буымен фазалар шекарасы S меншікті беттік ауданға және 1моль еріген затқа ие болсын. Онда:
Г= 1| S моль/ см2
болады.
7 – тақырып
1) Қатты және сұйық шекарасындағы адсорбция, оны реттеу жолдары
Заттардың фазалар шекарасында концентрациялануы адсорбция деп аталады.
Адсорбцияланушы зат адсорбтив, ал адсорбциялағыш зат адсорбент деп аталады.
Адсорбция – бұл беттік бос энергияны төмендету арқылы өздігінен жүретін процесс. Белгілі концентрациядағы ерітіндінің беттік кернеулілігін біле отырып, фазалар шекарасындағы адсорбцияны есептеуге болады. Беттік кернеуліліктің төмендеуімен жүретін адсорбция үрдісінің теңдеуін Гиббс енгізген:
Г=- dσ| dc ∙ c| RT
Гиббс теңдеуін төмендегідей жолмен шығаруға болады. Белгілі С (моль/л) конйентрациядағы және σ (эрг/см2) беттік екрнеуліліктегі ерітіндіні алайық. Ерітіндінің өзінің буымен фазалар шекарасы S меншікті беттік ауданға және 1моль еріген затқа ие болсын. Онда:
Г= 1| S моль/ см2
болады.
Егер фазалар шекарасына заттың өте аз мөлшерін өткізсек, онда беттік кернеулілік dσ мәніне өзгереді. Сонда беттік энергияның өзгерісі мынаған тең болады: dFs = dsS. Бұл өзгеріс осмостық қысымның, затты ерітіндінің көлемінен фазалар шекарасына алып өтуі нәтижесінде жасалған жұмыс нәтижесінде алынған. Егер ерітіндінің көлемі V, ал осмостық қысымның өзгерісі dπ тең болса, онда атқарылған жұмыс:
V dπ = RT dc тең болады.
Демек dsS =─ RT dc/c болады. Г орнына 1| S қою арқылы,
ds/Г =─ RT dc/c аламыз, одан
Г=- dσ| dc ∙ c| RT шығады.
Гиббс теңдеуінен dσ| dc туындысының мәні теріс болғанда, яғни беттік кернеулілік төмендегенде, Г адсорбция оң мәнге ие болатындығы көрінеді. Беттік кернеуліліктің мәні, ерітіндінің концентрациясы артқан сайын төмендейді.
7 – тақырып
1) Гидрофильді және гидрофодты заттар
Гидрофильдік (орысша гидрофильность, от гидро ... и Үлгі:Lang-grc рһіlіа - любовь, жақтыру), заттың (материалдың) сулану, ылғалдану қабілеті. Ондай заттарға мысалы, саз, силикаттар, т.б. жатады. Жайпақ офсет басу формасындағы ашық (пробелді) элементтері негізгі металл бетіне орналасқан адсорбцияланған гидрофильді қабатта болады. Форманың ол жерлері басу бояуын қабылдамайды
Гидрофобтық— заттың (материалдың) суға шыланбайтын қасиеті. Бұлардың қатарына көптеген металдар, майлар, балауыздар, кейбір полимерлер жатады. Мұндай қасиеті бар материалдармен көптеген заттардың (металл, маталар, қайыстар, ағаштар және т.б.) бетін қаптау арқылы ылғалды атмосфера әсерінен сақтайды.
7 – тақырып
1) Фазалар шекарасындағы беттік бос энергия, оны төмендету әдістері.
Фазалар шекарасы ауданының бірлігіне сайкес келетін артықша бос энегия беттік бос энергия деп аталады. Температураны көтеру, ББЗ қрсу арқылы.
ББЗ д:з- екі жакты қасиетт корсететін заттар. Негізінен құрамында –ОН, -СНО
7 – тақырып
1) Беттік белсенді заттар
Беттік белсенді заттарға көмірсутекті тізбегінде полярлы атом топтары бар заттар жатады. Беттік белсенді заттардың молекулалары, суда еріген кезде фазалар шекарасына шығуға ұмтылады және фазалар шекарасында полярлы атом топтарымен суға қарай, ал полюссіз көмірсутекті тізбегімен ауаға қарай орналасады. Бұл беттік белсенді заттардың екі жақты қасиеті болуына байланысты: біріншіден полярлы атом топтарының молекула аралық әсерлеуі жоғары болған суға туыстығы болуына, ал полярсыз атом топтарын судың молекулалары ығыстырып шығуына байланысты болады. Сондықтан беттік белсенді заттар, фазалар шекарасына ұмтылады, себебі онда әрбір атом топтары өзінің табиғатына сәйкес орналасуға мүмкіндік алады. Сондықтан беттік белсенді заттардың молекулаларын дифильді молекулалар деп атайды.
8 – тақырып
1) Дисперсті жүйелер, олардың ерекшеліктері
Дисперсті жүйелер-газ сұйық не қатты ортада біркелкі таралған ұсақ бөлжектерден тұратын жұйе
Дисперсті фаза- ұнтақталған ұсақ бөлшектер
Дисперсті орта- Дисперсті фаза бөлшектерін біркелкі таратушы газ сұйық немесе қатты зат
Колойдты жүйелер - Дисперсті фаза бөлшектерінің ұнтақталу дәрежесі жоғары гетерогенді жүйелер.
Колойдты лиофобты ерітінді (золь) – кем дегенде 3компоненттер тұратын ультрамикрагетерегенді жүйелер.
Ерекшеліктері фазалар шекарасындағы бет ауданының жоғарылылығымен сипатталады. Термодинамикалық тұрғыдан тұраксыз болады жане бұл жүйелер фазалар шекарасының ауданын төмендету арқылы термодинамикалық тұрактылыққа ұмтылады. Ьос энегиясы коп.
8 – тақырып
1) Дисперсті фазаның дисперсиялық дәрежесі, оның дисперсті жүйенің қасиеттеріне әсері
дисперсиялық дәрежесі- Дисперсті фаза бөлшектерінің өлшеміне қарама-қарсы шама.
Дисперстік дәреже ұнтақтылықты сипаттайды. Д:д үлкен болган сайын ұнтак майда болады.
Нағыз д ж 1 мл микроннан 10-9 дан 10-7
Колоидтты д ж 0,1 мл микрон 10-7 10-5
Ірі д ж 110-5 10-3
Дисперсті орта, дисперсті фаза құрамы бірдей екі дисперсті жүйе алынды делік. Бұл екі жүйенің айырмашылығы бірінші жүйедегі дисперсті фазада кездесетін бөлшектер біркелкі де, екінші дисперсті фазадағы бөлшектер бірдей болса да өлшемдерінің әр түрлілігінде. Бұл – бөлшектер айырмашылығын диаметр, ұзындық, биіктік сияқты өлшемдермен шектеп көрсетуге арналған мысал. Ал іс жүзінде коллоидты жүйедегі дисперсті фаза бөлшектердің өлшемі әр түрлі болады. Мұндай жүйелерді салыстыру үшін меншікті (үлесті) бет (беткі қабат ауданы) арқылы сипатталатын, Оствальд ұсынған дисперстік дәреже қолданылады.
8 – тақырып
1) Дисперсті жүйелердің жіктелуі
Дисперстік жүйелерді олардың құрамындағы дисперстік фаза мен дисперстік ортаның агрегаттық күйлеріне байланысты жіктелуі.
Дисперстік жүйелердің бөлшектерінің өлшеміне қарай жіктелуі.
Коллоидтық ерітінделерде коллоидтық бөлшектер өзара әрекеттесуі бойынша жіктелуі.
Жисперстік жүйелердің термодинамикалық тұрақтылығына қарай жіктелуі.
1. Дисперстік фаза және дисперстік ортаның агрегаттық күйіне байланысты жіктелуі. Во. Оствальд ұсынған классификация. Коллоидты химияда қарастырылатын жүйелер гетерогенді, сондықтан кем дегенде екі фазадан тұрады. 3 агрегаттық күйден, 9 типті дисперстік жүйе шығады (1-кесте). Мысалы, С/Г. С – дисперстік фазаның агрегаттық күйі, Г – дисперстік ортаның агрегаттық күйі.
Үш агрегаттық күйге сәйкес дисперстік жүйенің түрлері
Зидентопф және Зигмонди бөлшектерді:
микрондар – кәдімгі микроскоптан көрінетін бөлшектер, яғни, өлшемі >0,2 мкм
ультрамикрондар – микроскоптан көрінбейтін коллоидты бөлшектер. Оларды әрі қарай
а) субмикрондар, яғни ультрамикроскоп көмегімен көрінетін өлшемі 5 нм-ден 200 нм-ге дейінгі бөлшектер;
б)амикрондар, яғни ультрамикроскоп көмегімен де көрінбейтін өлшемі <5 нм бөлшектер.
Г/Г типі коллоидтық жүйеге сәйкес келмейді, себебі кәдімгі жағдайларда газдар кез-келген концентрацияда шынайы ерітінділер береді (тек өте жоғары қысымда ғана кейбір газ жүйелері гетерогенді жүйе түзеді).
Дисперстік жүйелерді олардың құрамындағы дисперстік фаза бөлшектерінің өлшеміне байланысты жіктеуге болады. Сонда бөлшектерінің өлшеміне қарай барлық дисперстік жүйелерді мынандай топтарға бөлуге болады.
Байланысқан дисперстік жүйелерде дисперстік фаза бөлшектері молекулааралық күштер әсерінен бір-бірімен байланысып, дисперстік ортада өзінше бір кеңістіктік тор немесе каркас түзеді. Ал құрылым түзетін бөлшектер, әдетте, өзара еркін қозғала алмайды, тек тербелістік қозғалыс жасай алады. Байланысқан дисперстік жүйелерге белгілі дәрежеде қатты денелердің қасиеттері тән болғанымен, оларды дисперсті ортасы қатты болатын жүйелермен шатастыруға болмайды. Дисперсиялық ортасы қатты жүйелер бөлшектері де өзара қозғала алмайды, бірақ оның себебі басқада – ол дисперсиялық ортаның жоғары тұтқырлығы.
М. М. Дубинин байланысқан дисперстік жүйелерді, нақтырақ айтсақ, кеуекті денелерді былай жіктеді;
микрокеуекті, кеуек өлшемі < 2 нм;
ауыспалыкеуекті, кеуек өлшемі 2 - 200 нм аралығында;
макро кеуекті, кеуек өлшемі >200 нм.
Мұндай жүйелерге, көбінесе, диафрагмалар немесе капиллярлы жүйелер деп аталатын капиллярлы – кеуекті денелер; мембраналар – жұқа қабықшалар, әдетте, полимерлі, сұйық және газ өткізгіштер; гельдер және ұйымалар (студни); концентрлі суспензиялар (пасталар) мен эмульсиялар, көбіктер.
Tермодинамикалық тұрақтылығына қарай дисперстік жүйелерді үлкен 2 топқа бөледі: лиофильді және лиофобты жүйелер.
Лиофильді жүйелер (грек. лиос – сұйықтық; phileo – жақсы көремін; phobos –жеккөремін)-термодинамикалық тұрақты жүйелер. Олар өз еркімен түзіледі, түзілу барысында жүйенің еркін(Гиббс) энергиясы азаяды, яғни ∆G=∆+T∆S<0. Мұндай жүйелерге беттік-активті заттардың мицеллярлық ерітніділері, жоғары молекулалық қосылыстардың ерітінділері және бентонит сазбалшықтарының суспензиясы жатады. Оларға агрегаттық тұрақтылық тән.
Лиофобтық жүйелерге термодинамикалық тұрақсыз, ұзақ өмір сүре алмайтын дисперстік жүйелер жатады. Мұндай жүйелерге эмульсиялар, кейбір суспензиялар, көбіктер жатады. Лиофобтық жүйелерді тұрақтандыру үшін оларға тұрақтандырғыш заттар-беттік-активті заттар (БАЗ), полимерлер қосады. Бұл жағдайда коллоидты ертінділердің дисперстік фазаның дисперстік ортамен өзара әрекеттесуі байқалады.
Диспесті жүйелердің жіктелуі.
Дисперсті жүйелерді түрлі сипаттамаларына сәйкес жіктеуге болады. Қазіргі кезде дисперсті ортаның агрегаттық күйіне байланысты жіктеу кеңінен қолданылады.
Газтәрізді диперсті ортаға ие жүйелер: Қ/Г; С/Г; Г/Г.
Сұйық диперсті ортаға ие жүйелер: Қ/С; Г/С; С/С.
Қатты диперсті ортаға ие жүйелер: С/Қ; Г/Қ; Қ/Қ.
8 – тақырып
Коллойдты күйдің негізгі ерекшеліктері
Коллойдты күйдің негізгі ерекшелігі – екі немесе бірнеше фазалардан тұратын дисперсті жүйеледің гетерогенділігі болып есептеледі. Жүйенің гетерогендігінің негізгі екі ерекшелігі болады: жүйе иеленетін кеңістіктің түрлі аймақтарындағы қасиеттерінің әр түрлі болуы және осы аймақтар арасындағы нақты беттік айырмашылықтың болуы.
Коллоидтар (грек. kolla – желім және eіdos – түр) – бөлшектерінің мөлшері 10–7 – 10–5 см болатын жоғары дисперстік (микрогетерогендік) жүйелер. Коллоидтарға (Коллоидтар жүйесіне), бөлшектері ірірек дисперстік жүйелерге қарағанда, дисперстік фаза бөлшектерінің броундық қарқынды қозғалыстары тән.
Коллоид күйінің ерекшелігі.
1. Барлық коллоидты ерітінділердің сәуле шашырату қабілеті болады (мұны опалесценциялау дейді). Бұл құбылысты тәжірибе жүзінде жасап көруге болады. Ол үшін сәуле жолына линза қойып, одан шыққан сәулені коллоидты ерітінді арқылы жіберсе, одан опалесценцияны көруге болады. Мұны Тиндаль конусы дейді.
2. Нағыз ерітінділермен салыстырғанда коллоидты ерітінділердегі диффузия жылдамдығы төмен.
3. Коллоидты ерітінділердің осмостық қысымы аз, кейде оларды байқау да қиын. Демек, коллоидты ерітінділердегі диффузия жылдамдығы мен осмостық қысымының төмен болуы ондағы еріген зат бөлшегінің нағыз ерітіндімен салыстырғанда ірі екендігін көрсетеді. Расында да коллоидты ерітіндідегі бөлшек ірі болған сайын оның диффузия кезіндегі қозғалысы қиындап, жылдамдығы төмендейді, өйткені бөлшек іріленген сайын кедергі де арта түседі. Сондай-ақ ондағы бөлшек өлшемі осмостық қысымға әсер етеді. Берілген бірдей көлем мен тығыздықтағы екі ерітіндінің қайсысында бөлшек ірілеу болса, сонда бөлшек саны аз болады. Ал осмостық қысым концентрацияға, яғни бөлшек санына тікелей тәуелді. 4. Коллоидты ерітінділер диализге бейім, яғни онымен ерітіндіде бірге еріген төменгі молекулалы заттарды жартылай өткізетін жарғақты пленкалар көмегімен тазартуға болады. Мұндайда төменгі молекулалы заттар (нағыз ерітінділер) жарғақ арқылы өтеді де, коллоидты ерітінділер қалып қояды. 5. Нағыз ерітінділер өте тұрақты, ал коллоидты ерітінділер тұрақсыз. Олай болса, коллоидты бөлшектер болмашы ғана сыртқы әсер салдарынан коагуляцияланады. 6. Коллоидты ерітінділер, әдетте, электрофорез құбылысына бейім. Бұл құбылыс электр өрісіндегі коллоидты бөлшекті оң, не теріс электродқа тасымалдаумен сипатталады.
8 – тақырып
Коллойдты жүйелердің тұрақтылығы, оны арттырудың теориялық негіздері
Коллойдты жүйелердің тұрақсыздық дәрежесі, олардың бөлшектерінің арсында әсерлесуші күштердің қатнасымен анықталады. Коллойдты бөлшектердің бір түрлі зарядқа ие болуы, оларды агрегациялауға тырысатын тарту күштері әсер ететін қашықтыққа дейін бөлшектердің жақындауына кедергі жасайды. Сонымен бірге коллойдты бөлщектердің айнаасында сольватты қабаттың болуы да, ол бөлшектердің бір-біріне жақындауына кедергі жасайды. Яғни коллойдты бөлшектердің бір-бірімен агрегациялануы басталғанға дейін, бұл жүйелер кинетикалық тұрақты күйде болады, ал бөлшектер жылулық қозғалыс арқлы, тұнбайды.
Сондықтан коллойдты жүйелер, термодинамикалық жағынан тұрақсыз болуына қарамастан, кинетикалық тұрақты болып табылады. Ал бөлшектердің іріленуі кинетикалық тұрақтылығын жоғалдуына алып келеді. Бұл коллойдты жүйенің бұзылып, ірі диспесті жүйеге айналуына алып келеді.
Коллойдты жүйелерді бұзылудан сақтау қажет, егер жүйеге беттік белсенді заттарды ендірсек, олар бөлшектерге адсорбциялану арқылы, олардың беттік бос энергиясын төмендетіп, оларды бір-біріне жабысудан сақтайды.

 с.г.
с.г. с.г.
с.г.