
лабы ИХМА / Определение цинка в природной воде атомно-абсорбционным методом
.pdf
Лабораторная работа по атомно-абсорбционной спектроскопии «Определение цинка в природной воде»
Цель работы: Определить содержание ионов цинка в природной воде методом атомной абсорбции и оценить случайную составляющую погрешности результата определения.
Теоретическая часть
Атомно-абсорбционный метод основан на резонансном поглощении характеристического излучения элемента его невозбужденными атомами, находящимися в свободном состоянии, т. е. в состоянии атомного «пара».
В результате поглощения кванта света валентный электрон атома возбуждается и переходит на ближайший разрешенный энергетический уровень, а резонансное излучение, проходящее через плазму, ослабляется. Ослабление резонансного излучения элемента, падающего на плазму с интенсивностью Io, до интенсивности I для выходящего светового потока происходит по экспоненциальному закону, который идентичен закону Бугера - Ламберта - Бера:
I = I0 e−Klc
где К-коэффициент поглощения, рассчитанный на моль элемента для центра линии поглощения; l - поглощающего слоя плазмы: с - концентрация поглощающих атомов. После логарифмирования этого выражения и перехода от натуральных к десятичным логарифмам получают зависимость:
= lg 0 =
где А - абсорбция поглощающего слоя плазмы; k - атомный коэффициент абсорбции.
При постоянной толщине поглощающего слоя градуировочный график, построенный в координатах А-с, представляет собой прямую, проходящую через нулевую точку. Так как подавляющее большинство свободных атомов находится в основном состоянии, то значения атомных коэффициентов абсорбции для элементов очень высоки и достигают n*108, что примерно на три порядка выше молярных коэффициентов поглощения светового излучения, полученных для растворов (ε=n*105). Это в известной степени обусловливает низкие абсолютные и относительные пределы обнаружения элементов атомно-абсорбционным методом: первые составляют 10-12-10-14 г., вторые 10-5- 10-8%. Для атомизации вещества в атомно-абсорбционной спектрофотометрии используют пламена различных типов и электротермические атомизаторы. Последние основаны на получении поглощающего слоя свободных атомов элемента путем импульсного термического испарения вещества: кювета Львова, графитовый трубчатый атомизатор, лазерный испаритель и др. Пламенная атомизация. вещества получила большее распространение в аналитической практике, так как она обеспечивает достаточно низкие пределы обнаружения элементов (10-6-10-7%) и хорошую воспроизводимость результатов анализа (1-2%) при достаточно высокой скорости определений и небольшой трудоемкости. Для наиболее доступных низкотемпературных пламен число элементов, определяемых методом атомно-абсорбционной спектрофотометрии, значительно больше, чем методом фотометрии пламени, так как роль плазмы ограничена только атомизацией вводимых в
нее веществ.
Спектр атомного поглощения элемента проще эмиссионного, так как состоит только из спектральных линий резонансной серии. В то же время среди линий резонансной серии имеются такие, которые в спектре эмиссии отсутствуют вследствие высоких потенциалов их возбуждения. Последние спектральные линии некоторых элементов (Со, Сr) смещены в спектре абсорбции в более коротковолновую область по сравнению с наиболее яркой эмиссионной спектральной линией.
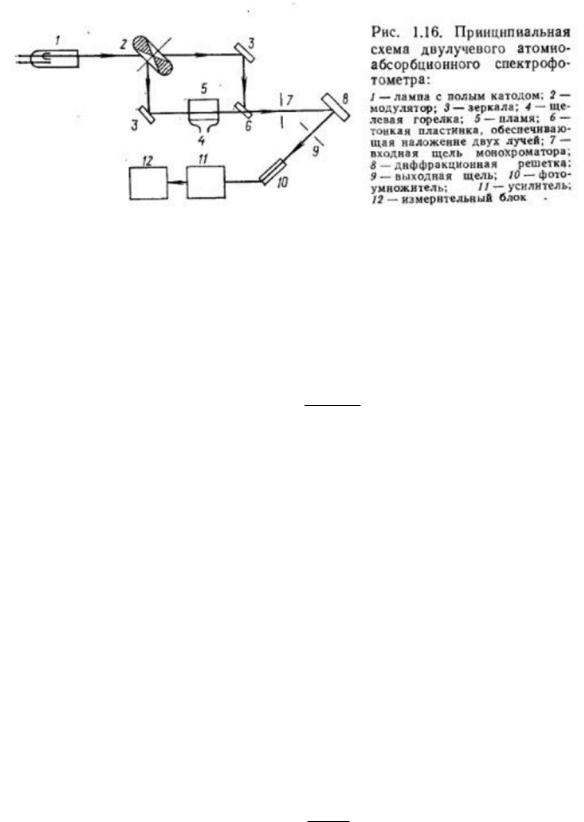
Определение элементов в атомно-абсорбционном методе заключается в измерении относительной интенсивности двух световых потоков. Один из них проходит через плазму
свведенным в нее анализируемым веществом, другой является контрольным. Окончательный аналитический сигнал может быть получен двумя способами. Последовательное во времени измерение интенсивности одного светового потока, прошедшего через поглощающий слой без анализируемого вещества и затем измерение интенсивности светового потока, прошедшего через пламя с анализируемым веществом, проводят, используя однолучевые приборы. Применение однолучевых приборов возможно только при высокой стабильности атомизатора и источника монохроматического излучения. Одновременное измерение интенсивности двух световых потоков, один из которых проходит через пламя с анализируемым веществом, а другой нет, проводят с двулучевыми атомно-абсорбционными спектрофотометрами.
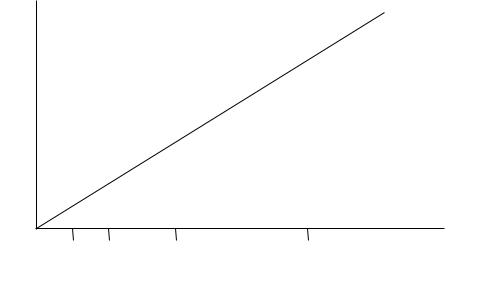
Определение ионов цинка в природной воде проводят методом атомной абсорбции
сиспользованием градуировочной функции (метод градуировочного графика). Вид градуировочного графика представлен на рис.1. Он линеен в диапазоне концентраций цинка от 0 до 10 мкг/мл.
A
|
|
|
|
с, мкг/мл |
|
1 |
2 |
4 |
8 |
||
|
|||||
|
|
|
|
|
В соответствии с санитарными нормами в питьевой воде должно содержаться цинка не более 5 мг/л.
Реагенты и аппаратура
Анализируемый раствор – природная вода
Стандартный раствор хлорида цинка, содержащий 100 мкг/мл цинка
Пламенный атомно-абсорбционный спектрометр
Лампа с полым катодом для определения цинка
Методика выполнения работы
Выполнение определения. В 4 мерные колбы вместимостью 100 мл (V(колбы)) пипеткой переносят: 1,00; 2,00; 4,00; 8,00 мл стандартного раствора хлорида цинка (Vi,ст)с концентрацией (cст)100 мкг/мл цинка. Разбавляют содержимое колб до метки дистиллированной водой и тщательно перемешивают. Рассчитывают концентрации полученных растворов градуировочного ряда (ci,ст, мкг/мл) с учетом разбавления по формуле:
c |
|
c |
V |
|
ст |
i,ст |
|||
|
|
|||
i,ст |
|
V |
||
|
|
|||
|
|
|
колбы |
|
и результаты заносят в таблицу 1.
Включают прибор, устанавливают лампу с полым катодом для определения цинка и необходимые для работы параметры: ток питания лампы, напряжение фотоумножителя, коэффициент усиления фототока, длину волны резонансной линии цинка.
Промывают горелку и распылительную систему дистиллированной водой. Все растворы градуировочного ряда фотометрируют последовательно в порядке увеличения концентрации цинка. Измеренные величины атомного поглощения (Ai,ст) заносят в табл.1. По результатам табл.1 строят на миллилиметровой бумаге градуировочный график.
После фотометрирования серии стандартных растворов горелку и распылительную систему промывают дистиллированной водой и фотометрируют анализируемый раствор (природную воду) не менее 5 раз. Результаты измерений атомного поглощения анализируемой воды (Ai) заносят в таблицу 2.
Используя данные таблицы 1, рассчитывают коэффициенты градуировочной зависимости (А = а + bс) методом наименьших квадратов (см. файл «математическая обработка»).
Зная значения атомного поглощения для каждого из повторных опытов фотометрирования анализируемой воды, рассчитывают концентрацию (сi, мкг/мл), используя уравнение градуировочной зависимости по формуле:
ci A a b
Рассчитанные результаты вносят в таблицу 2.
Результаты определения цинка обрабатывают статистически, рассчитывают доверительный интервал, в котором находится значение измеряемых концентраций (см. файл «математическая обработка»). Результаты математической обработки результатов определения и результаты расчета представляют в виде таблицы 3.
Практическая часть
Вариант 1:
Таблица экспериментальных значений для расчета уравнения градуировочной зависимости
Vi, ст , мл |
1 |
2 |
4 |
8 |
Аi,ст |
0,025 |
0,048 |
0,11 |
0,20 |
Таблица экспериментальных значений для расчета доверительного интервала
n |
Ai |
1 |
0,15 |
2 |
0,16 |
3 |
0,15 |
4 |
0,14 |
5 |
0,16 |
Таблица 1. Данные для построения градуировочного графика (Вариант 1)
Vi, ст, мл |
1 |
2 |
4 |
8 |
сi,ст,мкг/мл |
1 |
2 |
4 |
8 |
Аi,ст |
0,025 |
0,048 |
0,11 |
0,20 |
с |
|
|
|
|
= |
100 1 |
= 1 |
= |
. |
|
|||||
1 , |
|
|
колбы |
|
100 |
|
|
|
|
|
|
|
|||
с |
= |
|
|
= |
100 2 |
= 2 |
|
|
|
. |
|
||||
2 , |
|
|
колбы |
|
100 |
|
|
|
|
|
|
|
|||
с |
= |
|
|
= |
100 4 |
= 4 |
|
|
|
. |
|
||||
3 , |
|
|
колбы |
|
100 |
|
|
|
|
|
|
|
|||
с |
= |
|
|
= |
100 8 |
= 8 |
|
|
|
. |
|
||||
4 , |
|
|
колбы |
|
100 |
|
|
|
|
|
|
|
|||
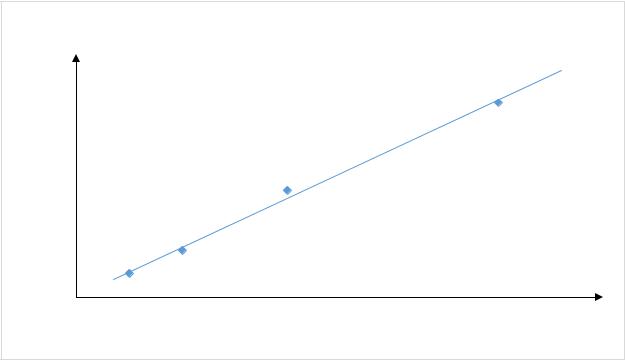
ГРАДУИРОВОЧНЫЙ ГРАФИК
0.25
А
0.2
0.2
0.15
0.11
0.1
0.048
0.05
0.025
0
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
1 0 |
С, МКГ/МЛ
Расчет коэффициентов линейной функции А = а + bс
№ точки |
|
|
|
|
|
|
Сi |
|
|
|
|
|
|
|
|
Аi |
|
|
|
|
С2 |
|
|
АiСi |
||||||
1 |
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
0,025 |
|
|
|
|
1 |
|
|
|
|
0,025 |
|||||
2 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
0,048 |
|
|
|
|
4 |
|
|
|
|
0,096 |
|||||
3 |
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
0,11 |
|
|
|
|
16 |
|
|
|
|
0,44 |
|||||
4 |
|
|
|
|
|
|
8 |
|
|
|
|
|
|
|
0,20 |
|
|
|
|
64 |
|
|
|
|
1,6 |
|||||
4 |
|
|
|
|
|
|
15 |
|
|
|
|
|
|
0,383 |
|
|
|
|
85 |
|
|
|
|
2,161 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
∑ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
∑n |
с2 ∑n |
А − |
∑n |
|
|
с |
∑n |
А С |
85 0,383 − 15 2,161 |
||||||||||||||||||||
а = |
|
i=1 |
|
i |
|
i=1 |
|
i |
|
i=1 |
|
i |
i=1 i |
i |
= |
|
|
|
|
|
|
|
|
= 0,001217 |
||||||
|
|
|
n |
∑n |
с2 |
− (∑n |
|
с )2 |
|
|
|
4 85 − (15)2 |
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
i=1 |
|
i |
|
|
i=1 |
|
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
n ∑n |
|
С А - |
∑n |
|
С |
∑n |
А |
|
4 2,161 − 15 0,383 |
|
|
|
||||||||||||
|
|
|
b= |
|
i=1 |
i |
i |
|
|
i=1 i |
i=1 |
|
i |
= |
|
|
|
|
|
|
|
=0,02521 |
||||||||
|
|
|
|
n |
∑n |
|
С2 |
-( ∑n |
С )2 |
|
|
|
|
4 85 − (15)2 |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
i=1 |
i |
|
|
|
|
i=1 |
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
А=0,001217+0,02521*с |
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
С |
|
|
|
|
1 |
|
|
2 |
|
4 |
8 |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
А |
|
|
0,02643 |
|
0,05164 |
0,1021 |
0,2029 |
|
|
|
|
|
|||||||||
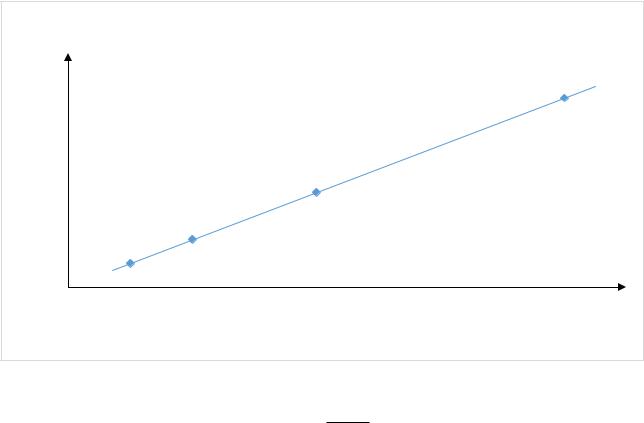
|
|
ГРАДУИРОВОЧНАЯ ЗАВИСИМОСТЬ |
|
|
|||||||
0.25 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0.2029 |
|
0.2 |
|
|
|
|
|
|
|
|
|
|
|
0.15 |
|
|
|
|
|
|
|
|
|
|
|
А |
|
|
|
0.1021 |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|||
0.1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
0.05164 |
|
|
|
|
|
|
|
|
|
0.05 |
0.02643 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
0 |
|
|
|
|
|
|
|
|
|
|
|
0 |
1 |
2 |
3 |
|
4 |
|
5 |
6 |
7 |
8 |
9 |
|
|
|
С, МКГ/МЛ |
|
|
|
|
||||
|
|
|
c |
|
|
A a |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
i |
|
b |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 2. Данные фотометрирования анализируемой природной воды |
|
||||||||||
|
|
|
|
|
(Вариант 1) |
|
|
|
|
||
n |
Ai |
ci, мкг/мл |
1 |
0,15 |
5,90 |
2 |
0,16 |
6,29 |
3 |
0,15 |
5,90 |
4 |
0.14 |
5,50 |
5 |
0,16 |
6,29 |
Экспериментальные значения для расчета доверительного интервала
№ |
Ai, мм |
|
|
Ci |
(Сi – |
|
) |
(Ci – |
|
)2 |
|
|
с |
с |
|||||||
1 |
0,15 |
5,90 |
-0,076 |
0,006 |
||||||
2 |
0,16 |
6,29 |
0,314 |
|
0,099 |
|||||
3 |
0,15 |
5,90 |
-0,076 |
0,006 |
||||||
4 |
0,14 |
5,50 |
-0,476 |
0,227 |
||||||
5 |
0,16 |
6,29 |
0,314 |
|
0,099 |
|||||
1 |
|
|
|
|
|
|
|
|
|
|
∑ |
|
|
|
=5,976 |
|
|
|
0,437 |
||
|
|
с |
|
|
|
|||||
5 |
|
|
|
|
|
|
|
|
|
|

|
∑i=5(с − |
|
)2 |
|
0,437 |
|
|
|
с |
|
|
||||
s2( ) = |
i=1 |
= |
|
= 0,10925 |
|||
n − 1 |
4 |
||||||
|
|
|
|||||
∑i=5(c − c)2
s(x) = √ i=1 = √s2 = √0,10925 = 0,33 n − 1
|
s (x) = |
s(x) |
|
= |
0,33 |
= 0,055 |
|||||||||
|
|
|
|
|
|||||||||||
|
r |
|
|
|
|
c |
5,967 |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|||||||
±C(x) = |
t (P, v) |
× s(x) |
= |
2,78 × |
0,33 |
= 0,41 |
|||||||||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
√n |
|
|
√5 |
||||||||||
Доверительный интервал |
c C(x) : |
5,976 0,41 5,976 + 0,41
5,566 6,386
n
5
ci
, мкг/мл
5,976
Таблица 3. Результаты определения
s |
2 |
(x) |
s(x) |
, |
s |
r |
(x) |
|
|
|
|
||||
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
мкг/мл |
|
|
|
|
0,10925 |
0,33 |
|
0,055 |
||||
|
|
|
|
|
|
|
|
x C(x) , M
5,566 6,386
Вывод: в ходе эксперимента была определена концентрация ионов цинка в природной воде методом атомной абсорбции c=5,976 мкг/мл с доверительным интервалом
5,566 6,386.
