
- •Робоча програма розділу
- •Особливості каталітичних реакцій
- •Опорний конспект Каталіз. Основні поняття. Автокаталіз. Гомогенний каталіз
- •Особливості каталітичних реакцій:
- •Теорія проміжних сполук
- •Поверхневі явища та адсорбція. Рівняння Фрейдлиха та Ленгмюра
- •Завдання для срс №25. Теорія проміжних сполук. Іонообмінна адсорбція.
- •Лабораторна робота №18
- •Хід роботи
- •Лабораторна робота №19
- •Хід роботи
- •Лабораторна робота №20
- •Хід роботи
- •Лабораторна робота №21
- •Хід роботи
- •Лабораторна робота №22
- •Хід роботи
- •Завдання для срс №26. Теорії гетерогенного каталізу.
Опорний конспект Каталіз. Основні поняття. Автокаталіз. Гомогенний каталіз
Каталіз – явище зміни швидкості реакції під впливом введення в реакційну суміш речовин – каталізаторів

 Позитивний
Негативний
Позитивний
Негативний
(інгібітори)
________
 КАТАЛІЗ
КАТАЛІЗ
Гомогенний Гетерогенний
Особливості каталітичних реакцій:
каталізатор – в незмінному вигляді
кількість каталізатора мала
впливає на пряму та зворотну реакції
специфічність (ферменти)
не змінює величини теплового ефекту
сторонні речовини: нейтральні
корисні (активатори – промотори)
шкідливі (каталітичні отрути)
Гомогенний каталіз – одна фаза
Автокаталіз – прискорення реакції продуктами

Теорія проміжних сполук
 І.
А + К = АК
протікає
швидко
І.
А + К = АК
протікає
швидко
ІІ. АК + В = С + К____________________________
Сумарна реакція:
А + В = С (протікає швидко)
Знижує Еакт!
Поверхневі явища та адсорбція. Рівняння Фрейдлиха та Ленгмюра
Вільна поверхнева енергія!
Загальна поверхня – S (м2)
Питома поверхня - S0 (м-1) S0 = S/V
 Ад
Ад

 Аб
СОРБЦІЯ
Аб
СОРБЦІЯ
Хемо
АДСОРБЦІЯ – зміна С у поверхні розділу фаз:
Р – Г, Р І – Р ІІ, Т – Г, Т – Р
адсорбент____________
абсорбція
Хемосорбція – поверхневі сполуки
АДСОРБЦІЯ ДЕСОРБЦІЯ
вибірковий характер
екзотермічна при t0 характеристика
Еакт

 хімічна
(Ленгмюр, Гуревич)
хімічна
(Ленгмюр, Гуревич)
ТЕОРІЇ фізико – хімічна природа
фізична (Поляні)
Г – Р, Р І – Р ІІ
F = S
ПАВ, ПНВ
Позитивна – негативна
(С, Г ) (С, Г )
Рівняння
Гіббса:
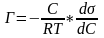
Флотація
2. Т – Г, Т – Р
Зелінський
Залежить від величини поверхні!
Питома адсорбція: Г = Х/S, Г = Х/m

Ізотерма адсорбції
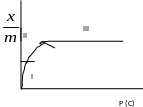
РІВНЯННЯ ФРЕЙДЛІХА: X/m = kP1/n = aC1/n
lgX/m = lgk + 1/nlgP = lga + 1/nlgC
РІВНЯННЯ
ЛЕНГМЮРА:

Завдання для срс №25. Теорія проміжних сполук. Іонообмінна адсорбція.
Гомогенний каталіз може протікати у газоподібній чи рідкій фазах при відповідному стані каталізатора. На перший план виходять умови перебігу реакцій: концентрації реагентів, температура, тиск, інтенсивність перемішування. Механізм гомогенного каталізу пояснюється теорією проміжних сполук. Відповідно до цієї теорії каталізатор утворює з однією з реагуючих речовин нестійку проміжну сполуку, що надалі взаємодіє з іншими реагентами, наприклад, у присутності каталізатора реакція А + В ↔ АВ відбувається у дві стадії:
А
+ K
![]() AK
AK
АK
+ B
![]() AB
+ K.
AB
+ K.
Енергетичні бар’єри, які необхідно подолати на кожній з цих стадій, значно нижчі, ніж для некаталітичного процесу, тому вони відбуваються з більшою швидкістю, ніж некаталітична реакція. Швидкість гомогенної каталітичної реакції найчастіше пропорційна концентрації каталізатора. Проміжна сполука АK (інтермедіат) перебуває в рівновазі з вихідними речовинами, отже, швидкість прямої (υ1) і зворотної (υ2) реакції дорівнює:
k1 ‧ c´A(cK – c´AK ) = k2 ‧ c´AK,
де cК – c´AK; c´A; c´AK – рівноважні концентрації каталізатора, речовини А і проміжної сполуки АK відповідно. Сумарна швидкість усього процесу u визначається швидкістю повільної другої стадії:
υ = k3 ‧ c´AK ‧ cB,
або
υ = k1 ‧ k3 ‧ c´A ‧ cB ‧ cK .
k2 + k1 ‧cA
Існують різні типи гомогенного каталізу: кислотно-основний, координаційний, ферментативний та ін.
Каталізаторами в розчинах слугують мінеральні кислоти, луги, іони металів, а також речовини, які сприяють виділенню вільних радикалів. Прикладом гомогенного каталізу є синтез бісфенолу А (хлоридна кислота в якості каталізатору):
Основним недоліком гомогенного каталізу є труднощі з виділенням каталізатору з кінцевої реакційної суміші, в результаті чого частина каталізатору втрачається, а продукт забруднюється ним.
За механізмом розрізняють іонні, радикальні та молекулярні каталітичні реакції. Механізм іонного каталізу полягає в обміні протонами між каталізатором та реагентами, який супроводжується внутрішньомолекулярними перетвореннями. При радикальному механізмі, коли каталізатор лише ініціює ланцюгову реакцію, швидкість процесу не пропорційна концентрації каталізатора.
Іонний обмін — обмін іонів між двома електролітами. Іонний обмін може відбуватися як в гомогенному, так і в гетерогенному середовищі, в якому один з електролітів буде твердим іонообмінним сорбентом.
При обмінній адсорбції адсорбент, поглинаючи певну кількість яких-небудь іонів, виділяє одночасно в розчин еквівалентну кількість інших іонів того ж знаку, витиснених з поверхні.
Іонний обмін відбувається зворотньо і переважно відноситься до оборотних процесів. Як іонообмінні сорбенти застосовуються тверді, практично не розчинні у воді і органічних розчинниках матеріали, звані іонітами. Іоніти бувають мінерального і органічного походження, природні і синтетичні. Велика частина іонітів — високомолекулярні сполуки з сітчастою і просторовою структурою.
Найбільше значення мають штучні полімерні іоніти, або іонообмінні смоли, що відрізняються високою поглинальною здатністю, механічною міцністю і хімічною стійкістю. Іонообмінні смоли — аморфні полімери з сітчастою структурою. Присутність в макромолекулах іоногенних груп додає полімеру гідрофільність. Оскільки ланцюги макромолекул полімеру в іонітних смолах «зшиті» один з одним в просторову сітку, розчинник викликає тільки набухання смоли.
З електрохімічної точки зору, всякий іоніт є полівалентний іон з негативним і позитивним зарядом, оточеним іонами протилежного знаку. Від звичайних адсорбентів іоніти відрізняються тим, що їх поглинальна здатність практично не залежить від величини поверхні і визначається цілком активною частиною іоніту. Остання являє собою дисоційовані іоногенні групи, що беруть безпосередню участь в реакціях іонного обміну. Молекула іоніту містить тисячі атомів, більшість яких взаємно зв'язані в довгий ланцюг або каркас сітчастої будови. Ця головна частина молекули є великий багато разів заряджений іон з позитивним або негативним зарядом. Для нейтралізації цього заряду є дрібніші іони протилежного заряду, які обмінюються місцями з іонами в розчині.
Іоніти діляться на дві групи. До першої групи відносяться смоли, що отримуються з органічних речовин кислотного характеру (фенолів) і звуться катіонітами. Катіоніти володіють здатністю обмінювати катіони, що містяться в розчині, на іони водню або натрію. Другу групу складають смоли, що отримуються з органічних сполук основного характеру (анілін) і звуться аніонітами. Аніоніти обмінюють різні аніони, що містяться в розчині, на гідроксильні іони.
Здатність іонітів вступати в іонний обмін з електролітами, що знаходяться в розчині, широко використовується в техніці. Поглинання іонів з розчину супроводжується строго еквівалентним витісненням рухомих іонів іоніту. Швидкість встановлення іонообмінної рівноваги визначається ступенем іонізації іоніту в даному середовищі і швидкістю дифузії іонів в розчині і в зернах поглинача.
З підвищенням ступеня набухання іоніту і з пониженням розміру зерен швидкість встановлення обмінної рівноваги підвищується. У тих, що набрякають і сильно іонізованих іонітах процес заміщення всіх рухомих іонів триває 2—5 сек. Тому витягувати іони з розчину можна динамічним методом, тобто фільтрацією його через колону, заповнену зернами іоніту. Для витягання солей з розчинів застосовують послідовно сполучені фільтри, одні з яких заповнені катіонітом, а інші — аніонітом. У міру просування розчину по колоні з катіонітом відбувається поглинання катіонів солей і витіснення іонів водню або натрію. У аніонітовій колоні аніони солей витісняють гідроксильні іони іоніту.
Послідовне застосування іонітів цих двох видів дозволяє досягти практично повної демінералізації води без її дистиляції.
Катіоніт і анионит, узяті в еквівалентних кількостях, поглинуть відповідно рівні кількості катіонів і аніонів з солей, розчинених у воді. В результаті виділиться еквівалентне число іонів Н+ і ОН-, які утворюють воду.
Як регенеруючі розчини для катіонітів в водневій формі застосовуються зазвичай 3%-, 5% розчини сірчаної або соляної кислоти. Катіоніти при цьому «заряджають» іонами водню
Для регенерації аніонітів застосовують 5%-ий розчин NaOH або Na2C03.
Особливим видом іонітів є селективні іонообмінні смоли (комплексоутворуючі іонообмінні смоли), здатні до утворення координаційних зв’язків з іонами, що поглинаються, або молекулами. Селективність (вибірковість) визначається співвідношенням і взаємним розташуванням функціональних груп в смолі, їх хімічною спорідненістю до сорбіруємого йону або молекули, структурою полімерної матриці, а також складом і кислотністю контактуючого розчину, природою розчинника. Для збільшення селективності в аіионіт або катіоніт вводять специфічні комплексоутворюючі групи (наприклад, гліоксиматні, пірідинкарбонові, 8-оксихінолінові).
Іоніти пом'якшують воду, використовувану для живлення парових котлів високого і надвисокого тиску. У машинобудуванні іоніти застосовуються для регенерації травильних електролітів, уловлювання кольорових металів з промивних вод цехів гальванічного покриття, в кольоровій металургії — для витягання з руд концентратів кольорових металів, для очищення стічних вод від фенолу, хрому, нікелю і ін.
Іоніти використовуються в біології і фармакології для розділення і очищення вітамінів. Іоніти почали застосовувати в сільському господарстві при вивченні агрономічних властивостей ґрунтів. У медицині за допомогою іонітів отримують кров, що не згущується, їх застосовують при лікуванні хворих, страждаючих підвищеною кислотністю шлунку.
Обмінна адсорбція широко застосовується в харчовій промисловості. Іонообмінне очищення дифузного соку в цукровій промисловості, як показав досвід, дозволяє знизити вихід кормової патоки з 3 до 2,1% по масі сировини, що збільшує вихід цукру майже на 1%.
У молочній промисловості іонний обмін використовується для зміни сольового складу молока. Коров'яче молоко багатше жіночого змістом солей і відрізняється характером утворення сиру, що залежить від співвідношення казеїну і кальцію. Видаляючи певні кількості кальцію з молока, можна міняти це співвідношення. В даний час іонітне молоко у великих кількостях виробляється для дитячого харчування.
Особливо велике застосування іонообмінні смоли знайшли у виробництві вина. З нього можна видалити зайву кількість іонів Fe3+, Cu2+, Ca2+, які викликають помутніння вина, знизити кислотність, добитися знебварвлення сусла вина. Видалення іонів важких металів з плодово-ягідних сусел запобігає потемнінню плодово-ягідних вин.
У виробництві дріжджів іоніти застосовуються для очищення меляси, яка служить живильним середовищем для вирощування дріжджів. У ній є сполуки, пригноблюючі життєдіяльність дріжджів: фарбувальні речовини, леткі органічні кислоти і інші домішки. Особливо важливе значення має використання іонітів для очищення води в пивоварному виробництві.
Каолін застосовується у вигляді тонкого подрібненого порошку, що володіє адсорбційними властивостями. Він адсорбує фарбувальні і пахучі речовини вина.
Бентонітові глини володіють високою здібністю до якнайтоншого диспергування, завдяки чому мають високі адсорбційні властивості. Вони відмінно утворюють тонкі суспензії (суспензії) в рідинах. Наприклад, водна суспензія застосовується для освітлення плодово-ягідних вин, а водно-винні суспензії — для освітлення виноградних вин. Бентоніти використовуються і для очищення сиропів в крахмало-паточном виробництві.
Трепел володіє високими адсорбуючими властивостями. Мікроскопічні дрібні лусочки, різноманітні за формою, при введенні у вино утворюють густу сітку, що фільтрує, відмінно захоплює зважені в вині домішки.
Активоване вугілля служить прекрасним адсорбентом і ділиться на дві групи — вугілля газове і знебарвлююче. Вугілля газові адсорбують гази і пари і мають дрібні пори. Вугілля другої групи служить для знебарвлення заводських розчинів в цукровому, крахмало-паточному виробництвах; для очищення і освітлення жирів і масел, спирту, вин і ін. Активоване вугілля адсорбує з цукрового розчину не тільки забарвлені, але і інші речовини.
Питання для самоперевірки
Дайте визначення гомогенного каталізу.
Поясніть теорію проміжних сполук.
Що таке іоніти?
В чому різниця між кат іонітами і аніонітами?
Де застосовуються іоніти?
Література:
1.1.С.183-187,
1.5.С.256-258,268-301,
1.6.С.158-164.
