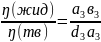- •11. Использование энтропии как критерия равновесия и определения направления протекания самопроизвольных процессов в изолированных системах.
- •12. Термодинамические потенциалы.
- •13. Применение энергии Гиббса и энергии Гельмгольца в качестве критериев направления самопроизвольных процессов и равновесия в изолированных системах.
- •14. Закон действия масс
- •15. Принцип Ле-Шателье.
- •16. Идеальные растворы. Законы Рауля.
- •17. Температура замерзания и кипения растворов. Криоскопия и эбуллиоскопия. Определение молекулярной массы растворенного вещества.
- •18. Закон Вант-Гоффа. Изотонический коэффициент. Положительные и отрицательные отклонения от закона Рауля.
- •19. Состав пара и температура кипения растворов.
- •20. Законы Коновалова.
- •I Закон:
- •21. Азеотропные смеси
- •22. Диаграммы: температура-состав при постоянном давлении; давление-состав при постоянной температуре.
- •23. Правило рычага.
21. Азеотропные смеси
Азеотропные растворы – это постоянно кипящие или нераздельно кипящие растворы. Азеотропные растворы разделить простой перегонкой на чистые компоненты нельзя. Для этого существуют специальные методы.
Азеотро́пная смесь — смесь двух или более жидкостей, состав которой не меняется при кипении, то есть смесь с равенством составов равновесных жидкой и паровой фаз. Смесь, в которой данное условие, напротив, не выполняется ни при каком соотношении количеств компонентов, называется зеотропной.
Например, азеотропная смесь воды и этилового спирта содержит 95,57 % спирта и кипит при температуре 78,15 °C]/ Этим объясняется принятая промышленная концентрация этилового спирта 96 %: это азеотропная смесь, и дальнейшей перегонкой её нельзя разделить на фракции. Температура кипения для азеотропной смеси может быть как меньше (положительные азеотропы), так и больше (отрицательные азеотропы) температуры кипения низкокипящего компонента.
При изменении давления изменяется не только температура кипения, но и состав азеотропной смеси, этим они отличаются от чистых жидкостей.
Для разделения азеотропных смесей используют различные технологии:
Удаление одного из компонентов за счёт адсорбции на твёрдом пористом материале;
Разделение на пористых мембранах;
Первапорация на непористых мембранах;
Перегонка при давлении, отличном от атмосферного, в частности — под вакуумом, см. выше;
Перегонка с дополнительным компонентом, с созданием тройного (или более) азеотропа
22. Диаграммы: температура-состав при постоянном давлении; давление-состав при постоянной температуре.

Нижняя линия – линия жидкости – это линия, показывающая зависимость температуры начала кипения от состава раствора.
Верхняя линия – зависимость Т начала конденсации пара от состава раствора.
Линии жидкости и пара определяют состав равновесной жидкости и пара при данной температуре.
23. Правило рычага.
Правило рычага позволяет определять относительное количество равновесных фаз. Если данная система распадается на две других системы, то фигуративные точки всех систем лежат на одной прямой. Количество равновесных фаз обратно пропорционально отрезкам, на которые точки системы делят промежуточно соединяющиеся фигуративные точки фаз.
Если диаграмма построена в мольных долях или процентах, то определение количества фаз: