
- •Міністерство освіти і науки україни дніпродзержинський державний технічний університет методичні вказівки
- •6.090801 – “Мікро- та наноелектроніка”,
- •6.050802 - „Електронні пристрої та системи”
- •1.Загальні положення
- •2. Правила безпеки при виконанні лабораторних робіт
- •3. Правила пожежної безпеки
- •5.Лабораторна робота №1
- •Контрольні питання і завдання
- •Лабораторна робота № 2 “ Визначення питомої теплоємності металу і його молярної маси атомів”
- •Контрольні питання і завдання
- •6.Лабораторна робота № 3
- •Контрольні питання і завдання
- •7.Лабораторна робота № 4
- •3.Контрольні запитання.
- •8.Лабораторна робота №5
- •4.Взаємодія осаду з кислотою:
- •Сумарне рівняння має вигляд:
- •9.Лабораторна робота № 6 “Окисно-відновні реакції”
- •Контрольні питання і завдання
- •10.Лабораторна робота № 7
- •Контрольні питання
- •11.Лабораторна робота № 8
- •Контрольні запитання.
- •12.Лабораторна робота № 9
- •3.Контрольні запитання.
- •13. Рекомендована література
- •51918 М. Дніпрдзержинськ,
4.Взаємодія осаду з кислотою:
а)Реакція в молекулярній формі: MnS + 2HCl H2S + MnCl2.
Іонне рівняння реакції: MnS + 2H+ H2S + Mn2+.
![]()
Реакція можлива.
б)Реакція в молекулярній формі: Ag2S + 2HCl 2AgCl +H2S.
Іонне рівняння реакції: Ag2S + 2H++ 2Cl- 2AgCl +H2S.
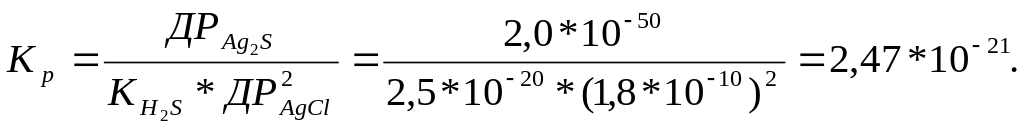
Константа рівноваги менше 1, реакція у прямому напрямку неможлива.
До іонообмінних реакцій відносять і реакції гідролізу. Гідроліз солі - взаємодія іонів розчиненої солі з іонами, які утворюються при дисоціації води. Гідроліз супроводжується зміною рН розчину, що пов’язане зі зміщенням рівноваги процесу дисоціації води внаслідок утворення мало дисоційованих або малорозчинних сполук.
Перебігання реакції гідролізу і рН розчину залежать від різноманітних факторів і в першу чергу від природи катіону і аніону, що утворюють сіль.
Сіль, утворена катіоном одно кислотної сильної основи і аніоном одноосновної слабкої кислоти, наприклад:
КСN + H2O KOH + HCN,
СN- + H2O OH- + HCN.
Кажуть, що така сіль гідролізується по аніону, середовище розчину набуває лужну реакцію (рН>7).
Сіль, утворена катіоном одно кислотної слабкої основи і аніоном одноосновної сильної кислоти, наприклад:
NH4Cl + H2O NH4OH + HCl,
NH4+ + H2O NH4OH + H+.
Кажуть, що така сіль гідролізується по катіону, середовище розчину набуває кислу реакцію (рН<7).
Солі слабких кислот і слабких основ гідролізуються у більшій мірі, оскільки тут можуть утворюватися одночасно усі можливі продукти гідролізу.
CH3COONH4 + H2O ↔ CH3COOH + NH4OH,
рН середовища залежить від співвідношення констант дисоціації кислоти і основи: якщо сильніша кислота – рН < 7, якщо сильніша основа – рН > 7 (утворюється або слабо кисле, або слабо лужне середовище).
2. Експериментальна частина.
Дослід 1. Взаємодія сильного електроліту з сильним електролітом без утворення малорозчинних, газоподібних сполук і слабких електролітів. Розмістить у пробірці 0,1 н розчин КNO3 і додайте 0,1н розчин NaCl. Поясніть відсутність утворення осаду і виділення газоподібних продуктів реакції.
Дослід 2. Реакція утворення слабкого електроліту – води(реакція нейтралізації). Внесить у пробірку 5 крапель 0,1н розчину нітратної кислоти. За допомогою універсального індикаторного паперу визначить приблизне значення рН розчину кислоти. Додайте у пробірку 6 крапель 0,1н розчину натрію гідроксиду. Визначить приблизне значення рН отриманого розчину за допомогою універсального індикаторного паперу. Як змінилося значення рН отриманого розчину? З чим це пов’язане? Який слабкий електроліт утворився при взаємодії сильної кислоти з сильною основою?
Дослід 3. Реакція взаємодії сильних електролітів з утворенням осаду. Внесіть в пробірку по 2-3 краплини розчинів солей ВаСl2 і К2СrО4. Відмітьте колір отриманого осаду. Чому ці солі взаємодіють між собою?
ВаСl2 + К2СrО4 →
Напишіть рівняння реакції в молекулярній та іонно-молекулярній формах.
Дослід 4. Реакція взаємодії сильних електролітів з утворенням газоподібної сполуки. У чистий сухий тигель помість 1-2 краплі розчину солі амоніаку (наприклад, NH4Cl ), додайте 2-3 краплі NaOH або KOH, накрийте предметним склом із прикріпленим вологим рожевим лакмусовим папером. Тигель злегка нагрійте(якщо концентрація іонів NH4+ незначна), не допускаючи розбризкування рідини:
NH4Cl + NaOH NaCl + NH3 + H2O,
NH4+ + OH- NH3 + H2O.
Спостерігайте зміну кольору вологого індикаторного лакмусового паперу з рожевого у синій:
NH3 + H2O NH4OH.
Амоніак, що утворився, можна спостерігати і за запахом(Обережно! Не направляти отвір пробірки на обличчя!).
Дослід 5. Реакція розчинення осаду з утворенням комплексної сполуки
До 4-5 крапель розчину солі купруму додайте 1-2 краплі розчину NH4OH до появи зеленуватого осаду (CuOH)2SO4:
2CuSO4 + 2NH4OH (CuOH)2SO4 + (NH4)2SO4.
Додайте надлишок аміаку (5-6 крапель 2 н розчини NH4OH або 1-2 краплі концентрованого розчину аміаку), до повного розчинення осаду і появи інтенсивно синього кольору:
(CuOH)2SO4 + 6NH4OH + (NH4)2SO4 2[Cu(NH3)4]SO4 + 8H2O
