
- •6.040106 «Екологія навколишнього середовища та збалансоване природокористування» денної та заочної форм навчання
- •Київ нухт 2013
- •Передмова
- •1. Предмет органічної хімії
- •2. Електронна будова атому Карбону
- •2.1. Поняття про гібридизацію атомів Карбону.
- •3. Типи хімічних зв’язків в органічних сполуках
- •3.1. Характеристики ковалентного зв’язку
- •3.2. Електронні впливи (електронні ефекти в молекулах)
- •3.4. Типи утворення і види ковалентних зв’язків
- •4. Класифікація органічних сполук
- •5.1. Номенклатура і загальні принципи сучасної хімічної термінології
- •5.2. Ізомерія алканів та їх одновалентних залишків (алкілів)
- •5.3. Поняття про первинні, вторинні, третинні атоми Карбону
- •5.4. Правила номенклатури iupac
- •5.5. Методи добування алканів
- •5.6. Хімічні властивості алканів
- •5.7. Окремі представники
- •6. Алкени
- •6.1. Ізомерія алкенів
- •6.2. Номенклатура
- •6.3. Методи добування
- •6.4. Хімічні властивості
- •IV. Ізомеризація.
- •6.5. Просторова будова (стереохімія) алкенів (гомологів етену)
- •6.6. Окремі представники
- •7.1. Методи добування
- •7.2. Хімічні властивості
- •IV. Реакції заміщення атома Гідрогену біля потрійного зв’язку.
- •7.3. Окремі представники
- •8. Алкадієни
- •8.1. Ізомерія алкадієнів
- •8.2. Класифікація
- •8.3. Методи добування
- •8.4. Хімічні властивості
- •8.5. Окремі представники
- •9. Циклоалкани
- •9.1. Номенклатура. Ізомерія
- •9.2. Будова циклоалканів
- •9.3. Сучасні уявлення про будову малих циклів
- •9.4. Стереохімія циклоалканів
- •9.5. Окремі представники
- •10. Арени (Ароматичні вуглеводні)
- •10. 1. Класифікація ароматичних сполук
- •10.2. Ароматичні вуглеводні з одним бензеновим ядром
- •10.2.1. Будова молекули бензену
- •10.2.2. Гомологи бензену
- •10.2.3. Ізомерія та номенклатура.
- •10.2.4. Методи добування бензену та його гомологів.
- •10.2.5. Хімічні властивості
- •10.2.6. Окремі представники
- •10.3. Багатоядерні ароматичні вуглеводні
- •10.3.1. Багатоядерні ароматичні вуглеводні з неконденсованими бензеновими ядрами
- •1. Група дифенілу.
- •2. Дифенілметан.
- •3. Група трифенілметану.
- •10.3.2. Багатоядерні ароматичні сполуки з конденсованими ядрами
- •11. Галогеновуглеводні
- •11.1. Класифікація
- •11.2. Номенклатура
- •11.3. Ізомерія
- •11.3. Методи добування
- •11.4. Хімічні властивості
- •11.5. Окремі представники
- •12. Гідроксисполуки (спирти)
- •12.1. Класифікація
- •12.2. Номенклатура
- •12.3. Ізомерія
- •12.4. Фізичні властивості
- •12.5. Методи добування одноатомних спиртів
- •12.6. Хімічні властивості спиртів
- •Третинні спирти окиснюються важко з розривом карбонового ланцюга.
- •12.7. Окремі представники
- •13. Багатоатомні спирти
- •13.1. Хімічні властивості
- •13.2. Окремі представники
- •14.Феноли
- •14.1. Номенклатура
- •14.2. Методи добування
- •14.3. Фізичні властивості
- •14.4. Хімічні властивості.
- •14.5. Окремі представники
- •15. Етери
- •15.6. Хімічні властивості
- •15.7. Окремі представники
- •16. Оксосполуки ( альдегіди і кетони)
- •16.1. Класифікація
- •16.2. Ізомерія
- •16.3. Номенклатура
- •16.4. Методи добування
- •16.5. Фізичні властивості
- •16.6. Хімічні властивості
- •I. Реакції приєднання.
- •III. Реакції заміщення.
- •IV. Реакції полімеризації.
- •16.7. Окремі представники
- •17. Карбонові кислоти
- •17.1. Одноосновні карбонові кислоти
- •17.1.1. Номенклатура
- •Назви деяких карбонових кислот
- •17.1.2. Ізомерія
- •17.1.3. Методи добування
- •17.1.4. Фізичні властивості
- •17.1.5. Хімічні властивості
- •17.1.6. Окремі представники
- •17.2. Дикарбонові кислоти
- •Назви деяких дикарбонових кислот
- •17.2.1. Методи добування
- •17.2.2. Фізичні властивості
- •17.2.3. Хімічні властивості
- •17.2.4. Окремі представники
- •17.3. Ненасичені монокарбонові кислоти
- •Назви деяких ненасичених монокарбонових кислот
- •18. Жири
- •18.1. Фізичні властивості
- •18.2. Методи добування
- •18.3. Хімічні властивості
- •1. Гідроліз, або омилення:
- •2. Гідрогенізація жирів
- •3. Згіркнення жирів
- •18.4. Застосування жирів
- •19. Гідроксикарбонові кислоти. Гідроксикислоти
- •19.1. Ізомерія
- •19.2. Методи добування
- •19.3. Фізичні властивості
- •19.4. Хімічні властивості
- •20. Оптична ізомерія гідроксикислот
- •21. Вуглеводи
- •21.1. Класифікація вуглеводів
- •21.2. Моносахариди
- •21.2.1. Будова моносахаридів
- •21.2.2. Стереохімія моноз
- •21.2.3. Циклічна структура моносахаридів
- •21.2.4. Характер окисних кілець
- •21.2.5. Таутомерна рівновага моносахаридів. Явище мутаротації
- •21.2.6. Поняття про конформаційну ізомерію
- •21.2.7. Методи добування
- •21.2.8. Фізичні властивості
- •21.2.9. Хімічні властивості
- •1. Реакції окиснення моносахаридів:
- •7. Дія мінеральних кислот.
- •8. Реакція алкілювання.
- •9. Реакція ацилювання.
- •10. Утворення сахаратів.
- •11. Бродіння моносахаридів.
- •21.2.10. Окремі представники
- •21.3. Полісахариди
- •21.3.1. Олігосахариди (сахароподібні полісахариди)
- •21.3.1.1. Дисахариди (біози)
- •21.3.1.2. Глікозил-глікози (відновлювальні дисахариди)
- •21.3.1.3. Глікозил-глікозиди, або невідновлювальні дисахариди
- •21.3.2. Вищі полісахариди (поліози, несахароподібні складні вуглеводи)
- •22. Нітрогеновмісні органічні сполуки
- •22.1. Нітросполуки жирного й ароматичного рядів
- •22.1.1. Класифікація
- •22.1.2. Номенклатура
- •22.1.3. Ізомерія
- •22.1.4. Методи добування
- •22.1.5. Фізичні властивості
- •22.1.6. Хімічні властивості нітросполук
- •22.1.7. Окремі представники
- •22.2.1. Класифікація
- •22.2.2. Номенклатура
- •22.2.3. Ізомерія
- •22.2.4. Методи добування
- •22.2.5. Фізичні властивості
- •22.2.6. Хімічні властивості
- •22.2.7. Окремі представники
- •22.3. Ароматичні діазо- та азосполуки
- •22.3.1. Номенклатура
- •22.3.2. Методи добування
- •22.3.3. Фізичні властивості
- •22.3.4. Хімічні властивості
- •22.4. Амінокислоти
- •22.4.1. Класифікація
- •22.4.2. Номенклатура
- •22.4.3. Ізомерія
- •22.4.4. Методи добування
- •22.4.5. Будова молекул
- •22.4.6. Фізичні властивості
- •22.4.7. Хімічні властивості
- •22.4.8. Окремі представники
- •Література
- •6.051301. «Хімічна технологія», 6.051401 «Біотехнологія»
- •6.040106 «Екологія навколишнього середовища та збалансоване природокористування» денної та заочної форм навчання
IV. Ізомеризація.
Як правило, ізомеризація положення подвійного зв’язку відбувається за високих температур і проходить за радикальним механізмом.

Практично такий процес використовується дуже рідко.
Примітка! При розв’язуванні задач на добування одного ізомеру з іншого треба використовувати перетворення, які однозначно приводять від одного ізомеру до іншого, а не до суміші можливих ізомерів.
Приклад: Від бутену-1 перейти до бутену-2.

V. Високотемпературне галогенування гомологів етилену.
У разі галогенування за температур порядку 500 – 550°С реакція іде не за іонним механізмом приєднання, а за радикальним механізмом заміщення. При цьому заміщення відбувається в α-положенні до подвійного зв’язку.

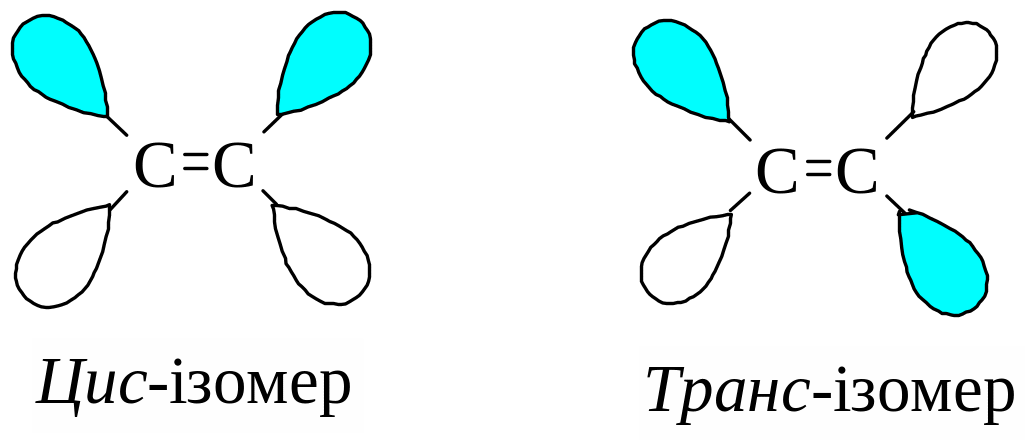
6.5. Просторова будова (стереохімія) алкенів (гомологів етену)
Заміщені етилени можуть існувати у вигляді цис- або транс- ізомерів:
1. Якщо два однакові замісники при двох атомах Карбону, що складають подвійний зв’язок, розташовані по один бік від площини подвійного зв’язку, то це цис-ізомер.
2. Якщо два однакові замісники при двох атомах Карбону, що складають подвійний зв’язок, розташовані по різні боки від площини подвійного зв’язку, то це транс-ізомери.
Але розглянутий вид просторової (геометричної) ізомерії є лише окремим випадком загального типу ізомерії, що називається E/Z – ізомерією (від двох німецьких слів – entgegen – навпроти; zusammen – разом).
В термінах E/Z – ізомерії можна розглядати гомологи етену, що мають чотири (або три) зовсім різні замісники біля подвійного зв’язку. Для цього спершу розглядається старший із замісників. Старшість замісників визначається тим, який атомний номер має атом замісника, що сполучається з атомом Карбону подвійного зв’язку.

Z-ізомер – має старші замісники біля атомів Карбону подвійного зв’язку знаходяться по один бік від площини подвійного зв’язку.
Е-ізомер – має старші замісники по різні боки подвійного зв’язку.

6.6. Окремі представники
Етен (етилен) – безбарвний, майже нерозчинний у воді газ. Горить світлим кіптявим полум’ям, утворює з повітрям вибухові суміші.
Етен міститься в значній кількості у коксових газах очистки нафтопереробних установок, з яких він добувається.
Етен використовують здебільшого для виробництва поліетилену, а також для добування етанолу, ацетальдегіду, вінілхлориду і стирену. Слід згадати про використання етену для прискорення дозрівання фруктів. Це дає змогу транспортувати недозрілі плоди до місця призначення, де вони дозрівають в атмосфері етену.
Пропен виділяють з газів нафтопереробки й у великій кількості використовують для синтезу ізопропанолу, поліпропілену і алілхлориду.
Бутени добувають у промислових масштабах з газів крекінгу або переробки нафти. 1-Бутен і ізомерні 2-бутени використовують для виробництва 1,3-бутадієну і 2-бутанолу. [1], c. 145-146; [2], с. 229-252.
Контрольні запитання та завдання
1. Напишіть структурні формули ізомерів (крім стереоізомерів) пентену, назвіть їх за номенклатурою IUPAC і (якщо можна) дайте їм альтернативні назви. Напишіть структурні формули продуктів, які утворюються під час озонолізу кожного з них.
2. Напишіть форми геометричних ізомерів: н-пентенів; монобромопропенів; ізопентенів.
3. Які алкени утворюються з наведених сполук? Напишіть рівняння відповідних реакцій:
(СН3)3ССl; (СН3)2С(ОН)С(СН3)3
4. Який алкен у кожній парі активніший у реакції приєднання Н2О? Дайте пояснення: а) етен або пропен; б) етен або вінілбромід; в) пропен або 2-бутен; г) 2-бутен або ізобутен; д) 1-пентен або 2-метил-1-бутен.
5. Наведіть механізм реакцій:
СН3СН=СН2 + НОВr ?
ССl3СН=СН2 + НОВr ?
6. Напишіть структурні формули алкенів, у яких в під час озонолізу утворюються такі продукти: а) СН3СН2СН2СНО та НСНО; б) СН3СН(СН3)СНО та СН3СНО; в) тільки СН3СОСН3. Що дає кожний із цих алкенів у реакції з калійперманганатом?
7. Алкіни
Це вуглеводні, що містять один потрійний зв’язок. Загальна формула: CnH2n-2.
Ізомерія, як і в ряду алкенів, зумовлена:
а) ізомерією будови карбонового ланцюга;
б) ізомерією положення потрійного зв’язку в ланцюзі.
Номенклатура:
раціональна
(за основу беруть назву першого члена
гомологічного ряду – ацетилен);
систематична:
![]()
Приклад:

