
- •6.040106 «Екологія навколишнього середовища та збалансоване природокористування» денної та заочної форм навчання
- •Київ нухт 2013
- •Передмова
- •1. Предмет органічної хімії
- •2. Електронна будова атому Карбону
- •2.1. Поняття про гібридизацію атомів Карбону.
- •3. Типи хімічних зв’язків в органічних сполуках
- •3.1. Характеристики ковалентного зв’язку
- •3.2. Електронні впливи (електронні ефекти в молекулах)
- •3.4. Типи утворення і види ковалентних зв’язків
- •4. Класифікація органічних сполук
- •5.1. Номенклатура і загальні принципи сучасної хімічної термінології
- •5.2. Ізомерія алканів та їх одновалентних залишків (алкілів)
- •5.3. Поняття про первинні, вторинні, третинні атоми Карбону
- •5.4. Правила номенклатури iupac
- •5.5. Методи добування алканів
- •5.6. Хімічні властивості алканів
- •5.7. Окремі представники
- •6. Алкени
- •6.1. Ізомерія алкенів
- •6.2. Номенклатура
- •6.3. Методи добування
- •6.4. Хімічні властивості
- •IV. Ізомеризація.
- •6.5. Просторова будова (стереохімія) алкенів (гомологів етену)
- •6.6. Окремі представники
- •7.1. Методи добування
- •7.2. Хімічні властивості
- •IV. Реакції заміщення атома Гідрогену біля потрійного зв’язку.
- •7.3. Окремі представники
- •8. Алкадієни
- •8.1. Ізомерія алкадієнів
- •8.2. Класифікація
- •8.3. Методи добування
- •8.4. Хімічні властивості
- •8.5. Окремі представники
- •9. Циклоалкани
- •9.1. Номенклатура. Ізомерія
- •9.2. Будова циклоалканів
- •9.3. Сучасні уявлення про будову малих циклів
- •9.4. Стереохімія циклоалканів
- •9.5. Окремі представники
- •10. Арени (Ароматичні вуглеводні)
- •10. 1. Класифікація ароматичних сполук
- •10.2. Ароматичні вуглеводні з одним бензеновим ядром
- •10.2.1. Будова молекули бензену
- •10.2.2. Гомологи бензену
- •10.2.3. Ізомерія та номенклатура.
- •10.2.4. Методи добування бензену та його гомологів.
- •10.2.5. Хімічні властивості
- •10.2.6. Окремі представники
- •10.3. Багатоядерні ароматичні вуглеводні
- •10.3.1. Багатоядерні ароматичні вуглеводні з неконденсованими бензеновими ядрами
- •1. Група дифенілу.
- •2. Дифенілметан.
- •3. Група трифенілметану.
- •10.3.2. Багатоядерні ароматичні сполуки з конденсованими ядрами
- •11. Галогеновуглеводні
- •11.1. Класифікація
- •11.2. Номенклатура
- •11.3. Ізомерія
- •11.3. Методи добування
- •11.4. Хімічні властивості
- •11.5. Окремі представники
- •12. Гідроксисполуки (спирти)
- •12.1. Класифікація
- •12.2. Номенклатура
- •12.3. Ізомерія
- •12.4. Фізичні властивості
- •12.5. Методи добування одноатомних спиртів
- •12.6. Хімічні властивості спиртів
- •Третинні спирти окиснюються важко з розривом карбонового ланцюга.
- •12.7. Окремі представники
- •13. Багатоатомні спирти
- •13.1. Хімічні властивості
- •13.2. Окремі представники
- •14.Феноли
- •14.1. Номенклатура
- •14.2. Методи добування
- •14.3. Фізичні властивості
- •14.4. Хімічні властивості.
- •14.5. Окремі представники
- •15. Етери
- •15.6. Хімічні властивості
- •15.7. Окремі представники
- •16. Оксосполуки ( альдегіди і кетони)
- •16.1. Класифікація
- •16.2. Ізомерія
- •16.3. Номенклатура
- •16.4. Методи добування
- •16.5. Фізичні властивості
- •16.6. Хімічні властивості
- •I. Реакції приєднання.
- •III. Реакції заміщення.
- •IV. Реакції полімеризації.
- •16.7. Окремі представники
- •17. Карбонові кислоти
- •17.1. Одноосновні карбонові кислоти
- •17.1.1. Номенклатура
- •Назви деяких карбонових кислот
- •17.1.2. Ізомерія
- •17.1.3. Методи добування
- •17.1.4. Фізичні властивості
- •17.1.5. Хімічні властивості
- •17.1.6. Окремі представники
- •17.2. Дикарбонові кислоти
- •Назви деяких дикарбонових кислот
- •17.2.1. Методи добування
- •17.2.2. Фізичні властивості
- •17.2.3. Хімічні властивості
- •17.2.4. Окремі представники
- •17.3. Ненасичені монокарбонові кислоти
- •Назви деяких ненасичених монокарбонових кислот
- •18. Жири
- •18.1. Фізичні властивості
- •18.2. Методи добування
- •18.3. Хімічні властивості
- •1. Гідроліз, або омилення:
- •2. Гідрогенізація жирів
- •3. Згіркнення жирів
- •18.4. Застосування жирів
- •19. Гідроксикарбонові кислоти. Гідроксикислоти
- •19.1. Ізомерія
- •19.2. Методи добування
- •19.3. Фізичні властивості
- •19.4. Хімічні властивості
- •20. Оптична ізомерія гідроксикислот
- •21. Вуглеводи
- •21.1. Класифікація вуглеводів
- •21.2. Моносахариди
- •21.2.1. Будова моносахаридів
- •21.2.2. Стереохімія моноз
- •21.2.3. Циклічна структура моносахаридів
- •21.2.4. Характер окисних кілець
- •21.2.5. Таутомерна рівновага моносахаридів. Явище мутаротації
- •21.2.6. Поняття про конформаційну ізомерію
- •21.2.7. Методи добування
- •21.2.8. Фізичні властивості
- •21.2.9. Хімічні властивості
- •1. Реакції окиснення моносахаридів:
- •7. Дія мінеральних кислот.
- •8. Реакція алкілювання.
- •9. Реакція ацилювання.
- •10. Утворення сахаратів.
- •11. Бродіння моносахаридів.
- •21.2.10. Окремі представники
- •21.3. Полісахариди
- •21.3.1. Олігосахариди (сахароподібні полісахариди)
- •21.3.1.1. Дисахариди (біози)
- •21.3.1.2. Глікозил-глікози (відновлювальні дисахариди)
- •21.3.1.3. Глікозил-глікозиди, або невідновлювальні дисахариди
- •21.3.2. Вищі полісахариди (поліози, несахароподібні складні вуглеводи)
- •22. Нітрогеновмісні органічні сполуки
- •22.1. Нітросполуки жирного й ароматичного рядів
- •22.1.1. Класифікація
- •22.1.2. Номенклатура
- •22.1.3. Ізомерія
- •22.1.4. Методи добування
- •22.1.5. Фізичні властивості
- •22.1.6. Хімічні властивості нітросполук
- •22.1.7. Окремі представники
- •22.2.1. Класифікація
- •22.2.2. Номенклатура
- •22.2.3. Ізомерія
- •22.2.4. Методи добування
- •22.2.5. Фізичні властивості
- •22.2.6. Хімічні властивості
- •22.2.7. Окремі представники
- •22.3. Ароматичні діазо- та азосполуки
- •22.3.1. Номенклатура
- •22.3.2. Методи добування
- •22.3.3. Фізичні властивості
- •22.3.4. Хімічні властивості
- •22.4. Амінокислоти
- •22.4.1. Класифікація
- •22.4.2. Номенклатура
- •22.4.3. Ізомерія
- •22.4.4. Методи добування
- •22.4.5. Будова молекул
- •22.4.6. Фізичні властивості
- •22.4.7. Хімічні властивості
- •22.4.8. Окремі представники
- •Література
- •6.051301. «Хімічна технологія», 6.051401 «Біотехнологія»
- •6.040106 «Екологія навколишнього середовища та збалансоване природокористування» денної та заочної форм навчання
22.1.2. Номенклатура
Найбільш вживаними для нітросполук є назви за систематичною номенклатурою, де сполука розглядається як відповідний вуглеводень, а нітрогрупа — як замісник у карбоновому ланцюгу. Крім того, для окремих сполук вживаними є тривіальні назви, наприклад тринітротолуен називають тол, або тротил.
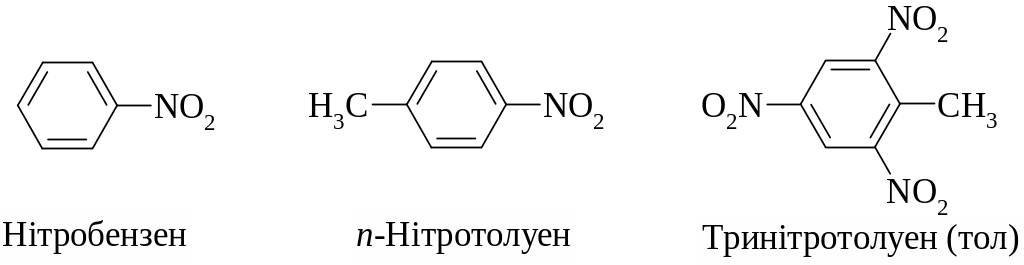
22.1.3. Ізомерія
Ізомерія нітросполук пов'язана з ізомерією: а) карбонового ланцюга; б) положення нітрогрупи у ланцюгу; в) для полінітросполук — зі взаємним розташуванням нітрогруп в молекулі.
22.1.4. Методи добування
Методи добування нітросполук здебільшого вже були розглянуті під час розгляду хімічних властивостей відповідних класів вуглеводнів:
1. Нітрування алканів за Коноваловим;
2. Нітрування алканів у газовій фазі;.
3. Нітрування аренів у кільце (нітруючою сумішшю) та в бічний ланцюг (розведеною нітратною кислотою).
4. Дія солей нітритної кислоти на галогеналкани – як метод синтезу первинних і вторинних нітросполук:
![]()
5. Окиснення амінів зазвичай використовується для добування третинних нітросполук із амінів.
![]()
22.1.5. Фізичні властивості
За агрегатним станом аліфатичні нітросполуки здебільшого є рідинами, а ароматичні – рідинами або твердими речовинами. Аліфатичні нітросполуки мають приємний запах, а ароматичні — запах гіркого мигдалю. Густину більшу за одиницю мають усі нітросполуки ароматичного ряду, з аліфатичних — лише чотири перші гомологи, густина наступних (після нітробутану) гомологів менша за одиницю. Всі нітросполуки мають великі значення електричного моменту диполя, високі температури кипіння та плавлення (порівняно з ізомерними їм етерами нітритної кислоти), що пояснюється наявністю в їх молекулах координаційного зв'язку.
22.1.6. Хімічні властивості нітросполук
Хімічна поведінка нітросполук зумовлюється будовою не тільки нітрогрупи, а й вуглеводневого залишку, а також їх взаємним впливом.
1. Нітрогрупа за рахунок свого сильного –І-ефекту спричинює рухливість атомів Гідрогену біля α-карбонового атома, внаслідок чого первинні та вторинні нітросполуки можуть існувати у двох таутомерних формах:
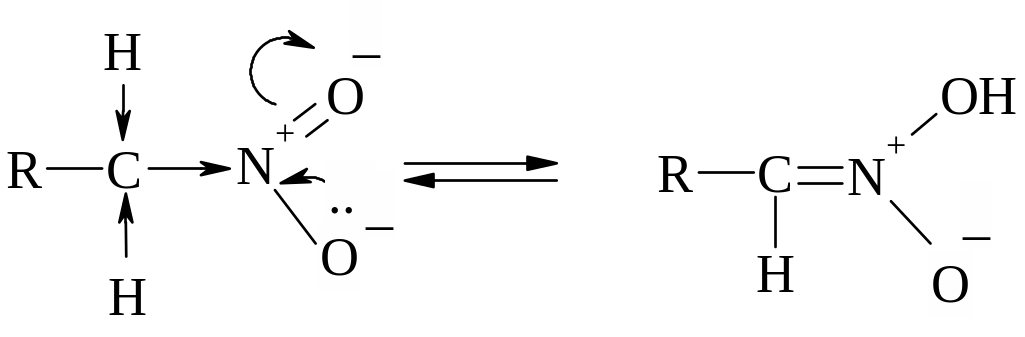
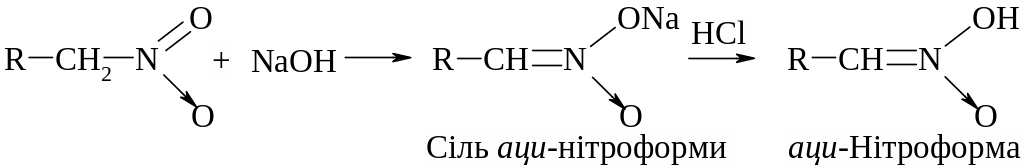
Завдяки цьому первинні і вторинні нітросполуки розчиняються в лугах з утворенням солей. Треба мати на увазі, що це солі не власне нітросполук, а ізомерних їм ізонітросполук, так званих аци-нітроформ. Аци-нітроформи виявляють сильно виражені кислотні властивості:
Аналогічно для вторинних нітросполук:
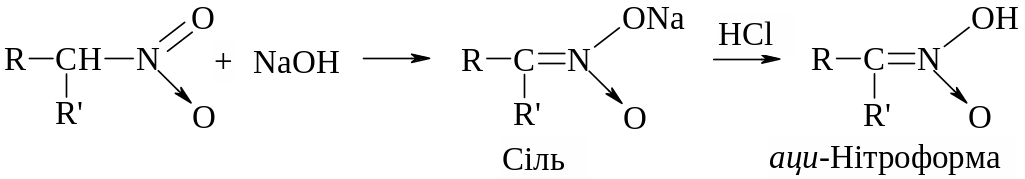
Аци-нітроформа утворена при підкисленні розчину, її солі швидко ізомеризується в нітроформу. Таким чином, аліфатичні нітросполуки є псевдокислотами, оскільки вони самі нейтральні, не мають електропровідності, однак утворюють солі лужних металів.
2. Дія нітритної кислоти є характерною (якісною) реакцією, за якою можна розрізнити первинні, вторинні, третинні нітросполуки. Вона також зумовлена рухливістю атомів Гідрогену в α-положенні до нітрогрупи.
Первинні нітросполуки з нітритною кислотою утворюють нітролові кислоти, лужні солі яких забарвлені в червоний колір:

Вторинні нітросполуки при взаємодії з нітритною кислотою також виділяють воду:

Псевдонітроли у кристалічному стані безбарвні, а в розчинах (в етері, хлороформі тощо) набувають інтенсивного синьо-зеленого забарвлення.
Третинні нітросполуки з нітритною кислотою не реагують.
3. Конденсація з альдегідами, як і дві попередні реакції, можлива за наявності рухливих атомів Гідрогену в α-положенні і відбувається за альдольно-кротоновим типом:


4. Відновлення нітросполук зумовлює утворення первинних амінів. Особливе значення має відновлення ароматичних нітросполук, під час якого синтезуються у промисловому масштабі важливі нітрогеновмісні ароматичні сполуки. Залежно від типу відновника і відповідних умов реакції можна добути різні продукти відновлення. У нейтральному або кислому середовищі реакція відбувається за схемою:

У лужному середовищі утворюється значно більше проміжних продуктів:
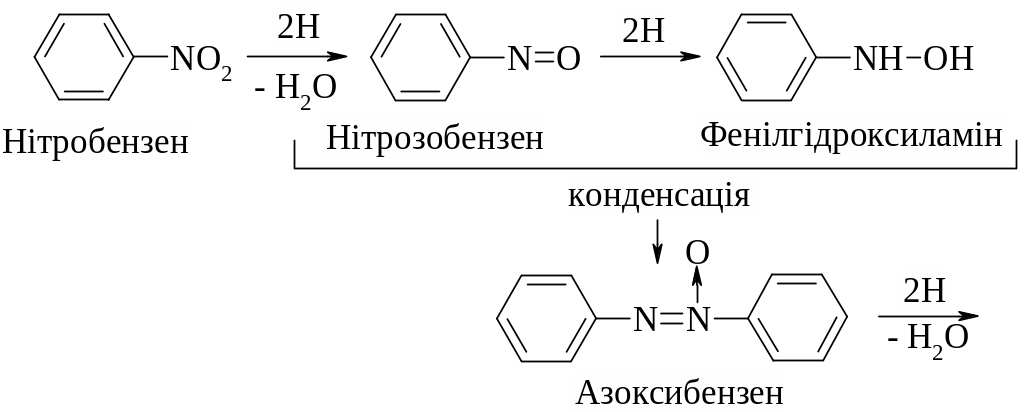

5. Заміщення в бензеновому кільці ароматичних нітросполук. У реакціях електрофільного заміщення в бензеновому кільці (SE) нітрогрупа є орієнтантом другого роду (-М) і в реакціях галогенування, сульфування, алкілювання, ацилювання, нітрування орієнтує відповідні замісники в мета-положення, у той самий час ускладнюючи їх перебіг (тому ці реакції здійснюються за жорсткіших умов, ніж для відповідних ароматичних вуглеводнів):

Електрофільне заміщення в кільці ароматичних динітросполук відбувається за значно жорсткіших умов, ніж монопохідних.
