
11.2.2 Изменение агрегатного состояния
В разделе 11.2.2 рассматривался процесс парообразования, осуществляемый при постоянном давлении. Аналогичный переход из твердого состояния в газообразное называют возгонкой, или сублимацией, а из твердого состояния к жидкому – плавлением.
Состояния вещества при этих превращениях считают устойчивыми, стабильными. При этом всякие изменения состояния считаются квазистатическими, как это обычно принято в термодинамике.
П ереход
из одного агрегатного состояния в другое
удобно рассматривать на р
-
t
– диаграмме
(рисунок
11.6). Кривая АК
представляет
собой зависимость между давлением
насыщенного пара и температурой кипения,
т. е. р =
f
(tн)
(кривая
упругости пара).
ереход
из одного агрегатного состояния в другое
удобно рассматривать на р
-
t
– диаграмме
(рисунок
11.6). Кривая АК
представляет
собой зависимость между давлением
насыщенного пара и температурой кипения,
т. е. р =
f
(tн)
(кривая
упругости пара).
Рисунок 11.6 – р
– t
- диаграмма,
для рассмотрения перехода из одного
агрегатного состояния в другое
Кривая равновесия жидкой и газообразной фазы заканчивается в критической точке К.
Если от жидкости отбирать теплоту при постоянном давлении, то при определенной температуре жидкость переходит в твердое состояние. Температура, при которой осуществляется этот переход, называется температурой затвердевания, или плавления tпл, а количество теплоты, отбираемое в этом процессе, называется скрытой теплотой плавления. При плавлении так же, как и при парообразовании, вещество находится в двух фазах. Аналогично кривой АК можно построить кривую AD, которая однозначно определяется зависимостью р = f(tпл).
Кривая сублимации АВ представляет собой зависимость р = f(tc) для перехода твердого тела в газообразное. Этот переход при температуре сублимации tc происходит вследствие подведения некоторого количества теплоты, носящего название скрытой теплоты сублимации. Точки этой кривой соответствуют двухфазной системе твердое тело – газ (например, водяной пар над поверхностью льда).
Все три кривых равновесия (парообразования, плавления и сублимации) пересекаются в некоторой характерной для каждого вещества точке. Эта точка А называется тройной точкой, а изображаемое ею состояние – фундаментальным. В этой точке находятся в термодинамическом равновесии три различные фазы вещества: твердая, жидкая и газообразная.
Тройной точке воды соответствуют следующие параметры:
давление р = 0,00610 бар, Т =273,16 К.
Рассмотрение описанных процессов показывает, что в состояниях, находящихся между кривыми АВ, АЕ и AD, тело будет находиться целиком в одной фазе: правее АВ и АК – область газообразного состояния; левее линий AD и АВ располагается область вещества в твердом состоянии; между линиями AD и АК находится область жидкости.
В состояниях на линии АК, AD и АВ вещество может существовать в двух фазах, причем на линии АК в жидкой и газообразной, на AD – твердой и жидкой; а на линии АВ вещество может быть в твердом и газообразном состояниях. Расположение и вид этих трех кривых
AK – p = f(tн), АD – р = f(tпл), AB – p = f(tc)
зависят от природы вещества и устанавливаются опытным путем.
11.2.4. Параметры состояния воды и водяного пара
Вследствие незначительной сжимаемости воды можно принять, что плотность воды при 0° С и любых давлениях есть величина постоянная, ('0 = 0,001 м3/кг). Начало отсчета внутренней энергии энтальпии и энтропии берется от 0° С и соответствующего давления насыщения р = 0,00610 бар. При этих параметрах энтальпия, энтропия, а также внутренняя энергия воды берутся условно равными нулю: s'0 = 0, i'0 = 0, u'0 = 0.
В процессе подогрева воды происходит нагревание ее до температуры кипения tн. Удельный объем воды при температуре кипения ' будет больше объема '0. Соответствующие значения ' для воды в функции температуры и давления для состояний, лежащих или на нижней пограничной кривой, или левее ее, даются в справочной литературе.
Количество теплоты, которое нужно сообщать воде, чтобы нагреть ее от 0° С до температуры кипения в процессе р = const, называется теплотой жидкости. Это количество теплоты определяется по формуле
![]() , (11.15)
, (11.15)
или
![]() (11.16)
(11.16)
где
![]() – средняя
теплоемкость воды в интервале температур
от 0° С
до tН°С/
– средняя
теплоемкость воды в интервале температур
от 0° С
до tН°С/
При низких по
сравнению с Ткр
температурах
можно считать
![]() = 4,1865 кДж/(кг·град).
= 4,1865 кДж/(кг·град).
Воспользуемся в изобарном процессе подогрева воды первым законом термодинамики, по которому
![]() (11.17)
(11.17)
где u' — внутренняя энергия воды при температуре кипения.
Так как при 0° С u0 = 0, а работа расширения жидкости
![]() (11.18)
(11.18)
практически заметна только при больших значениях давления, то
![]() (11.19)
(11.19)
Энтальпия воды при температуре кипения определяется по общей формуле
![]() (11.20)
(11.20)
Полагая, что
![]() ,
получим
,
получим
![]() (11.21)
(11.21)
В процессе нагревания жидкости от 0° С до температуры кипения происходит увеличение ее энтропии, которое может быть найдено по формуле
![]() (11.22)
(11.22)
при s'0 = 0 и сРв = 4,1865 кДж/(кг·град)
![]() (11.23)
(11.23)
В процессе парообразования жидкость, нагретая до температуры кипения при этой температуре и определенном постоянном давлении, обращается в пар. Количество теплоты, затрачиваемое в процессе при р = const на превращение 1 кг воды при температуре кипения в сухой насыщенный пар той же температуры, обозначим через r.
Теплота r называется скрытой теплотой парообразования. По первому закону термодинамики
![]() (11.24)
(11.24)
где u — внутренняя энергия сухого насыщенного пара;
l" — работа расширения в процессе парообразования.
Разность внутренних энергий u" – u затрачиваемая на работу против внутренних сил, называется внутренней теплотой парообразования и обозначается буквой . Теплота, затрачиваемая на работу против внешних сил, равна
![]() (11.25)
(11.25)
и называется внешней теплотой парообразования. Обозначим ее буквой .
Таким образом,
![]() (11.26)
(11.26)
Вследствие того, что процесс парообразования идет при постоянном давлении,
![]() (11.27)
(11.27)
Величины
r
и i"
даются в
таблицах насыщенного пара, а
![]() -
легко определяются по приведенным выше
формулам.
-
легко определяются по приведенным выше
формулам.
С возрастанием давления, как видно из рисунка 11.7, увеличивается энтальпия жидкости и достигает максимального значения при критическом давлении. Скрытая теплота парообразования уменьшается с ростом давления и равна нулю при критическом давлении (и температуре), потому что в этих условиях различия между жидкостью и ее паром исчезают и процесс парообразования как таковой отсутствует.
Изменение энтропии в процессе парообразования при подведении к кипящей воде r кДж/кг теплоты равно
![]() (11.28)
(11.28)
откуда
![]() (11.29)
(11.29)
или, используя значение s из выражения (11.23),
![]() (11.30)
(11.30)

Рисунок 11.7 – i
- p–диаграмма
воды
При полном испарении жидкости состояние сухого насыщенного пара определяется одним параметром: давлением или температурой. Поэтому объем, внутренняя энергия и энтальпия определяются по таблицам насыщенного пара по давлению или температуре.
Связь между
удельными объемами жидкости и пара на
линии насыщения
и
давлением насыщенного пара рН
температурой
ТН
и скрытой
теплотой парообразования может быть
получена следующим образом. При
превращении жидкости в пар давление
насыщенного пара от объема системы не
зависит,
следовательно, в выражении
![]() ,
но так как равновесное превращение
жидкости в пар происходит при постоянной
температуре (ТН=const),
то
,
но так как равновесное превращение
жидкости в пар происходит при постоянной
температуре (ТН=const),
то
![]() ,
,
где dV представляет изменение объема системы при переходе жидкости в пар. Таким образом,
![]() (11.31)
(11.31)
Изменение объема системы, если испарилась жидкость массой dm, равно
![]() ,
,
а приращение энтропии в квазистатическом процессе испарения жидкости массой dm по (11.28)
![]() .
.
Подставив эти значения в уравнение (11.31), получим
![]() , (11.32)
, (11.32)
где
![]() —
производная от давления по температуре
на кривой фазового равновесия рН
= f
(TН).
—
производная от давления по температуре
на кривой фазового равновесия рН
= f
(TН).
Уравнение (9.32) называют уравнением Клапейрона – Клаузиуса и применяют при исследованиях изменений агрегатного состояния вещества из жидкого состояния в парообразное. Аналогичные уравнения можно применять и к процессам перехода вещества из твердого состояния в жидкое или газообразное.
Параметры влажного насыщенного пара при заданной величине сухости могут быть определены из следующих соотношений.
Удельный объем влажного насыщенного пара
![]() (11.33)
(11.33)
Так
как объем воды (1
— х)
![]() мал
по сравнению с объемом пара, то при
невысоких давлениях
мал
по сравнению с объемом пара, то при
невысоких давлениях
![]() . (11.34)
. (11.34)
Энтальпия влажного насыщенного пара с учетом того, что на превращение в пар х кг жидкости необходимо затратить хr кДж/кг теплоты, равна
![]() . (11.35)
. (11.35)
Энтропия влажного насыщенного пара
![]() . (11.36)
. (11.36)
Свойства перегретого пара резко отличаются от свойств насыщенного пара и приближаются к свойствам газов.
Перегретый пар характеризуется тем, что его температура выше температуры парообразования ТH при том же давлении и удельный объем его больше, чем объем сухого насыщенного пара при том же давлении.
Количество теплоты, необходимое для перевода 1 кг сухого насыщенного пара при р = const в перегретый с температурой t, называют теплотой перегрева qп и определяют по формуле
![]() . (11.37)
. (11.37)
Если срm – средняя массовая теплоемкость перегретого пара при постоянном давлении, то
![]() . (11.38)
. (11.38)
Значение
срm
берется
для перегретого пара по формуле
![]() .
.
Энтальпия перегретого пара
![]() (11.39)
(11.39)
называется полной теплотой перегретого пара. По первому закону термодинамики
![]() , (11.40)
, (11.40)
где
![]() – работа расширения в изобарном процессе
перегрева пара;
– работа расширения в изобарном процессе
перегрева пара;
![]() — изменение
внутренней энергии в процессе перегрева.
— изменение
внутренней энергии в процессе перегрева.
Изменение энтропии в равновесном изобарном процессе перегрева равно
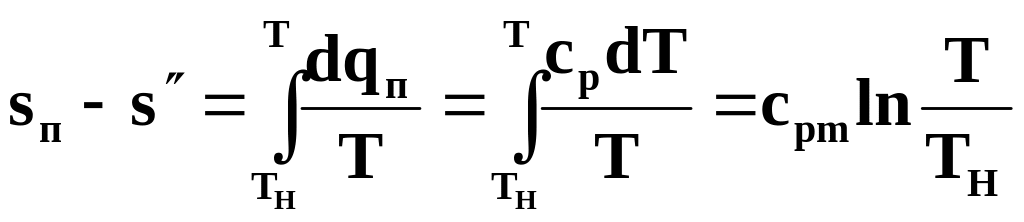 (11.41)
(11.41)
или
![]() . (11.42)
. (11.42)
Свойства перегретых паров будут тем ближе к свойствам идеального газа, чем больше температура перегрева.
11.2.5 Т–s-диаграмма водяного пара
Для
графического изображения процессов,
происходящих в паре, удобно пользоваться
Т–s
- диаграммой, Площадь
под кривой обратимого процесса дает
количество теплоты, сообщаемое телу
или отнимаемое от него.
Точкам р–![]() диаграммы
соответствуют определенные точки, Т–s
диаграммы
(рисунок
11.8).
диаграммы
соответствуют определенные точки, Т–s
диаграммы
(рисунок
11.8).

Рисунок 11.8 –
Т–s-диаграмма
водяного пара
Если было принято условно, что энтропия начального состояния воды s0 = 0, то эта точка лежит на оси ординат на 273° выше абсолютного нуля.
Перенося по точкам нижнюю пограничную кривую (х = 0) из системы р–v в Т–s-диаграмму, получим соответствующую ей кривую, абсциссами которой являются значения s'. Аналогично наносится верхняя пограничная кривая (х=1), абсциссами которой будут значения энтропии сухого насыщенного пара s".
В точке b диаграммы начинается кипение при ТH = const, и энтропия в процессе парообразования повышается
![]() .
.
Процесс парообразования заканчивается в точке с, где
![]() .
.
Так как процесс парообразования идет при Тн = const и р – =const, изотерма b-с является одновременно и изобарой. Дальнейший подвод теплоты снова сопровождается увеличением температуры и энтропии. В процессе перегрева пара (кривая с-е)
![]() .
.
Вследствие того, что площади в Т-s-диаграмме изображают количество подведенной (отведенной) теплоты, то пл. аbАО – теплота в процессе нагрева жидкости от 0° С до температуры кипения; пл. abСВ – теплота, подводимая к воде в процессе парообразования; пл. сеСВ – теплота, затраченная на перегрев пара.
Учитывая,
что количество теплоты в процессе р
=
const
равно разности энтальпий
![]() ,
площадь, ограниченная ординатами, осью
абсцисс и изобарой, проходящей через
точку, определяет энтальпию в данной
точке. Точка пересечения верхней и
нижней пограничных кривых является
критической
точкой
К.
Область,
лежащая между кривыми аК
и
сK,
это область
влажного насыщенного пара.
Область, лежащая правее верхней
пограничной кривой, – область
перегретого пара.
,
площадь, ограниченная ординатами, осью
абсцисс и изобарой, проходящей через
точку, определяет энтальпию в данной
точке. Точка пересечения верхней и
нижней пограничных кривых является
критической
точкой
К.
Область,
лежащая между кривыми аК
и
сK,
это область
влажного насыщенного пара.
Область, лежащая правее верхней
пограничной кривой, – область
перегретого пара.
11.2.6 i–s-диаграмма водяного пара
Для изучения и расчетов различных термодинамических процессов, в которых рабочим телом является насыщенный и перегретый пар, удобна i–s-диаграмма (рисунок 11.9).

Рисунок 11.9 –
i–s-диаграмма
водяного пара
В системе координат
i–s
наносятся
пограничные кривые, изобары и изотермы.
Нижняя пограничная кривая и верхняя
пограничная кривая строятся по известным
значениям
![]() ,
,
![]() ,
,
![]() ,
,
![]() и сливаются в критической точке К.
В области
влажного насыщенного пара наносятся
линии
постоянной сухости
(пунктирные
кривые). В
этой диаграмме теплоты
жидкостей, парообразование и перегрев
изображаются линейными отрезками, а не
площадями.
Теплота парообразования
по данной изобаре
и сливаются в критической точке К.
В области
влажного насыщенного пара наносятся
линии
постоянной сухости
(пунктирные
кривые). В
этой диаграмме теплоты
жидкостей, парообразование и перегрев
изображаются линейными отрезками, а не
площадями.
Теплота парообразования
по данной изобаре
![]()
равна разности ординат точек пересечения изобары с правой и левой пограничными кривыми.
Для процесса парообразования, происходящего при р = const,
![]() , то
есть
, то
есть ![]() .
.
Следовательно, в области влажного насыщенного пара изобары, являясь одновременно и изотермами, представляют собой прямые линии с угловым коэффициентом, равным Tн.
Изобары пересекают пограничные кривые без излома. Изобары и изохоры в области перегрева – слабо вогнутые логарифмические кривые. Изотермы в области перегретого пара – выпуклые кривые, поднимающиеся слева вверх направо. Чем больше температура, тем выше располагается изотерма. Чем дальше от пограничной кривой (х = 1) проходит изотерма, тем больше она приближается к горизонтали i = const, так как в области идеального газа энтальпия однозначно определяется температурой.
На рисунке 11.9 точки A, В, С изображают соответственно состояния влажного, сухого и перегретого пара. Точка А лежит на пересечении изобары (изотермы) и линии постоянной сухости. Точка В лежит на пересечении изобары и верхней пограничной кривой. Точка С находится на пересечении изобары и изотермы. По положению точки, соответствующей некоторому состоянию пара, можно определить на i–s-диаграмме числовые значения всех параметров в этой точке.
