
- •6. Карбонильные соединения. Альдегиды.
- •2. Физические свойства.
- •Можно сделать вывод: карбонильные соединения легко окисляются и восстанавливаются. Спирт ↔ альдегид ↔ карбоновая кислота
- •5.Получение альдегидов и применение альдегидов.
- •Прочитайте текст, найдите ответы на вопросы.
- •Выполните в тетради упражнения.
6. Карбонильные соединения. Альдегиды.
План.
Карбонильные соединения: альдегиды, кетоны. Номенклатура, изомерия.
Строение, физические и химические свойства альдегидов.
Получение, применение альдегидов.
Особенности свойств кетонов.
![]()
1. К карбонильным соединениям относятся соединения, содержащие карбонильную группу (карбонил, окси-группу).
Э![]()
![]()
![]() ти
соединения, в зависимости от связанных
с ней заместителей, делятся на две
основные группы: альдегиды и кетоны.
Альдегиды
содержат карбонильную группу, которая
связана с первичным атомом углерода,
т.е. находится в начале углеродной цепи.
Кетоны
содержат карбонильную группу, которая
связана со вторичным атомом углерода,
т.е. находится в середине углеродной
цепи. Карбоновые
кислоты
кроме карбонильной группы имеют еще и
гидроксогруппу, причем обе функциональные
группы связаны с одним (первичным) атомом
углерода.
ти
соединения, в зависимости от связанных
с ней заместителей, делятся на две
основные группы: альдегиды и кетоны.
Альдегиды
содержат карбонильную группу, которая
связана с первичным атомом углерода,
т.е. находится в начале углеродной цепи.
Кетоны
содержат карбонильную группу, которая
связана со вторичным атомом углерода,
т.е. находится в середине углеродной
цепи. Карбоновые
кислоты
кроме карбонильной группы имеют еще и
гидроксогруппу, причем обе функциональные
группы связаны с одним (первичным) атомом
углерода.
В этой лекции мы рассматриваем альдегиды и кетоны. В зависимости от природы углеродного радикала различают алифатические и ароматические карбонильные соединения, а также предельные и непредельные.
![]()
![]()
![]()


Функциональная группа у альдегидов находится на конце углеродной цепи, у первичного атома углерода. Она является главной функциональной группой (других нет) и счет атомов идет от нее. Карбонильная группа в названии альдегида обозначается добавлением суффикса –аль. Цифра в названии не указывается, ведь это всегда первый атом углерода. Т.е. изомерии функциональной группы для альдегидов нет. Возможна только изомерия углеродного скелета и межклассовая изомерия с кетонами. У кетонов оксо-группа указывается добавлением суффикса –он. Кроме того, надо указать, где находится эта группа. Эта цифра должна быть как можно м еньше.
Н![]()
 апример:
апример:
М![]() етаналь
(формальдегид, муравьиный альдегид)
Этаналь (ацетальдегид, уксусный альдегид)
етаналь
(формальдегид, муравьиный альдегид)
Этаналь (ацетальдегид, уксусный альдегид)
2![]() -метилгексанон-3.
-метилгексанон-3.
Пропаналь (пропионовый альдегид)
Пропанон
Б![]() утаналь
(масляный альдегид)
утаналь
(масляный альдегид)
Метилпропаналь
2. Физические свойства.
Карбонильные
соединения не образуют водородных
связей, поэтому температуры кипения у
них ниже, чем у соответствующих спиртов.
Метаналь – газ, все другие низшие
альдегиды – жидкости, высшие – твердые
вещества. Низшие альдегиды летучи и
имеют характерный запах. Они растворимы
в воде. Водный 40% раствор метаналя
называют формалином. Этаналь летучая
жидкость (температура кипения 210С![]() ),
с неприятным удушливым запахом (в малых
концентрациях он пахнет яблоками).
),
с неприятным удушливым запахом (в малых
концентрациях он пахнет яблоками).
Особенности
строения.  Атом
углерода карбонильной группы находится
в состоянии sp2
гибридизации и образует три
Атом
углерода карбонильной группы находится
в состоянии sp2
гибридизации и образует три
 -связи,
лежащие в одной плоскости под углом
1200
и одну
-связи,
лежащие в одной плоскости под углом
1200
и одну
 -связь с атомом кислорода, за счет
негибридной р-орбитали. Причем связи
между атомами углерода и кислорода
сильно поляризованы. В результате на
атоме углерода образуется частичный
положительный заряд, и он становиться
удобным объектом для атаки нуклеофила.
Эта
атака для альдегидов приводит к реакции
присоединения (АN
).
В зависимости от природы радикала,
связанного с карбонильной группой,
величина заряда на атоме углерода может
быть разной, т.е. альдегиды вступают в
реакцию присоединения с разной
активностью.
-связь с атомом кислорода, за счет
негибридной р-орбитали. Причем связи
между атомами углерода и кислорода
сильно поляризованы. В результате на
атоме углерода образуется частичный
положительный заряд, и он становиться
удобным объектом для атаки нуклеофила.
Эта
атака для альдегидов приводит к реакции
присоединения (АN
).
В зависимости от природы радикала,
связанного с карбонильной группой,
величина заряда на атоме углерода может
быть разной, т.е. альдегиды вступают в
реакцию присоединения с разной
активностью.
Химические свойства.
1)Итак, для альдегидов характерны реакции нуклеофильного присоединения. Такие реакции присоединения протекают для альдегидов с разными веществами.
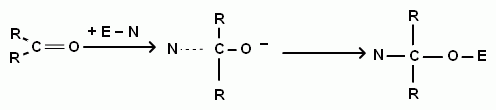
Например, к реакциям присоединения (АN) относится реакция гидрирования (т.е. присоединения водорода). Эту реакцию можно рассматривать как реакцию восстановления альдегидов.
![]()
+ H2 → CH3-CH2-OH
Очень важной является реакция присоединения спиртов к альдегидам. При этом образуются полуацетали, а потом они при взаимодействии со спиртами превращаются в ацетали (но это уже реакция нуклеофильного замещения).
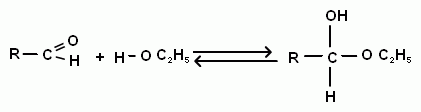
2) Характерной для альдегидов является реакция окисления. Альдегиды - это вообще один из наиболее легко окисляющихся классов органических соединений. При этом обычно образуются соответствующие карбоновые кислоты. А окисление в жестких условиях или очень сильным окислителем приведет к образованию углекислого газа.
Полное окисление:
+ О2 → СО2 + Н2О
Реакция «серебряного зеркала» (р. Толленса) – с аммиачным раствором нитрата серебра (обычно вместо формулы комплексного соединения серебра в уравнении пишут формулу оксида серебра). Образуется соответствующая карбоновая кислота и свободное серебро, которое выделяется в виде черного осадка или блестящей (зеркальной) пленки на поверхности сосуда.
![]()
+ Ag2O → + Ag↓
Реакция «медного зеркала» (р. Фелинга) – реакция окисления альдегидов комплексным соединением меди (II) (обычно вместо формулы комплексного соединения меди в уравнении пишут формулу гидроксида меди (II). Образуется соответствующая карбоновая кислота и оксид меди (I) оранжевого цвета. Эти реакции окисления (с оксидом серебра и с гидроксидом меди) используют как качественные на альдегиды. Можно использовать как качественную реакцию на альдегиды и реакцию с фуксинсернистой кислотой. В этом случае мы наблюдаем изменение окраски раствора в характерный розовый цвет.
+ Cu(OH)2↓ → + CuOH↓
Cu(OH)↓ → Cu2O↓ + H2O
