
- •Факультет «экологической и информационной безопасности»
- •Утверждаю:
- •Учебное пособие
- •Общие методические указания
- •Список литературы Основная
- •Дополнительная
- •Введение. Предмет, задачи аналитической химии. Методы анализа.
- •Ошибки при количественном анализе.
- •Чувствительность, правильность и точность анализа.
- •2.2 Равновесия в водных растворах кислот и оснований
- •2.3. Автопротолиз воды
- •2.4. Расчёт рН
- •3.2. Условия образования и растворения осадков
- •4.Рановесия в растворах комплексных соединений
- •4.1. Основные понятия
- •4.2. Устойчивость комплексов
- •Вариант 1.
- •Вариант 2.
- •Вариант 3.
- •Вариант 4.
- •Вариант 5.
- •Вариант 6.
- •Вариант 7.
- •Вариант 8.
- •Вариант 9.
- •Вариант 10.
- •7.2. Электрохимические методы анализа
- •7.2.А. Потенциометрический анализ
- •7.2.Б. Потенциометрическое титрование
- •Вариант 1.
- •Вариант 2.
- •Вариант 3.
- •Вариант 4.
- •Вариант 5.
- •Вариант 6.
- •Вариант 7.
- •Вариант 8.
- •Вариант 9.
- •Вариант 10.
- •Примерный перечень вопросов к экзамену по курсу «Аналитическая химия и физико-химические методы анализа»
2.2 Равновесия в водных растворах кислот и оснований
В соответствии с протолитической теорией кислоты – это частицы, способные в растворе отдавать протоны, а основания – частицы, способные принимать протоны. При этом кислота образует сопряжённое с ней основание, а основание образует сопряжённую с ним кислоту. Кислота и сопряжённое с нею основание, так же как основание и сопряжённая с ним кислота, составляют кислотно-основную (протолитическую) пару. Примеры протолитических пар:
Кислота Основание
HCl ↔ H+ + Cl-
CH3COOH ↔ H+ + CH3COO-
H2CO3
↔ H+
+ HCO![]()
H3O+ ↔ H+ + H2O
NH![]() ↔ H+
+ NH3
↔ H+
+ NH3
HCO![]() ↔ H+
+ CO
↔ H+
+ CO![]()
Из приведённых примеров следует, что кислоты могут быть молекулярными (HCl, CH3COOH, H2CO3), катионными (H3O+, NH ) и анионными (HCO ). Аналогично и основания делятся на молекулярные (NH3), анионные (Cl-, CH3COO-, HCO ) и катионные (СаОН+).
Протолиты, обладающие как протонодонорными, так и протоноакцепторными свойствами, называют амфипротонными (H2O, HCO ).
2.3. Автопротолиз воды
Поведение кислот и оснований в растворе зависит от свойств растворителя. В водных растворах следует учитывать амфотерный характер воды, который можно проиллюстрировать с помощью реакции автопротолиза:
H2O + H2O ↔ H3O+ + ОН-
К=
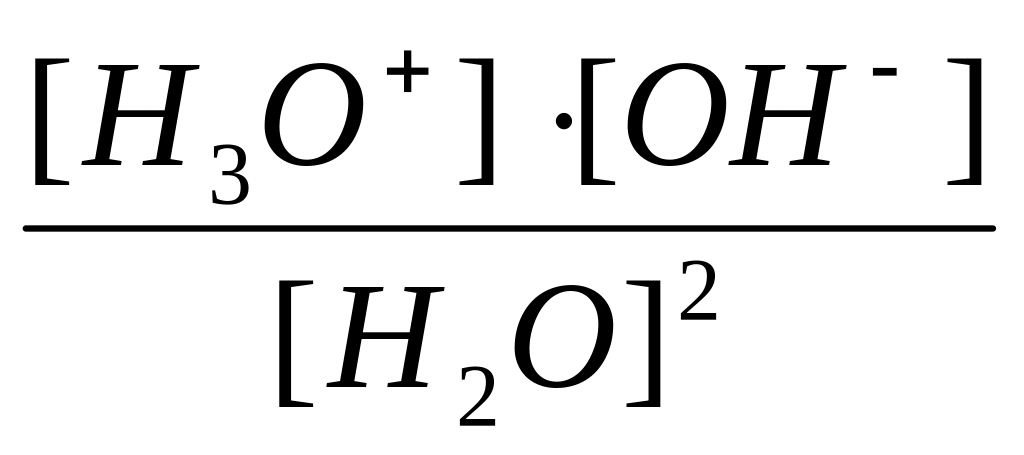 (12).
(12).
Так как концентрация воды в разбавленных водных растворах велика и мало изменяется по сравнению с концентрацией растворённых веществ, её можно считать постоянной величиной и записать
К·[H2O]2 = [H3O+]·[ОН-]= Kw (13),
где Kw – константа автопротолиза воды (ионное произведение воды).
Численное значение константы автопротолиза воды при 25ºС равно Kw ≈ 1·10-14. для упрощения вычислений ионное произведение воды записывают в виде
Kw = [H+]·[ ОН-] = 10-14 (14)
В чистой воде [H+] = [ ОН-] = 10-7 моль/дм3.
Для характеристики кислотности раствора пользуются десятичными логарифмами концентрации растворов H+ и ОН-, взятыми с отрицательным знаком; эти величины называют соответственно водородным и гидроксильным показателями:
рН= -lg[H+]; pOH= -lg[ОН-] (15)
Из уравнения (15) следует, что для воды и водных растворов выполняется равенство:
рН + рОН = 14 (16)
Уравнение (16) есть не что иное, как выражение ионного произведения воды, записанного в логарифмическом виде.
2.4. Расчёт рН
1. Раствор сильной кислоты НА. Сильные кислоты практически полностью диссоциированы в растворе на ионы, поэтому
[H+]=СНА (17), рН = -lg СНА (18)
Таким образом можно рассчитывать рН растворов кислот с концентрацией С ≥ 10-4М, когда концентрацией протонов, образующихся при диссоциации воды, можно пренебречь. При меньшей концентрации кислоты диссоциацию воды следует учитывать.
2.Раствор сильного основания МОН. Основание в растворе диссоциировано нацело, поэтому концентрация лиат-иона равна исходной концентрации основания. В водных растворах, в частности, ионом лиата является гидроксид-ион и, соответственно, мы можем записать:
[ОН-] = СМОН (19) и рОН=-lg СМОН (20) или рН =14 – рОН (21)
Пример 2. Вычислить рН 0,01М раствора азотной кислоты.
Решение. HNO3 – сильная кислота, т.е.
[H+]=СНNO3=0,01 моль/дм3; рН= -lg0,01= 2
3. Раствор слабой кислоты НА. В упрощённом виде диссоциацию кислоты можно представить в следующем виде:
НА↔ H+ + А-
Равновесие в растворе слабой кислоты описывают с помощью константы диссоциации КНА:
КНА=
![]() .
.
Как видно, [H+]=[A-]; кроме того, если степень диссоциации α мала (<5%),можно допустить, что [HA]= CHA.. Отсюда следует
[H+]=
![]() (22)
(22)
рН=-lg![]() (23)
(23)
4. Раствор слабого основания. Диссоциацию слабого основания в водном растворе в упрощённом виде можно представить так:
МОН↔М+ + ОН-
Константу равновесия данного процесса выражаем следующим образом:
КМОН=
![]() .
.
Поскольку [M+]=[OH-] и если степень диссоциации мала (α < 5%), то [MOH]=CMOH, отсюда
[OH-]=
![]() =α·СMOH
(24) и
=α·СMOH
(24) и
[H+]
=
![]() (25)
(25)
рН= 14 + lg (26)
pH= 14 + lg(α·СMOH) (27)
Пример 3. Вычислить концентрацию ионов водорода [H+] и рН 0,5М раствора пропионовой кислоты С2Н5СООН; КС2Н5СООН= 1,4·10-5.
Решение. Так как КС2Н5СООН <10-4, то для вычисления [H+] и рН используем выражения (22) и (23):
[H+]=
![]() моль/дм3;
моль/дм3;
рН= -lg(2,6·10-3)= 2,58
Вариант 1.
2. Вычислить рН раствора NaOH с массовой долей 0,2%.
3. Вычислите рН 0,1М раствора азотистой кислоты; К= 6,9·10-4.
Вариант 2.
2.Вычислите рН раствора КОН с массовой долей 0,19%.
3. Вычислите рН 0,2М раствора синильной кислоты; К=5·10-10.
Вариант 3.
2. Вычислите рН раствора хлороводородной кислоты с массовой долей 0,36%.
3. Вычислите рН 0,01М раствора муравьиной кислоты; К= 1,8·10-4.
Вариант 4.
2. Вычислите рН раствора азотной кислоты с массовой долей 0,32%
3. Вычислите рН 0,02М раствора уксусной кислоты; К= 1,74·10-5.
Вариант 5.
2. Вычислите рН раствора серной кислоты с массовой долей 0,4%.
3. Вычислите рН 0,5М раствора гидроксида аммония; К= 1,76·10-5.
Вариант 6.
2. Вычислите рН раствора гидроксида натрия с плотностью ρ=1,002.
3. Вычислите рН 0,2М раствора иодноватистой кислоты; К= 2,3·10-11.
Вариант 7.
2. Вычислите рН раствора гидроксида калия с плотностью ρ=1,004.
3. Вычислите рН 0,1М раствора фенола; К= 1·10-10
Вариант 8.
2. Вычислите рН раствора хлороводородной кислоты с плотностью ρ=1,000.
3. Вычислите рН 0,1М раствора гидроксиламина; К= 8,9·10-9
Вариант 9.
2. Вычислите рН раствора азотной кислоты с плотностью ρ=1,003.
3. Вычислите рН 0,1М раствора хлорноватистой кислоты; К= 2,95·10-8
Вариант 10.
2. Вычислите рН раствора серной кислоты с плотностью ρ=1,005.
3. Вычислите рН 0,1М раствора цианововой кислоты; К= 2,7·10-4
2.5. Буферные растворы
Часто
для успешного проведения реакции
необходимо не только создать нужное
значение рН реакционной среды, но и
поддерживать его постоянным в течение
реакции. Для этого применяют так
называемые буферные растворы,
представляющие собой смеси слабой
кислоты или её соли, слабого основания
и его соли, либо смесями солей многоосновных
кислот разной степени замещения, т.е.
смеси компонентов протолитической пары
слабых протолитов. Наиболее часто
используется в анализе ацетатный буфер
(водный раствор уксусной кислоты СН3СООН
и ацетата натрия СН3СООNa,
т.е.пара СН3СООН и СН3СОО-)
и аммиачный буфер (водный раствор аммиака
и хлорида аммония, т.е.пара NH3
и NH3+). Можно
привести ещё несколько примеров буферных
растворов: NaHCO3 +
Na2CO3
(карбонатный), KH2PO4
+ K2HPO4
(фосфатный); в этих случаях роль слабых
кислот выполняют ионы НСО
и Н2РО![]() ,
а сопряжённых оснований– соответственно
СО
и НРО
,
а сопряжённых оснований– соответственно
СО
и НРО![]() -
ионы.
-
ионы.
При добавлении небольших количеств мильной кислоты (основания) или при разбавлении ( в несколько раз) рН таких растворов практически не меняется. Буферной емкостью называется количество молей сильной кислоты или основания, изменяющего рН буферного раствора на единицу.
В смеси слабой кислоты НА и сопряжённого основания А- устанавливаются равновесия:
НА↔ Н+ + А-; А- + Н+ ↔ НА.
Для кислоты можно записать:
КНА= ,
откуда
![]() .
.
Поскольку
[HA]=CHA
и [A![]() ]=
CA, то
]=
CA, то
[H+]=KHA·![]()
и расчёт рН выполняется по формуле:
рН=
рКНА + lg![]() (28),
(28),
где рКНА= - lgКНА.
Для смеси слабого основания и сопряжённой кислоты аналогично вычисляют рОН, а затем рН буферного раствора. В математическом виде их выражают формулы:
рОН=
рКМОН - lg![]() (29)
(29)
pH = 14-pKMOH + lg (30),
где рКМОН= - lgКМОН.
Пример 4. Вычислить рН смеси уксусной кислоты и ацетата натрия, содержащей указанные компоненты в соотношении 1: 1,6.
Решение. рН ацетатной буферной смеси вычисляем, пользуясь уравнением (28):
рН=рКСН3СООН
+ lg![]() ;
;
рН= 4,8 + lg1,6 = 5
Вариант 1.
4. Вычислить рН буферной смеси, приготовленной сливанием равных объёмов растворов 0,1М СН3СООН и 0,1М NaCH3COO.
Вариант 2.
4. Вычислить рН буферной смеси, приготовленной сливанием равных объёмов растворов 0,1М СН3СООН и 0,01М NaCH3COO.
Вариант 3.
4. Вычислить рН буферной смеси, приготовленной сливанием равных объёмов растворов 0,001М СН3СООН и 0,1М NaCH3COO.
Вариант 4.
4. Вычислить рН буферной смеси, приготовленной сливанием равных объёмов растворов 0,1М NH3∙H2O и 0,1M NH4Cl,
Вариант 5.
4. Вычислить рН буферной смеси, приготовленной сливанием равных объёмов растворов 0,2М NH3∙H2O и 0,02M NH4Cl.
Вариант 6.
4. Вычислить рН буферной смеси, приготовленной сливанием равных объёмов растворов 0,2М NH3∙H2O и 0,2M NH4Cl.
Вариант 7.
4. На сколько единиц увеличится или уменьшится рН формиатной буферной смеси (НСООН + НСООNa) при увеличении концентрации соли в 100 раз?
Вариант 8.
4. На сколько единиц увеличится или уменьшится рН формиатной буферной смеси (НСООН + НСООNa) при уменьшении концентрации соли в 10 раз?
Вариант 9.
4. На сколько единиц увеличится или уменьшится рН аммонийной буферной смеси (NH3∙H2O + NH4Cl ) при увеличении концентрации соли NH4Cl в 10 раз?
Вариант 10.
4. На сколько единиц увеличится или уменьшится рН аммонийной буферной смеси (NH3∙H2O + NH4Cl ) при уменьшении концентрации NH3∙H2O в 10 раз?
3. ГЕТЕРОГЕННЫЕ РАВНОВЕСИЯ В ИОННЫХ СИСТЕМАХ
3.1.Растворимость и произведение растворимости
Явление осаждения широко используется в аналитической практике для удаления из растворов соответствующих катионов или анионов. Часто возникает и обратная задача – перевести в раствор ион, находящийся в виде нерастворимой соли. В общих случаях существует равновесие между твёрдым веществом и находящимися в растворе ионами, образующее это вещество. Равновесия, связанные с осаждением и образованием осадков, являются обратимыми, подчиняются закону действия масс и характеризуются постоянной величиной, называемой произведением растворимости (ПР). Соответствующее равновесие можно представить в виде:
МеmAn ↔ mMen+ + nAm-,
а константу равновесия, с учетом того, что активность электролита в осадке при данной температуре постоянна, - в виде
ПР
МеmAn= a![]() ∙a
∙a![]() (31).
(31).
В растворах малорастворимых веществ концентрации ионов очень низки. Если в растворе отсутствуют другие ионы, то концентрации мало отличаются от активностей ионов. Поэтому для приближённых расчётов вместо активностей можно использовать их молярные концентрации:
ПРМеmAn= [Men+]∙[Am-]n (32).
