
- •Изоферменты.
- •Обезвреживание аммиака в печени. Орнитиновый цикл.
- •В моей контрольной. Секреторн, не секротр
- •Декарбаксилирование а/к.
- •Ферменты. Хим природа. Активный центр. Апо и кое и кофактор. Химическая природа. Примеры.
- •Дезаминирование а)к.
- •1.Прямое окислительное дезаминирование.
- •Непрямое дезаминирование (трансдезаминирование).
- •Метаболизм глюкозо-6-фосфота в клетке. Характеристика глюкокиназ и гексокиназ.
- •Стероидные гормоны. Классификация. Стероидогенез.
- •10. Витамин а.
- •11. Обезвреживание аммиака в тканях. Значение обезвреживания аммиака в почках в условиях ацидоза.
- •12. Свойства ферментов: каталитическая активность, регулируемость, специфичность, взаимосвязь. Виды специфичности.
- •13. Пентозофосфатный путь превращения глюкозы.
- •14. Трансаминирование. Значение. Алт и аст в сыворотке.
- •15. Белки плазмы крови.
- •20. Образование желчных кислот. Биороль.
- •21. Витамин в6
- •22. Окисление вжк.Транспорт вжк в митохондриях. В-окисление вжк. Значение.
- •23. Цикл трикарбоновых кислот
- •24. Обмен метионина. Образование sam ( в тетради). Применение в медицине.
- •25. Синтез гликогена.
- •26. Гниение белков в кишечнике. В моей контрольной.
- •27. Способы регуляции метаболических процессов в клетке.
- •28. Переваривание углеводов.
- •29. Трансмембранный перенос глюкозы в клетку.
- •30. Механизмы передачи гормональных сигналов в клетки через мембр рецепторы. У меня в контрольной
- •31. Переваривание липидов.
14. Трансаминирование. Значение. Алт и аст в сыворотке.
Трансаминирование (переаминирование) – межмолекулярный перенос аминогруппы с a-аминокислоты на a-кетокислоту без промежуточного образования аммиака.
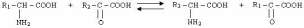
Впервые реакции трансаминирования были открыты в 1937 г. при изучении дезаминирования глутаминовой кислоты в мышечной ткани. Было замечено, что при добавлении к гомогенату мышц АЛА и a- кетоглутаровой кислоты приводило к образованию соответственно ПВК и глутаминовой кислот.
Реакции трансаминирования являются обратимыми и универсальными для всех живых организмом, протекают при участии специфических ферментов аминотрансфераз (трансаминаз). Наиболее распространенными из них являются:
- глутаматаминотрансфераза (переносит аминогруппу с любой аминокислоты на a-кетоглутаровую кислоту, которая при этом превращается в глутаминовую);
- аспартатаминотрансфераза (переносит аминогруппу с любой аминокислоты на ЩУК с образованием аспарагиновой кислоты);
- аланинаминотрансфераза (переносит аминогруппу с любой аминокислоты на ПВК с образованием аланина).
Все аминотрансферазы в качестве кофермента содержат пиридоксальфосфат (производное витамина В6).
Каждая аминотрансфераза специфична к определенным парам a-амино- и a-кетокислот. В организме человека имеется более десятка аминотрансфераз.
Замещение кетогруппы в a-кетокислоте на аминогруппу представляет собой конечную стадию синтеза аминокислоты. Наоборот, замещение NН2-группы в аминокислоте на кетогруппу − первая стадия катаболизма аминокислот. Следовательно, трансаминирование может служить как для синтеза, так и для катаболизма аминокислот.
Аминотрансферазы содержатся практически во всех органах, но наиболее активно реакции трансаминирования протекают в печени.
Функциональное значение трансаминирования в разных органах различно. Например, работающая мышца выделяет в кровь наряду с молочной кислотой значительные количества количества аланина. АЛА образуется в мышце из ПВК путем трансаминирования. Из кровотока АЛА поглощается печенью, где в результате трансаминирования вновь превращается в ПВК, а ПВК используется для глюконеогенеаза (глюкозо-аланиновый цикл). В результате реакций трансаминирования общее количество аминокислот аминокислот в организме не изменяется, т.к. в каждой реакции одна аминокислота превращается в безазотистый остаток (в a-кетокислоту), а один безазотистый остаток – в новую аминокислоту. Напротив, дезаминирование ведет к уменьшению общего количества аминокислот, т.к. NН2-группа не используется для образования новой аминокислоты, а превращается в NН3.
Клиническое значение определения активности трансаминаз. Широкое распространение и высокая активность трансаминаз в органах и тканях человека, а также сравнительно низкие величины активности этих ферментов в крови послужили основанием для определения уровня ряда трансаминаз в сыворотке крови человека при органических и функциональных поражениях разных органов. Для клинических целей наибольшее значение имеют две трансаминазы - аспартат-аминотрансфераза (AcAT) и аланин-аминотрансфераза (АлАТ).
В сыворотке крови здоровых людей активность этих трансаминаз в тысячи раз ниже, чем в паренхиматозных органах. Поэтому органические поражения при острых и хронических заболеваниях, сопровождающиеся дектрукцией клеток, приводят к выходу трансаминаз из очага поражения в кровь. Так, уже через 3-5 ч после развития инфаркта миокарда уровень AcAT в сыворотке крови резко повышается (в 20-30 раз). Максимум активности обеих трансаминаз крови приходится на конец первых суток, уже через 2-3 дня при благоприятном исходе болезни уровень сыроточных трансаминаз возвращается к норме. Напротив, при затяжном процессе или наступлении повторного инфаркта миокарда наблюдается новый пик повышения активности этих ферментов в крови. Этим объясняется тот факт, что в клинике трансаминазный тест используется не только для постановки диагноза, но и для прогноза и проверки эффективности лечения.
Повышение уровня трансаминаз в сыворотке крови отмечено, кроме того, при некоторых заболеваниях мышц, в частности при обширных травмах, гангрене конечностей и прогрессивной мышечной дистрофии. поражениях клеток печени, например при гепатитах.
