
- •Изоферменты.
- •Обезвреживание аммиака в печени. Орнитиновый цикл.
- •В моей контрольной. Секреторн, не секротр
- •Декарбаксилирование а/к.
- •Ферменты. Хим природа. Активный центр. Апо и кое и кофактор. Химическая природа. Примеры.
- •Дезаминирование а)к.
- •1.Прямое окислительное дезаминирование.
- •Непрямое дезаминирование (трансдезаминирование).
- •Метаболизм глюкозо-6-фосфота в клетке. Характеристика глюкокиназ и гексокиназ.
- •Стероидные гормоны. Классификация. Стероидогенез.
- •10. Витамин а.
- •11. Обезвреживание аммиака в тканях. Значение обезвреживания аммиака в почках в условиях ацидоза.
- •12. Свойства ферментов: каталитическая активность, регулируемость, специфичность, взаимосвязь. Виды специфичности.
- •13. Пентозофосфатный путь превращения глюкозы.
- •14. Трансаминирование. Значение. Алт и аст в сыворотке.
- •15. Белки плазмы крови.
- •20. Образование желчных кислот. Биороль.
- •21. Витамин в6
- •22. Окисление вжк.Транспорт вжк в митохондриях. В-окисление вжк. Значение.
- •23. Цикл трикарбоновых кислот
- •24. Обмен метионина. Образование sam ( в тетради). Применение в медицине.
- •25. Синтез гликогена.
- •26. Гниение белков в кишечнике. В моей контрольной.
- •27. Способы регуляции метаболических процессов в клетке.
- •28. Переваривание углеводов.
- •29. Трансмембранный перенос глюкозы в клетку.
- •30. Механизмы передачи гормональных сигналов в клетки через мембр рецепторы. У меня в контрольной
- •31. Переваривание липидов.
Дезаминирование а)к.
Дезаминирование аминокислот – реакция отщепления α- аминокислоты, в результате чего образуется соответствующая α-кетокислота (безазотистый остаток) и выделяется молекула аммиака.
Существует несколько типов дезаминирования аминокислот:
Окислительное;
Непрямое (трансдезаминирование);
Неокислительное;
Внутримолекулярное.
1.Прямое окислительное дезаминирование.
Этот путь дезаминирования преобладает в мышцах при интенсивной работе, в результате которой накапливается молочная кислота. Выделяющийся аммиак предотвращает закисление среды в клетках, вызванное образованием лактата.
1). Анаэробное прямое окислительное дезаминирование существует только для глутаминовой кислоты, катализируется только глутаматдегидрогеназой, превращает глутамат в α-кетоглутарат. Этот тип дезаминирования теснейшим образом связан с трансаминированием аминокислот и формирует с ним процесс трансдезаминирования.
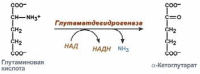
Реакция прямого окислительного дезаминирования глутаминовой кислоты.
Окислительное дезаминирование глутамата – обратимая реакция и при повышении концентрации аммиака в клетке может протекать в боратном направлении, как восстановительное аминирование α-кетоглутарата.
Глутаматдегидрогенназа очень активна в митохондриях клеток практически всех органов кроме мышц. Этот фермент – олигомер, состоящий из 6 субъединиц (молекулярная масса 312 кД). Глутаматдегидрогеназа играет важную роль, так как являктся регуляторным ферментом аминокислотного обмена. Аллостерические ингибиторы глутаматдегидрогеназы (АТФ, ГТФ, NADH) вызывают диссоциацию фермента и потерю глутаматдегидрогеназой активности. Высокие концентрации АДФ активируют фермент. Таким образом низкий энергитический уровень в клетках стимулирует разрушение аминокислот и образование α-кетоглутарата, поступающего в ЦТК как энергетический субстрат. Глутаматдегидрогеназа может индуцироваться стероидными гормонами (кортизолом).
2).Аэробное прямое окислительное дезаминирование катализируется оксидазами D– аминокислот (D–оксидазы) в качестве кофермента использующими ФАД, и оксидазами L-аминокислот (L-оксидазы) с коферментом ФМН. В организме человека эти ферменты присутствуют, но практически не активны.

Реакция, катализируемая оксидазами D- и L- аминокислот
Оксидаза L-аминокислот
В печени и почках обнаружен фермент оксидаза L-аминокислот, способный дезаминировать некоторые L-аминокислоты. (схема 2)

Коферментом в данной реакции выступает FMN. Однако вклад оксидазы L-аминокислот в дезаминирование, очевидно, незначителен, так как оптимум её действия лежит в щелочной среде (рН 10,0). В клетках, где рН среды близок к нейтральному, активность фермента очень низка.
Оксидаза D- аминокислот обнаружена в почках и печени. Это FAD- зависимый фермент. Оптимум рН оксидазы лежит в нейтральной среде, поэтому фермент более активен, чем оксидаза L-аминокислот. Роль оксидазы D- аминокислот способствует их превращению в соответствующие L- изомеры. (рисунок 2)
Непрямое дезаминирование (трансдезаминирование).
Большинство аминокислот не способно дезаминироваться в одну стадию, подобно Глу. Аминогруппы таких аминокислот в результате трансаминирования переносятся на α-кетоглутарат с образованием глутаминовой кислоты, которая затем подвергается прямому окислительлному дезаминированию. Такой механизм дезаминирования аминокислот в 2 стадии получил название трансдезаминирования, или непрямого дезаминирования:
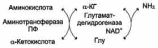
Первая стадия заключается в обратимом переносе NH2 – группы с аминокислот на кетокислоту с образованием новой кетокислоты – этот перенос называется трансаминирование и его механизм сложен. В качестве кетокислоты – акцептора («кетокислота 2») в организме обычно используется α-кетоглутаровая кислота, которая превращается в глутамат («аминокислота 2»).
В результате трансаминирования свободные аминокислоты теряют α- NH2 – группы и превращаются в соответствующие кетокислоты. Далее их кетоскелет катаболизируется специфическими путями и вовлекается в цикл трикарбоновых кислот и тканевое дыхание, где сгорает до CO2 и H 2O. При необходимости (например, голодание) углеродный скелет глюкогенных аминокислот может использоваться для синтеза глюкозы в глюконеогенезе.
Вторая стадия состоит в отщЕплении аминогруппы от аминокислоты 2 – дезаминирование. В организме человека дезаминирование подвергается только глутаминивая кислота. Вторая стадия осуществляется глутаматдегилрогеназой, которая имеется в митохондриях всех клеток, кроме мышечных. Учитывая тесную связь обоих этапов, непрямое окислительное дезаминирование называют трансдезаминированием.
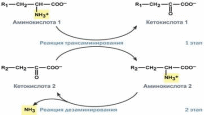
Схема обоих этапов трансдезаминирования.
Непрямое дезаминирование аминокислот происходит при участии 2 ферментов: аминотрансферазы (кофермент ПФ) и глутаматдегидрогеназы (кофермент NAD+).
Значение этих реакций в обмене аминокислот очень велико, так как непрямое дезаминирование – основной способ дезаминирования большинства аминокислот.
Обе стадии непрямого дезаминирования обратимы (рис. 3), что обеспечивает как катаболизм аминокислот (рис. 3, А), так и возможность образования практически любой аминокислоты из соответствующей α-кетокислоты (рис. 3, Б).
В мышечной ткани активность глутаматдегидрогеназы низка, поэтому в этих клетках при интенсивной физической нагрузке функционирует ещё один путь непрямого дезаминирования с участием цикла ИМФ-АМФ. Вначале происходит перенос аминогруппы аминокислот на аспартат, затем на инозиновую кислоту (ИМФ) и в завершение - дезаминирование АМФ. Представленная схема отражает последовательность реакций непрямого неокислительного дезаминирования:

Можно выделить 4 стадии процесса:
трансаминирование с α-кетоглутаратом, образование глутамата;
трансаминирование глутамата с оксалоацета-том (фермент ACT), образование аспартата;
реакция переноса аминогруппы от аспартата на ИМФ (инозинмонофосфат), образование АМФ и фумарата;
гидролитическое дезаминирование АМФ.
Перенос аминогруппы от аспартата и синтез АМФ происходят следующим образом (см. схему А на рис. 3).
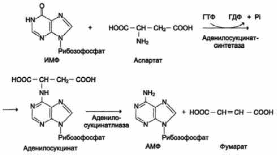
Схема А
Реакция дезаминирования адениловой кислоты происходит под действием фермента АМФ дезаминазы (см. схему Б на рис. 3).

Схема Б
Рис. 3. Биологическая роль непрямого дезаминирования. А - при катаболизме почти все природные аминокислоты сначала передают аминогруппу на а-кетоглутарат в реакции трансаминирования с образованием глутамата и соответствующей кетокислоты. Затем глутамат подвергается прямому окислительному дезаминированию под действием глутаматдегидрогеназы, в результате чего получаются а-кетоглутарат и аммиак;
Б - при необходимости синтеза аминокислот и наличии необходимых а-кетокислот обе стадии непрямого дезаминирования протекают в обратном направлении. В результате восстановительного аминирования а-кетоглутарата образуется глутамат, который вступает в трансаминирование с соответствующей а-кетокислотой, что приводит к синтезу новой аминокислоты.
Этот путь дезаминирования преобладает в мышцах при интенсивной работе, в результате которой накапливается молочная кислота. Выделяющийся аммиак предотвращает закисление среды в клетках, вызванное образованием лактата.
