
- •Изоферменты.
- •Обезвреживание аммиака в печени. Орнитиновый цикл.
- •В моей контрольной. Секреторн, не секротр
- •Декарбаксилирование а/к.
- •Ферменты. Хим природа. Активный центр. Апо и кое и кофактор. Химическая природа. Примеры.
- •Дезаминирование а)к.
- •1.Прямое окислительное дезаминирование.
- •Непрямое дезаминирование (трансдезаминирование).
- •Метаболизм глюкозо-6-фосфота в клетке. Характеристика глюкокиназ и гексокиназ.
- •Стероидные гормоны. Классификация. Стероидогенез.
- •10. Витамин а.
- •11. Обезвреживание аммиака в тканях. Значение обезвреживания аммиака в почках в условиях ацидоза.
- •12. Свойства ферментов: каталитическая активность, регулируемость, специфичность, взаимосвязь. Виды специфичности.
- •13. Пентозофосфатный путь превращения глюкозы.
- •14. Трансаминирование. Значение. Алт и аст в сыворотке.
- •15. Белки плазмы крови.
- •20. Образование желчных кислот. Биороль.
- •21. Витамин в6
- •22. Окисление вжк.Транспорт вжк в митохондриях. В-окисление вжк. Значение.
- •23. Цикл трикарбоновых кислот
- •24. Обмен метионина. Образование sam ( в тетради). Применение в медицине.
- •25. Синтез гликогена.
- •26. Гниение белков в кишечнике. В моей контрольной.
- •27. Способы регуляции метаболических процессов в клетке.
- •28. Переваривание углеводов.
- •29. Трансмембранный перенос глюкозы в клетку.
- •30. Механизмы передачи гормональных сигналов в клетки через мембр рецепторы. У меня в контрольной
- •31. Переваривание липидов.
22. Окисление вжк.Транспорт вжк в митохондриях. В-окисление вжк. Значение.
Установлено, что окисление жирных кислот протекает в печени, почках, скелетных и сердечной мышцах, в жировой ткани. В мозговой ткани скорость окисления жирных кислот весьма незначительна; основным источником энергии в мозговой ткани служит глюкоза.
Жирные кислоты, входящие в состав естественных жиров животных и растений, имеют четное число углеродныхатомов. Любая такая кислота, от которой отщепляется по паре углеродных атомов, в конце концов проходит через стадию масляной кислоты. После очередного β-окисления масляная кислота становится ацетоуксусной. Последняя затем гидроли-зуется до двух молекул уксусной кислоты. Теория β-окисления жирных кислот, предложенная Ф. Кноопом, в значительной мере послужила основой современных представлений о механизме окисления жирных кислот.
Доставка жирных кислот к месту их окисления – к митохондриям – происходит сложным путем: при участииальбумина осуществляется транспорт жирной кислоты в клетку; при участии специальных белков (fatty acid binding proteins, FABP) – транспорт в пределах цитозоля; при участии карнитина – транспорт жирной кислоты из цитозоля вмитохондрии.
Процесс окисления жирных кислот складывается из следующих основных этапов.
Активация жирных кислот. Свободная жирная кислота независимо от длины углеводородной цепи является метаболически инертной и не может подвергаться никаким биохимическим превращениям, в том числе окислению, пока не будет активирована. Активация жирной кислоты протекает на наружной поверхности мембраны митохондрийпри участии АТФ, коэнзима A (HS-KoA) и ионов Mg2+. Реакция катализируется ферментом ацил-КоА-синтетазой:
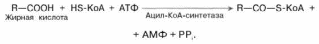
В результате реакции образуется ацил-КоА, являющийся активной формой жирной кислоты.
Считают, что активация жирной кислоты протекает в 2 этапа. Сначала жирная кислота реагирует с АТФ с образованием ациладенилата, представляющим собой эфир жирной кислоты и АМФ. Далее сульфгидрильная группа КоА действует на прочно связанный с ферментом ациладенилат с образованием ацил-КоА и АМФ.
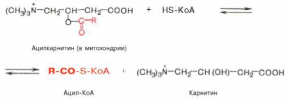
Транспорт жирных кислот внутрь митохондрий. Коэнзимная форма жирной кислоты, в равной мере как и свободныежирные кислоты, не обладает способностью проникать внутрь митохондрий, где, собственно, и протекает ихокисление. Переносчиком активированных жирных кислот
с длинной цепью через внутреннюю митохондриальную мембрану служит карнитин. Ацильная группа переносится сатома серы КоА на гидроксильную группу карнитина с образованием ацилкарнитина, который диффундирует через внутреннюю митохондриальную мембрану:

Реакция протекает при участии специфического цитоплазматического фермента карнитин-ацилтрансферазы. Уже на той стороне мембраны, которая обращена к матриксу, ацильная группа переносится обратно на КоА, что термодинамически выгодно, поскольку О-ацильная связь в кар-нитине обладает высоким потенциалом переноса группы. Иными словами, после прохождения ацилкарнитина через мембрану митохондрий происходит обратнаяреакция – расщепление ацилкарнитина при участии HS-KoA и митохондриальной карнитин-ацилтрансферазы:
Внутримитохондриальное окисление жирных кислот. Процесс окисления жирной кислоты в митохондриях клеткивключает несколько последовательных энзиматических реакций.
Первая стадия дегидрирования. Ацил-КоА в митохондриях прежде всего подвергается ферментативномудегидрированию, при этом ацил-КоА теряет 2 атома водорода в α- и β-положениях, превращаясь в КоА-эфир ненасыщенной кислоты. Таким образом, первой реакцией в каждом цикле распада ацил-КоА является его окислениеацил-КоА-де-гидрогеназой, приводящее к образованию еноил-КоА с двойной связью между С-2 и С-3:

Существует несколько ФАД-содержащих ацил-КоА-дегидрогеназ, каждая из которых обладает специфичностью по отношению к ацил-КоА с определенной длиной углеродной цепи.
Стадия гидратации. Ненасыщенный ацил-КоА (еноил-КоА) при участии фермента еноил-КоА-гидратазы присоединяет молекулу воды. В результате образуется β-оксиацил-КоА (или 3-гидроксиацил-КоА):
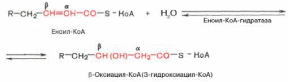
Заметим, что гидратация еноил-КоА стереоспецифична, подобно гидратации фумарата и аконитата (см. с. 348). В результате гидратации транс-Δ2-двойной связи образуется только L-изомер 3-гидроксиацил-КоА.
Вторая стадия дегидрирования. Образовавшийся β-оксиацил-КоА (3-гидроксиацил-КоА) затем дегидрируется. Этуреакцию катализируют НАД+-зависимые дегидрогеназы:

Тиолазная реакция. В ходе предыдущих реакций происходило окисление метиленовой группы при С-3 в оксогруппу. Тиолазная реакция представляет собой расщепление 3-оксоацил-КоА с помощью тиоловой группы второй молекулыКоА. В результате образуется укороченный на два углеродных атома ацил-КоА и двууглеродный фрагмент в виде ацетил-КоА. Данная реакция катализируется ацетил-КоА-ацилтрансферазой (β-ке-тотиолазой):
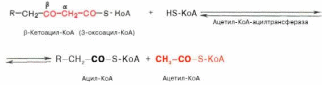
Образовавшийся ацетил-КоА подвергается окислению в цикле трикар-боновых кислот, а ацил-КоА, укоротившийся на два углеродных атома, снова многократно проходит весь путь β-окисления вплоть до образования бутирил-КоА (4-углеродное соединение), который в свою очередь окисляется до 2 молекул ацетил-КоА (рис. 11.2). Например, приокислении пальмитиновой кислоты (С16) повторяется 7 циклов β-окисления.
Баланс энергии. При каждом цикле β-окисления образуются одна молекула ФАДН2 и одна молекула НАДН. Последние в процессе окисления в дыхательной цепи и сопряженного с ним фосфорилирования дают: ФАДН2 – 2молекулы АТФ и НАДН – 3 молекулы АТФ, т.е. в сумме за один цикл образуется 5 молекул АТФ. При окислениипальмитиновой кислоты образуется 5 х 7 = 35 молекул АТФ. В процессе β-окисления пальмитиновой кислотыобразуется 8 молекул ацетил-КоА, каждая из которых, «сгорая» в цикле трикарбоновых кислот, дает 12 молекул АТФ, а 8 молекул ацетил-КоА дадут 12 х 8 = 96 молекул АТФ.
Таким образом, всего при полном β-окислении пальмитиновой кислоты образуется 35 + 96 = 131 молекула АТФ. С учетом одной молекулы АТФ, потраченной в самом начале на образование активной формы пальмитиновой кислоты(пальмитоил-КоА), общий энергетический выход при полном окислении одной молекулы пальмитиновой кислоты в условиях животного организма составит 131 – 1 = 130 молекул АТФ. Изменение свободной энергии ΔF при полном сгорании 1 моля пальмитиновой кислоты составляет 2338 ккал, а богатая энергией фосфатная связь АТФхарактеризуется величиной 7,6 ккал/моль. Нетрудно подсчитать, что примерно 990 ккал (7,6 х 130), или 42% от всей потенциальной энергии пальмитиновой кислоты при ее окислении в организме, используется для ресинтеза АТФ, а оставшаяся часть, очевидно, теряется в виде тепла.
Следовательно, эффективность накопления энергии в результате окисления жирных кислот при стандартных условиях составляет ~ 40%, что близко к соответствующей величине для гликолиза, цикла трикарбоновых кислот иокислительного фосфорилирования.
22. ВИТАМИН К
Витамин К относится к группе липофильных (жирорастворимых) и гидрофобных витаминов, необходимых для синтеза белков, обеспечивающих достаточный уровень коагуляции. Химически, является производным 2-метил-1,4-нафтохинона. Играет значи-тельную роль в обмене веществ в костях и в соединительной ткани, а также в здоровой работе почек. Во всех этих случаях ви-тамин участвует в усвоении кальция и в обеспечении взаимодей-ствия кальция и витамина D. В других тканях, например, в лёгких и в сердце, тоже были обнаружены белковые структуры, которые могут быть синтезированы только с участием витамина К. Хими-ческое строение. В природе найдены только два витамина группы К: выделенный из люцерны витамин K1 и выделенный из гниющей рыбной муки K2. Физиология. Витамин K участвует в карбокси-лировании остатков глутаминовой кислоты в полипептидных цепях некоторых белков. В результате такого ферментативного процесса происходит превращение остатков глутаминовой кислоты в остатки гамма-карбоксилглутаминовой кислоты (сокращенно Gla-радикалы). Остатки гамма-карбоксилг-лутаминовой кислоты (Gla-радикалы), благодаря двум свободным карбоксильным группам, участвуют в связывании кальция. Gla-радикалы играют важную роль в биологической активности всех известных Gla-белков. В настоящее время обнаружены 14 человеческих Gla-белков, играющих ключевые роли в регулировании следующих физиологических процессов: свёртывание крови (протромбин (фактор II), факторы VII, IX, X, белок C, белок S и белок Z). метаболизм костей (остеокальцин, также названный Gla-белком кости, и матрицей gla белка (MGP)). сосудистая биология. Некоторые бактерии, такие как кишечная палочка, найденная в толстом кишечнике, способны синтезировать витамин K2 , но не витамин K1. В этих бактериях витамин K2 служит переносчиком электронов в процессе, называемым анаэробным дыханием. Например, такие молекулы, как лактаты, формиаты или NADH, являющиеся донорами электронов, с помощью фермента передают два электрона K2. Витамин K2 в свою очередь передает эти электроны молекулам — акцепторам электронов, таким, как фумараты или нитраты, ко-торые соответственно восстанавливаются до сукцинатов или нитритов. В результате таких реакций, синтезируется клеточный источник энергии АТФ, подобно тому, как он синтезируется в эукариотических клетках с аэробным дыханием. Кишечная палочка способна осуществлять как аэробное, так и анаэробное дыхание, в котором участвуют интермедиаты менахиноны. Препараты. Фитоменадион (Синонимы: Канавит, Мефитон, Филлохинон, Фимедион, Эвлевен К и др.) Викасол (Синоним: Менадион).
