
Методички, учебники / Кинетика - практикум
.pdf
2. Метод определения времени полупревращения
Метод заключается в выявлении зависимости периода полупревращения от начальной концентрации реагирующего вещества. Так, для реакций первого порядка время полупревращения не зависит от начальной концентрации, для реакций второго порядка оно обратно пропорционально начальной концентрации, для реакций третьего порядка оно обратно пропорционально квадрату начальной концентрации.
Все выше перечисленные методы применимы лишь к простым реакциям и позволяют скорее подтвердить предполагаемый порядок реакции, нежели рассчитать его.
3. Метод Оствальда-Нойеса
Метод позволяет непосредственно рассчитать порядок реакции на основании зависимости периода полупревращения (или времени достижения любой другой степени превращения) от начальной концентрации реагирующих веществ.
Для реакции n-го порядка период полупревращения равен
⁄ = |
2 |
− 1 |
= |
( − 1) |
|
Таким образом, если известны хотя бы два значения периода полупревращения при двух разных начальных концентрациях, порядок реакции можно рассчитать по следующей формуле:
|
= |
|
− |
+ 1 |
|
|
|
|
|
||
где , |
− начальная концентрация и |
время полупревращения в первом опыте, а |
и |
||
− |
|
||||
− начальная концентрация и время полупревращения во втором опыте.
Прологарифмировав выражение ⁄ = |
|
, можно получить уравнение прямой, |
|
не проходящей через начало координат:
= −( − 1) +
Рис.9 Зависимость логарифма периода полупревращения от логарифма начальной
концентрации.
11
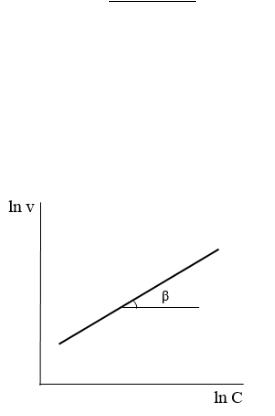
Тогда порядок реакции можно найти по тангенсу угла наклона прямой на графике:
= −( − 1)
Дифференциальный метод Вант-Гоффа
Дифференциальный метод Вант-Гоффа позволяет рассчитать любые порядки реакции на основании зависимости скорости реакции от концентрации реагирующих веществ.
Основан на дифференциальном кинетическом уравнении = .
Прологарифмировав это выражение получаем:
|
|
= |
+ |
|
|
|
|
|
Далее расчет порядка реакции возможен аналитическим и графическим способом. |
||||
|
|
а) Аналитический вариант. |
|
|
|
|
Если известны хотя бы два значения скорости ( |
|
) при двух разных концентрациях |
||||
( |
и |
), то порядок можно рассчитать по |
формуле: |
|
||
|
− ln |
и |
|
|||
|
|
= |
ln |
|
|
|
|
|
ln |
− ln |
|
|
|
В зависимости от исходных данных могут быть использованы как истинные, так и средние скорости реакции.
б) Графический вариант.
При наличии достаточно большого числа экспериментальных данных порядок реакции может быть найден по графику через тангенс угла наклона прямой: = .
Рис. 10. Зависимость логарифма скорости реакции от логарифма концентрации реагента.
Если для нахождения порядка реакции методом Вант-Гоффа были использованы результаты одного опыта, и скорость реакции найдена в разные моменты времени по
одной кинетической кривой, то определенный порядок называется временным , 12

поскольку учитывает возможное изменение механизма, а следовательно и порядка,
реакции под влиянием образующихся продуктов.
Если же реакция была проведена несколько раз с различными начальными
концентрациями, а скорость определена в момент времени |
|
, то порядок реакции, |
|
найденный по таким данным, носит название истинного |
или концентрационного |
, |
|
= 0 |
|
|
|
поскольку в начальный момент времени влияние продуктов на механизм процесса отсутствует.
Величины истинного и временного порядков для одной и той же реакции могут совпадать, могут и отличаться. В случае совпадения этих величин считают, что продукты реакции не влияют на скорость и механизм ее протекания. В случае, если временной и концентрационный порядки различаются, то имеет место ускорение или замедление процесса под влиянием продуктов реакции.
Зависимость скорости химической реакции от температуры
Скорость большинства реакций за очень редким исключением увеличивается при повышении температуры. Основное влияние температуры оказывает на константу скорости. Поэтому, говоря о влиянии температуры на скорость, в первую очередь имеют ввиду изменение константы скорости с температурой.
Эмпирическое правило Вант-Гоффа
Зависимость скорости реакции от температуры можно охарактеризовать отношением констант скоростей, найденных для данной реакции при двух температурах,
разница между которыми составляет 10 градусов, то есть величиной температурного коэффициента:
=
Согласно эмпирическому правилу Вант-Гоффа, при повышении температуры на каждые 10 градусов, скорость реакции возрастает в 2 – 4 раза. То есть величина температурного коэффициента Вант-Гоффа составляет от 2 до 4.
Это правило приближенное, эмпирическое, было установлено для реакций,
протекающих при сравнительно низких температурах. При повышении температуры величина температурного коэффициента уменьшается и стремится к единице при стремлении температуры к бесконечности: lim → ( ) = 1.
Для констант при двух любых температурах:
13

=
Уравнение Аррениуса
Более точно зависимость константы скорости от температуры описывает уравнение Аррениуса:
ln =
где – энергия активации реакции.
Аррениус предположил, что в реакцию могут вступать не все молекулы, а лишь обладающие повышенной энергией, достаточной для преодоления энергетического барьера реакции, то есть большей или равной энергии активации.
Энергия активации – некоторое избыточное количество энергии по сравнению со средней энергией молекул исходного вещества, которой должны обладать частицы, чтобы вступить во взаимодействие.
Изменение энергии системы в ходе экзотермической реакции схематически можно представить на графике: где – средняя энергия исходных веществ, – средняя энергия продуктов реакции, (разность между ними равна тепловому эффекту реакции),
– энергия активации прямой реакции.
Рис. 11. Схема изменения энергии участников реакции в ходе реакционного процесса.
Величина энергии активации определяется природой реакции, и в большинстве случаев считается не зависящей от температуры.
В случае сложной реакции опытная (эффективная) энергия активации является некоторой функцией энергий активаций отдельных стадий.
14

Расчет энергии активации
Для определения энергии активации необходимо знать константы скорости реакции при разных температурах.
1) Аналитический метод.
Проводится интегрирование уравнения Аррениуса в некоторых пределах при условии
≠ ( ):
|
|
ln |
= |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
где и – константы скорости реакции при температурах и |
соответственно. |
||||||||||
Зная две константы скорости при двух температурах можно вычислить значение |
|||||||||||
энергии активации: |
|
|
1 |
|
1 |
|
|
||||
ln |
|
= − |
|
|
− |
|
|
||||
|
|
|
|||||||||
На основании этого уравнения можно получить выражение связи энергии активации и температурного коэффициента Вант-Гоффа:
= |
( |
+ 10) |
ln |
|
10 |
2) Графический метод.
При неопределенном интегрировании уравнения Аррениуса получаем уравнение прямой, не проходящей через начало координат:
ln = − |
|
+ |
( ) |
|
Рис. 12. Зависимость логарифма константы скорости реакции от обратной температуры.
Тогда энергию активации можно найти по графику, по тангенсу угла наклона прямой:
=−
15

Потенциируя уравнение (*), получим экспоненциальную форму уравнения Аррениуса:
=
где А – предэкспоненциальный множитель уравнение Аррениуса.
16
ЛАБОРАТОРНЫЕ РАБОТЫ
Лабораторная работа 10. Изучение кинетики реакции каталитического разложения пероксида водорода газометрическим методом
Реакция разложения пероксида водорода может быть выражена уравнением:
2Н2О2 → Н2О + О2
В обычных условиях реакция протекает медленно. Скорость реакции значительно увеличивается при повышении температуры или в присутствии катализаторов: ионов Fe2+,
Fe3+, Сr2О72-, CrO42-, WO42-, МоО42- и многих других.
При соответствующем подборе условий реакция может протекать по первому или близкому к первому порядку. За ходом процесса удобно наблюдать по изменению объема выделившегося кислорода через различные промежутки времени от начала реакции.
Цель работы. Определить порядок реакции каталитического разложения пероксида водорода и рассчитать константу скорости реакции.
Оборудование и реактивы:
установка для определения объема кислорода, состоящая из бюретки, соединенной шлангом с уравнительным сосудом, и заполненными подкрашенной водой;
раствор катализатора К2CrO4;
раствор перекиси водорода ( 30%масс.).
Порядок выполнения работы
1.В реакционный сосуд влить 50 мл раствора катализатора, закрыть пробкой и поместить его в термостат, настроенный на заданную температуру.
2.Установить уровень жидкости в бюретке на нулевой отметке.
3.Проверить прибор на герметичность. Для этого опустить уравнительный сосуд вниз на 15-20 см. После понижения уровня воды в бюретке уровень должен удерживаться без перемещения в течение 2-3 минут, а затем при возвращении уравнительного сосуда на прежнее место подняться в исходное положение.
4.После 15 минутного термостатирования в реакционный сосуд влить определенное количество перекиси водорода. При вливании перекиси к раствору катализатора отметить время начала реакции (запустить секундомер).
5.Раствор тщательно перемешать стеклянной палочкой. Закрыть реакционный сосуд пробкой, соединенной с бюреткой, и поместить в термостат.
17
6.Установить одинаковые уровни жидкости в бюретке и уравнительном сосуде (таким образом давление в установке приводится к атмосферному). Произвести первое измерение, записав положение уровня жидкости в бюретке, и отметить время.
7.Кислород, выделяющийся в результате разложения перекиси водорода, постепенно будет вытеснять из бюретки воду. Уравнительный сосуд пи этом следует опускать, поддерживая во время опыта воду в нем и бюретке на одном уровне, чтобы давление газа внутри установки все время было близким к атмосферному. Записывать положение уровня воды в бюретке каждые 2 минуты. Всего провести 20 измерений.
8.К концу опыта реакция сильно замедляется и, чтобы определить объем выделившегося кислорода при практически полном разложении перекиси водорода, потребовались бы десятки часов. Для ускорения процесса реакционный сосуд поместить в кипящую водяную баню и выдержать в ней до полного разложения пероксида водорода (около 20 минут). При кипячении на водяной бане уравнительный сосуд поддерживать в наиболее низком положении.
9.После полного разложения пероксида водорода реакционный сосуд перенести в термостат и выдержать в нем в течение 15 минут.
10.Выровняв уровень жидкости в бюретке и уравнительном сосуде, записать объем всего выделившегося кислорода.
Результаты записывают измерений сводят в таблицу 1.
|
|
|
|
|
Таблица 1. |
|
|
|
|
|
|
|
|
№ |
Время от начала |
, мл |
− , мл |
( − ) |
k, |
|
п/п |
реакции, мин. |
мин.-1 |
|
|||
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
… |
|
|
|
|
|
|
|
|
|
|
|
|
|
Для определения порядка реакции интегральным методом по опытным данным строят график зависимости ln( − ) = ( ).
Поскольку исследуемая реакция является реакцией 1-го порядка, экспериментальные данные в этих координатах должны укладываться в линейную зависимость. По тангенсу угла наклона этой прямой к оси можно определить константу
скорости реакции.
18

Константу скорости реакции рассчитывают по уравнению:
= |
1 |
− |
В уравнении концентрации Н2О2 в начальный момент и в момент времени τ заменены разностями объемов кислорода.
V∞ - объем кислорода, выделившийся после разложения всего пероксида водорода
(определяется как разность уровней в бюретке в момент, принятый за начало реакции, и
после кипячения Н2О2 до полного разложения),
Vτ – уровень жидкости момент времени τ от начала реакции.
Лабораторная работа 11. Изучение кинетики реакции йодирования ацетона
Цель работы: определение константы скорости, энергии активации и температурного коэффициента реакции йодирования ацетона.
Теоретическое введение
В данной работе при изучении кинетики реакции используется аналитический метод
(метод титрования).
Реакция йодирования ацетона протекает по уравнению:
+ |
+ + |
Вотсутствии катализатора процесс протекает очень медленно. Реакция йодирования ацетона с превращением последнего в йодацетон с заметной скоростью идёт в щелочной или кислой среде. Механизм реакции зависит от среды.
Вкислой среде по мере протекания реакции происходит накопление ионов гидроксония, что приводит к увеличению скорости реакции. Такие самоускоряющиеся реакции называются автокаталитическими (ускоряется одним из продуктов реакции).
Вкислой среде йодирование ацетона протекает в две стадии:
1) обратимая реакция енолизации ацетона
( |
) ( |
) |
2) взаимодействие йода с енольной формой |
+ + . |
|
( ) ( ) + |
→ |
|
Первая стадия протекает медленно, вторая – быстро и практически до конца. Общая скорость процесса определяется скоростью стадии енолизации ацетона, которая пропорциональна концентрации ацетона и ионов водорода. Так как йод не участвует в лимитирующей стадии реакции, концентрация йода не влияет на скорость процесса.
19

Таким образом, йодирование ацетона протекает в соответствии с кинетическим уравнением автокаталитической реакции 2-го порядка, которое записывается в следующем виде:
= |
|
,ац( |
, |
) |
( ,ац , ) |
, |
( ,ац |
) |
|
где ,ац – начальная концентрация ацетона, моль/л; |
|
|
|
|
,– начальная концентрация кислоты, моль/л;
–концентрация ацетона, подвергшегося превращению за время , моль/л;
– время от начала реакции до данного измерения, мин.
Ход реакции контролируется по анализу проб, периодически отбираемых из реакционной смеси.
Оборудование и реактивы:
мерная колба объемом 250 мл;
2 колбы объемом 50 мл;
коническая колба для титрования объемом 100 мл;
бюретка объемом 25 мл;
пипетка для отбора пробы объемом 25 мл;
раствор йода с концентрацией 0,1 моль/л (в 4%-ном растворе KI);
раствор ацетона с концентрацией 1 моль/л;
раствор соляной кислоты с концентрацией 1 моль/л;
раствор NaHCO3 с концентрацией 0,1 моль/л;
|
раствор |
с концентрацией 0,01 моль·экв./л; |
|
крахмал. |
|
|
|
Последовательность выполнения работы |
В мерную колбу наливают 25 мл раствора йода, добавляют заданный объём ( 25
мл) раствора соляной кислоты и доливают водой до объема ниже метки примерно на 30– 35 мл. Берут две колбы, в одну из них наливают 25 мл раствора ацетона, в другую – дистиллированную воду. Все три колбы погружают в термостат, настроенный на определенную температуру, и выдерживают 15 – 20 минут.
Затем в колбу с реакционной смесью вливают 25 мл раствора ацетона, после чего объём раствора в ней доводят до метки дистиллированной водой, выдержанной в термостате, тщательно взболтать, закрыть пробкой и поместить обратно в термостат.
Момент вливания ацетона отмечают по часам (время начала реакции = 0). 20
