
Методички, учебники / Кинетика - практикум
.pdf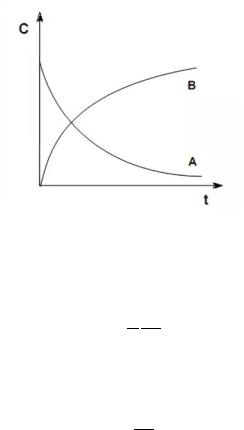
КИНЕТИКА
Изучением закономерностей физико-химических превращений во времени и занимается химическая кинетика.
Химическая кинетика – наука, занимающаяся изучением скоростей химических превращений, факторов, определяющих эти скорости, а также механизмов протекающих реакций.
Раздел химической кинетики, занимающийся формальным количественным описанием химических превращений на основании экспериментальных данных без рассмотрения механизма протекающего процесса, называется формальной кинетикой.
Основные понятия и определения
В ходе реакции количество исходных веществ уменьшается, а продуктов реакции – увеличивается. Зависимость концентрации участников химической реакции от времени протекания изображают в виде кинетических кривых.
Для реакции вида → , где А – исходное вещество, а В – продукт реакции:
Рис.2. Кинетические кривые.
Скорость реакции ( ) – изменение количества вещества ( ) в единицу времени ( ) в
единице объема ( ):
= ± 1
Если реакция протекает при постоянном объеме, то скорость реакции определяется изменением концентрации вещества ( ) в единицу времени:
= ±
Если в вышеприведенном уравнении скорость реакции определяется по изменению концентрации исходного реагента, то перед производной ставится знак «−», если скорость реакции определяется по изменению концентрации продукта, то знак «+».
1

Скорость реакции может быть определена по экспериментальным данным, как средняя величина по разности концентраций в разные моменты времени:
= ± |
− |
− |
Рассчитанная таким образом скорость является неизменной в соответствующем временном промежутке и называется средней скоростью реакции.
Истинная или мгновенная скорость реакции, то есть скорость в данный конкретный момент времени (t’), определяется как тангенс угла наклона касательной (β) к
кинетической кривой:
=
Рис. 3 Графическое определение скорости реакции по кинетической кривой.
С течением времени скорость реакции уменьшается, что видно из приведенных графиков.
Размерность скорости связана с размерностью концентрации. Обычно это моль/(л·время). В кинетике единицы измерения времени могут быть любыми (с, мин, год и т.д.).
Еще одной характеристикой протекания реакции во времени является период полупревращения ⁄ – время, за которое начальная концентрация исходного вещества уменьшиться вдвое.
Скорость реакции может быть выражена через концентрацию любого участника реакции – как исходного вещества, так и продукта реакции. Так, для реакции:
+ = +
2

скорость может быть определена как любая из производных , , , . В этом
случае скорость будет зависеть от выбора реагента.
Изменения концентраций каждого из реагентов не являются независимыми, а
связаны между собой стехиометрическими соотношениями. Соответственно, для определения инвариантной, то есть независящей от выбора реагента скорости реакции,
учитываются стехиометрические коэффициенты уравнения:
= − 1 = − 1 = 1 = 1
При постоянной температуре скорость реакции зависит от концентрации реагирующих веществ. Чем больше концентрация веществ, вступающих в реакцию, тем
выше скорость.
Математическая формула, связывающая скорость реакции с концентрацией реагентов, называется кинетическим уравнением, которое выражает основной постулат химической кинетики – так называемый закон действующих масс: скорость реакции в каждый момент времени пропорциональна произведению концентрации реагирующих
веществ, возведенных в некоторые степени. |
|
|
|
|
||
Для реакции |
+ |
= |
+ |
кинетическое уравнение |
имеет |
|
следующий вид: |
|
|
||||
Коэффициент |
пропорциональности в этом уравнении |
носит название константы |
||||
|
= |
|
|
|
|
|
скорости химической реакции. Физический смысл этой величины, иногда называемой удельной скоростью реакции, заключается в следующем: константа скорости численно равна скорости реакции при единичной концентрации реагирующих веществ.
Константа скорости не зависит от концентрации реагирующих веществ,
определяется природой реакции и зависит от температуры, а так же от условий
протекания процесса (наличия катализатора, природы растворителя и т.д.).
Размерность константы скорости зависит от вида кинетического уравнения.
Показатель степени при концентрации в кинетическом уравнении называется
порядком реакции. При этом в приведенном примере |
называется частным порядком по |
||||
компоненту А, а |
– частным порядком по компоненту В. Сумма частных порядков |
||||
определяет полный порядок реакции: |
|
. |
|
||
Порядок реакции является |
величиной формальной, физического смысла не имеет, |
||||
|
= + |
|
|
||
определяется экспериментально.
3
|
Для простых реакций порядок совпадает со стехиометрическим коэффициентом, то |
|||||
есть |
|
= |
, |
= |
|
. (Простыми называются реакции, протекающие в одну стадию, |
|
|
|
|
|
||
механизм которых правильно отражается стехиометрическим уравнением.) |
||||||
|
В общем случае, когда механизм реакции включает в себя несколько элементарных |
|||||
стадий, |
≠ |
, |
|
≠ |
. |
|
|
|
|
|
|||
Порядок реакции может принимать любые значения – целочисленные и дробные, а
также может быть равен нулю. По величине порядка реакции делятся на реакции первого,
второго, третьего и т.д. порядков.
Еще один вид классификации реакций – по молекулярности.
Молекулярность – число частиц, участвующих в элементарном акте химического взаимодействия. Молекулярность может принимать значения 1, 2 и 3. Более высокие значения молекулярности маловероятны, так как это означало бы одновременное столкновение четырех и более частиц.
По этому признаку реакции делятся на мономолекулярные, бимолекулярные и тримолекулярные. В простых реакциях значения молекулярности и порядка совпадают. В
случае многостадийного процесса можно говорить лишь о молекулярности элементарной стадии.
Метод изолирования Оствальда
Вслучае, когда в реакции участвуют несколько веществ, и некоторые из них взяты
визбытке, так что в ходе реакции их концентрация меняется незначительно, имеет место понижение порядка по сравнению с молекулярностью.
Например, для реакции |
+ |
= |
+ |
кинетическое уравнение имеет вид: |
||
Если провести эту |
реакцию |
|
избытке |
вещества В, так что |
|
на |
в = |
|
образом: |
|
|||
протяжении всего процесса, то скорость реакции можно записать следующим |
|
|||||
≈ |
|
|||||
=
где - некая эффективная константа скорости, включающая в себя неизменную концентрацию вещества В. В этом случае экспериментально определенный порядок реакции будет равен частному порядку по компоненту А.
Если затем провести эту же реакцию в избытке вещества А. то экспериментально определенный порядок реакции будет равен частному порядку по компоненту В.
=
Данный приём называется методом изолирования Оствальда и позволяет экспериментально найти частные порядки реакции по отдельным компонентам.
4

Кинетика простых необратимых реакции
Вывод интегральных кинетических уравнений для реакций различных порядков осуществляется на основании выражения:
−=
где – порядок реакции.
Реакции первого порядка
В реакцию вступает одно вещество:
→продукты
Креакциям первого порядка относятся такие процессы как термическое разложение, реакции изомеризации, радиоактивный распад, ряд бимолекулярных реакций при избытке одного из реагентов.
Дифференциальная форма кинетического уравнения:
−=
|
Путем интегрирования в пределах от 0 до и, соответственно, от |
до получаем |
|||||||||||||||||||
для константы скорости: |
|
= |
|
1 |
|
|
|
|
|
|
|
|
|
|
|||||||
или |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
= |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
момент времени |
|
, |
– концентрация |
|||||||
где – концентрация реагирующего вещества в− |
моменту времени. |
||||||||||||||||||||
в данный момент времени, |
– убыль концентрации к данному |
||||||||||||||||||||
|
= 0 |
|
|
||||||||||||||||||
|
Выражение константы скорости через степень диссоциации α: |
|
|
||||||||||||||||||
|
= |
|
|
|
= |
1 |
|
|
|
1 |
|
|
|
|
|
|
|||||
|
|
|
|
концентрации реагирующего вещества к начальной |
|||||||||||||||||
где |
|
|
– отношение |
убыли |
|
|
|
|
|
|
|
|
1 − |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
концентрации.
Размерность константы скорости − [время-1]
Переписав выражение для константы скорости в виде:
= − +
получаем уравнение линейной зависимости:
5

Рис. 4. Линейная анаморфоза кинетической кривой для реакции 1-го порядка Тангенс угла наклона прямой равен константе скорости реакции: = −
Зависимость концентрации реагирующего вещества в реакции первого порядка экспоненциальная:
=
Период полупревращения в реакции первого порядка не зависит от начальной концентрации реагирующего вещества:
⁄ = 2
Реакции второго порядка
Реакции второго порядка – это реакции вида:
2 → продукты или + → продукты
К реакциям первого порядка относятся такие процессы как реакции димеризации,
ряд гидоролитических реакций в щелочных растворах и т.д.
Дифференциальная форма кинетического уравнения в случае участия в реакции молекул одного вещества или равенства концентрации двух реагирующих веществ:
−=
Путем интегрирования в пределах от 0 до |
и, соответственно, от до получаем |
|||||||||||||||
для константы скорости: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
= |
1 |
1 |
− |
1 |
|
или |
=-1 |
1 |
∙ |
|
|
|
|
|
||
|
-1 |
] |
) |
|
||||||||||||
Размерность константы скорости − [л·моль |
|
время |
|
|
||||||||||||
· |
|
( |
− |
|
||||||||||||
Переписав выражение для константы скорости в виде: |
|
|
||||||||||||||
|
|
|
|
|
1 |
= |
+ |
1 |
|
|
|
|
|
|
|
|
получаем уравнение линейной зависимости:
6

Рис. 5. Линейная анаморфоза кинетической кривой для реакции 2-го порядка
Тангенс угла наклона прямой равен константе скорости реакции: =
Период полупревращения в реакции второго порядка обратно пропорционален начальной концентрации реагирующего вещества:
⁄ = 1
Для реакции типа
+→ продукты
при разных начальных концентрациях реагирующих веществ дифференциальная форма кинетического уравнения:
где – начальная концентрация |
вещества= ( А−, |
–)(начальная− ) |
концентрация вещества В, – |
|||
убыль концентрации реагирующих веществ к данному моменту времени. |
||||||
После интегрирования получаем: |
( |
− |
) |
|
||
1 |
|
|||||
|
= |
( − ) |
( |
− |
) |
|
Период полупревращения:
1 ⁄ = ( − ) 2 −
Реакции третьего порядка
Реакции второго порядка – это реакции вида:
3 → продукты, 2 + → продукты или + + → продукты
Пример реакций третьего порядке – взаимодействие оксида азота (II) с галогенами:
2 + = 2
7
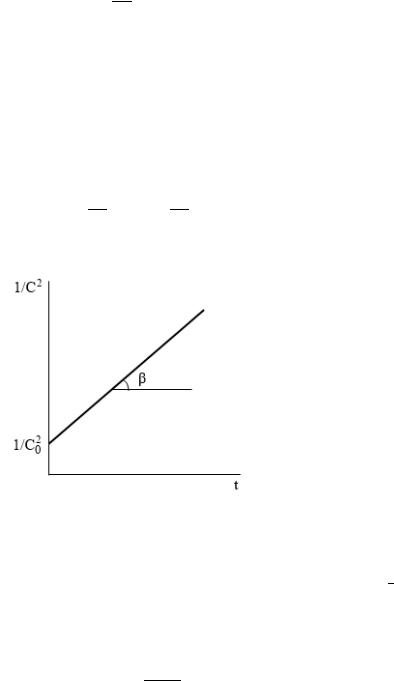
Дифференциальная форма кинетического уравнения в случае равенства концентрации реагирующих веществ:
−=
Путем интегрирования в пределах от 0 до |
|
|
и, соответственно, от до получаем |
|||||||||
для константы скорости: |
1 |
|
1 |
|
1 |
|
|
|
|
|||
= |
− |
|
|
|
|
|||||||
|
|
2 |
|
|
-2 |
·время |
-1 |
] |
||||
Размерность константы скорости |
− [л ·моль |
|
|
|||||||||
2 |
|
|
|
|
|
|
|
|
|
|
||
Переписав выражение для константы скорости в виде: |
||||||||||||
1 |
= 2 |
+ |
1 |
|
|
|
||||||
получаем уравнение линейной зависимости:
Рис. 6. Линейная анаморфоза кинетической кривой для реакции 3-го порядка
По тангенсу угла наклона прямой можно найти константу скорости реакции: =
Период полупревращения в реакции третьего порядка обратно пропорционален квадрату начальной концентрации реагирующего вещества:
⁄ = 2 3
Реакции нулевого порядка
Вряде случаев при определенных условиях проведения процесса,
экспериментально определяемый порядок реакции может оказаться равным нулю.
В этом случае дифференциальная форма кинетического уравнения будет иметь
следующий вид:
8

−=
То есть скорость реакции равна константе и не зависит от времени. Примерами реакций нулевого порядка могут служить реакции в насыщенном растворе, находящемся в контакте с избытком нерастворенного реагирующего вещества или гетерогенные каталитические реакции, протекающие на поверхности твердого катализатора при непрерывном подводе реагентов в зону реакции.
Интегральное кинетическое уравнение константы скорости имеет вид:
= 1 ( − ) или =
Размерность константы скорости − [моль·л·время-1]
Изменение концентрации реагирующего вещества во времени описывается линейной зависимостью:
= − +
получаем уравнение линейной зависимости:
Рис. 7. Линейная анаморфоза кинетической кривой для реакции 0-го порядка.
Тангенс угла наклона прямой равен одновременно скорости и константе скорости
реакции: |
= = − |
|
|
Концентрация продукта реакции линейно увеличивается со временем: |
|
|
= |
Период полупревращения в реакции нулевого порядка прямо пропорционален начальной концентрации реагирующего вещества:
⁄ = 2
9

Методы определения порядка реакции
Методы определения порядка реакции делятся на интегральные и дифференциальные. Интегральные методы основаны на использовании интегральных форм кинетического уравнения, дифференциальные методы основаны на дифференциальной форме кинетического уравнения. Все методы имеют аналитический и графический варианты.
Интегральные методы
1. Метод подстановки или подбора уравнения
а) Аналитический вариант.
Суть метода состоит в подстановке в уравнения для расчета константы скорости реакций разных порядков – первого, второго и третьего экспериментальных данных о концентрации реагирующих веществ в разные моменты времени. Порядок реакции считается выбранным верно, если рассчитанные по соответствующему уравнению значения констант скорости колеблются возле какой-то средней величины, и отклонения от среднего не превышают погрешности измерения.
б) Графический вариант.
Суть метода состоит в нахождении такой функции концентрации от времени, которая имела бы линейный характер. Для каждого порядка зависимость концентрации от времени может быть выражена прямой линией, если правильно выбрать систему координат.
Так для реакций первого порядка прямая получается в системе координат |
(прямая |
||
1), для второго порядка – в системе координат |
(прямая 2) , для третьего порядка – |
||
в координатах |
(прямая 3). |
|
|
Рис. 8. Зависимость функции концентрации от времени для различных порядков реакций.
10
