
Дистанционные лекции / Фазовое равновесие - лекция 3
.pdf
Расчет теплот испарения и возгонки
Уравнение Клапейрона – Клаузиуса дает возможность определить тепловой эффект фазового перехода (в данном случае – испарения или возгонки) на основании экспериментальных данных о зависимости давления насыщенного пара (жидкой или твердой фаз) от температуры.
Расчет средней теплоты испарения или возгонки
Средней теплотой испарения или возгонки называется величина |
∆ |
, получаемая из |
||||
уравнения Клапейрона-Клаузиуса в приближении её постоянства( |
∆ф.п. = |
) в нешироком |
||||
интервале температур ( |
|
20 – 50 К). |
|
|
||
Для расчета |
средней теплоты фазового перехода используются интегральные формы |
|||||
|
∆ = |
|
|
|
|
|
уравнения Клапейрона-Клаузиуса, полученные в результате приближенного интегрирования: ln = ∆ф.п.
Принимаем ∆ = |
|
|
ln |
= |
|
|
∆ф.п. |
|
|
|
|
|
|
||
и выносим за знак интеграла: |
|
||||||||||||||
|
|
|
|
ln |
= |
∆ф.п. |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
||||||||||
Далее возможны два варианта интегрирования: |
|
||||||||||||||
1) Аналитический расчет |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Проводим определенное интегрирование указанного выражения: |
|
||||||||||||||
|
|
|
|
ln |
= |
∆ф.п. |
|
|
|
|
|
||||
|
|
|
|
||||||||||||
В результате получаем расчетную формулу: |
|
||||||||||||||
|
|
ln |
|
= − |
∆ф.п. |
1 |
− |
1 |
|
|
|||||
|
|
|
|
||||||||||||
где |
и – давления насыщенного пара соответственно при температурах |
и . |
|||||||||||||
Таким |
образом, |
можно приближённо |
рассчитать среднюю теплоту |
испарения |
|||||||||||
(возгонки) если известны хотя бы два равновесных давления пара при двух температурах.
Вместо давлений при двух температурах могут быть известны другие параметры, через которые давление можно выразить. Например, параметры состояния идеального газа: T, V, n.
1

2) Графический расчет Проводим неопределенное интегрирование уравнения и получаем уравнение прямой, не
проходящей через начало координат:
ln = − ∆ ∙ 1 +
Строим график в координатах |
|
|
|
|
и по тангенсу угла наклона прямой определяем |
|||||||||||||
|
|
|
|
|||||||||||||||
|
или возгонки: |
|
|
|
|
|
|
|
||||||||||
среднюю энтальпию испаренияln − |
= − |
∆ф.п. |
|
|
|
|
|
|
|
|
||||||||
|
|
ф.п. |
|
|
|
|
|
|
|
|
||||||||
|
|
l |
|
− |
|
|
|
∆ф.п. |
= −2,303 ∙ |
∙ |
||||||||
|
координатах |
|
|
, то |
||||||||||||||
Если график построен в |
∆ |
|
|
|
= − |
|
∙ |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
Кроме того, уравнение прямой может быть представлено в виде |
|
|
|
|
||||||||||||||
ln |
= + , где А и В |
|||||||||||||||||
– некоторые числовые коэффициенты. Тогда |
∆ф.п. |
|
= − ∙ |
. |
|
|||||||||||||
|
|
|
|
|
|
|
|
|||||||||||
Расчет истинной теплоты испарения или возгонки
При расчете истинного теплового эффекта испарения или возгонки (т.е. энтальпии фазового перехода при заданной конкретной температуре) используют дифференциальную форму уравнения Клапейрона-Клаузиуса.
ln = ∆ф.п.
или
= ∆ф.п.
Выражаем:
ln
∆ф.п. =
2
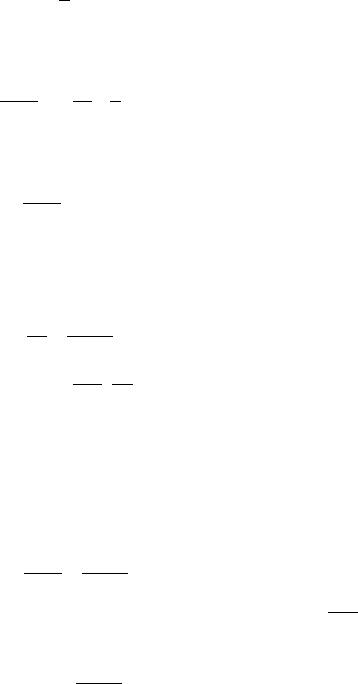
И далее задача сводится к нахождению производной, которую можно найти
аналитически или графически. 1) Аналитический расчет
Аналитический расчет возможен, если имеется функциональная зависимость вида
= |
( ) |
|
|
|
|
|
|
|
|
|
|
|
|
|
. |
|
|
|
|
|
|
|
|
|
|
|
|
Например: |
|
|
|
|
|
|
|
|
|
|
|
|
|
где A, B, C, D – постоянныеlnкоэффициенты= + |
+ уравненияln + . |
|
|
|
|
|
|||||||
Дифференцируем данное выражение по температуре: |
|
|
|
|
|
|
|||||||
|
|
|
|
ln |
|
|
|
|
|
|
|||
Далее, |
умножаем на |
и |
получаем= − |
зависимость+ + |
теплоты фазового превращения от |
||||||||
температуры: |
|
|
|
|
ln |
|
|
|
|
|
|
|
|
|
ф.п. |
|
|
|
|
|
|
|
|
|
ф.п. . |
||
Подставляя в полученное∆уравнение= |
заданную температуру= − + , рассчитываем+ |
значение |
|||||||||||
Если имеется функциональная зависимость вида |
|
|
, то расчет |
теплового эффекта |
|||||||||
|
|
|
∆ |
||||||||||
проводят по такому же принципу, с той лишь разницей, что=его( |
выражают из уравнения |
||||||||||||
) |
|
|
|
|
|||||||||
= ∆ф.п.
∆ф.п. =
2)Графический расчет
Взависимости от координат, в которых представлена графическая зависимость, расчет
∆проводится по соответствующему уравнению:
а) график в координатах |
∆ |
|
. |
|
|
|
|
В этом случае определение |
основано на уравнении: |
|
|||||
|
= ( |
) |
|
∆ф.п. |
|
|
|
|
|
ln |
|
= |
|
= |
|
Тангенс угла наклона касательной к графику в этих координатах равен: |
|||||||
Значит, |
|
|
|
|
|
|
|
= ∆ф.п.
3
Отсюда расчетная формула, связывающая тепловой эффект с тангенсом угла наклона касательной
∆ф.п. =
Если график построен в координатах l |
− |
|
, то |
|
∆ф.п. = 2,3
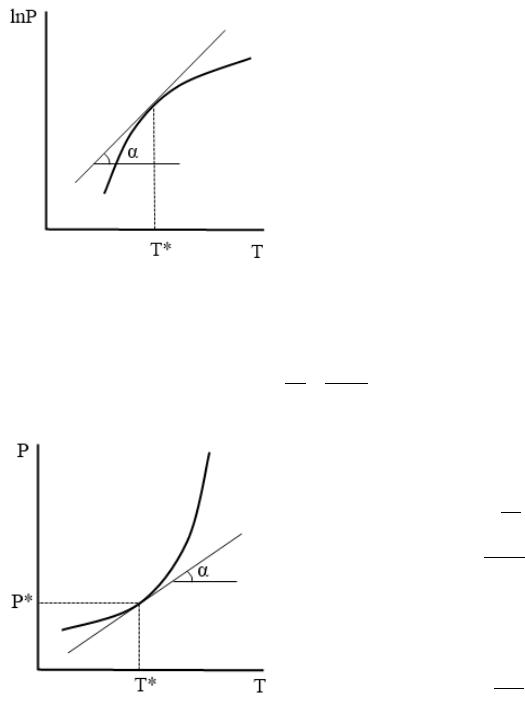
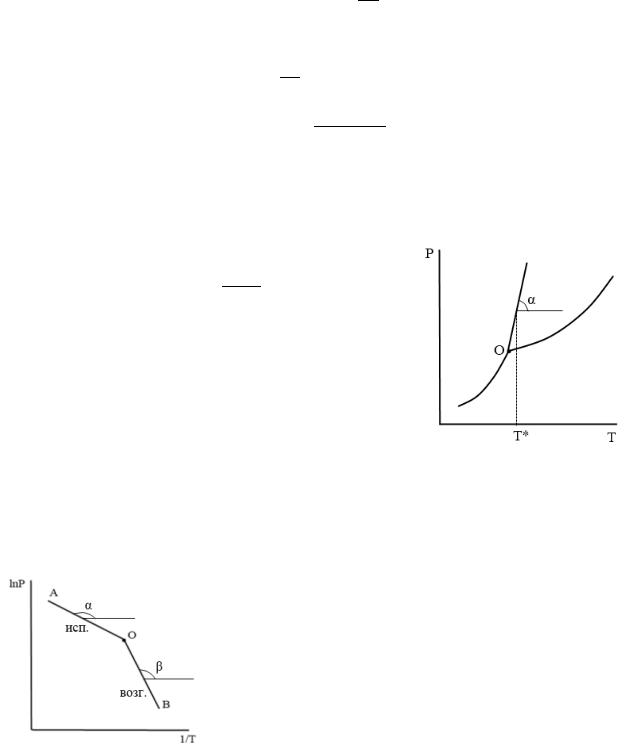
б) график в координатах = ( ).
Определение ∆ф.п. основано на уравнении:
= ∆ф.п.
Тангенс угла наклона касательной к графику в этих координатах равен:
=
= ∆ф.п.
Отсюда расчетная формула, связывающая тепловой эффект с тангенсом угла наклона касательной:
∆ф.п. =
Подставляя в это выражение найденный тангенс угла наклона касательной и конкретные значения Р* и Т*, находим тепловой эффект.
4
Зависимость теплоты испарения от температуры
Характер зависимости теплоты испарения от температуры определяется уравнением Кирхгофа:
∆исп. = ∆исп. . = ,пар − ,ж < 0
Следовательно, теплота испарения уменьшается с ростом температуры. В уравнении Кирхгофа записана производная функции одной переменной – температуры. В данной форме оно справедливо в той области температур и давлений, в которой пар можно считать идеальным газом и энтальпия испарения практически не зависит от давления. С приближением к критической точке для многих веществ пар становится неидеальным газом (например, у воды давление критической точки 218 атм и пар нельзя считать идеальным газом), но характер температурной зависимости энтальпии испарения сохраняется.
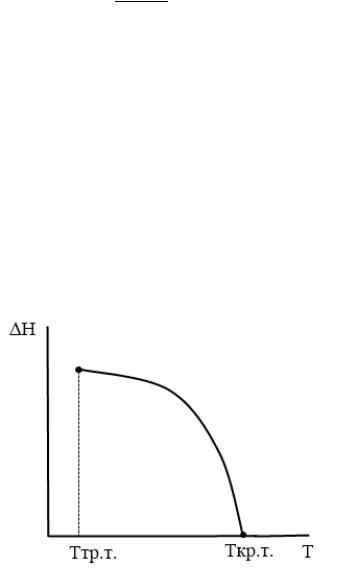
Графически эту зависимость в области температур существования жидкости (вдоль линии насыщенного пара) можно представить следующим образом:
График зависимости теплоты испарения от температуры начинается от температуры
тройной точки.
При низких и средних температурах теплота испарения убывает незначительно, от температуры практически не зависит.
По мере приближения к критической точке, эта зависимость становится все более ярко выраженной, наклон линии резко возрастает, и при критической температуре теплота испарения обращается в ноль:
|
∆исп. кр.т. = |
||||
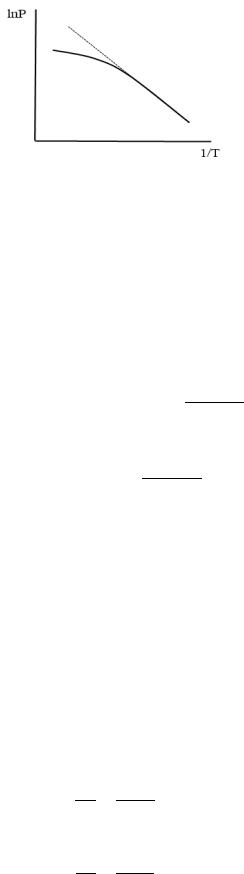
Т.о. в области высоких температур зависимость |
|
|
|
||
ln − будет отклоняться от прямолиней- |
|||||
ной: |
|
||||
|
|
5 |
|||
Правило Трутона
Теплоты испарения различных жидкостей закономерно связаны с их нормальными
температурами кипения.
Существует эмпирическое правило, которое носит название правила Трутона: Мольные
энтропии испарения неполярных неассоциированных жидкостей при нормальной
температуре кипения примерно одинаковы и в среднем составляют:
∆исп. = |
∆исп. |
≈ |
± |
Дж |
н.т.к. |
моль ∙ К |
В справочнике, на стр. 109 правило Трутона приведено в следующем виде:
∆исп. |
≈ , |
Дж |
н.т.к. |
моль ∙ К |
Это правило выполняется только для неполярных, неассоциированных в паровой фазе жидкостей и только при нормальной температуре кипения, которая у каждого вещества
единственная.
Интегрирование уравнения Клапейрона для процесса плавления
Т.к. мольные (удельные) объемы твердой и жидкой фаз очень близки друг другу по величине ( ж ≈ тв), уравнение Клапейрона для процесса плавления (а равно как и для процессов полиморфного превращения) преобразовать нельзя, и оно используется только в
таком виде:
= ∆пл.
∆
Или, что больше отвечает физическому смыслу процесса:
= ∆
∆пл.
Величина , определяющая наклон линии плавления к оси температур, хоть и является,
в свою очередь, функцией давления и температуры, но изменяется незначительно при
6

достаточно большом увеличении давления. Поэтому при изменении давления до 10 атм (иногда
и более) в хорошем приближении можно считать, что |
= |
, и линия плавления является |
||||||||
прямой линией. |
|
|
|
|
|
|
|
|
|
|
Соответственно, интегрирование уравнения Клапейрона-Клаузиуса для процесса |
||||||||||
плавления проводится следующим образом: |
|
∆пл. |
|
|
|
|||||
|
|
|
|
|
= |
|
|
|
||
|
|
|
|
|
|
|
||||
|
|
|
приблизительно постоянная величина, рассчитанная, |
|||||||
Cоотношение |
∆ |
берется как |
|
|
|
|
∆ |
|
|
|
|
∆ |
|
|
|
|
|
|
|
|
|
например, при температуре , и выносится за знак интеграла: |
|
|||||||||
|
|
|
= |
∆пл. |
|
|
||||
|
|
|
|
∆ |
|
|
|
|||
∆
Другими словами, заменяем на ∆ .
∆ |
= |
∆пл. |
|
∆ |
|||
− |
= |
∆пл. |
|
|
∆ |
||
= |
+ |
∆пл. |
|
|
∆ |
||
∆
( − )
( − )
Так можно рассчитать, при каком давлении температура плавления станет равной ,
если известна при ,
или рассчитать температуру плавления при заданном давлении:
= + |
∆ |
( − ) |
∆пл. |
Расчет теплоты плавления
В основе – уравнение Клапейрона:
= ∆пл.
∆
1) Аналитический расчет Проводится по известной зависимости = ( ).
Пусть эта зависимость имеет вид:
=+ +
где А, В, С – постоянные коэффициенты уравнения.
Выразим теплоту плавления из уравнения Клапейрона:
7
∆пл. = ∆
Продифференцируем зависимость = ( ) по давлению:
=+ 2
∆
∆ = ( + 2 )
Подставляя в полученное выражение необходимые значения p и Т, находим ∆Н.
2) Графический расчет По наклону линии плавления:
= |
|
|
= |
∆пл. |
|
|
∆ |
||
Отсюда выражаем ∆ |
: |
|
|
|
∆пл. = ∆
Подставляя сюда значение Т* и тангенса угла наклона линии плавления, получаем значение теплоты плавления.
3) Расчет теплоты плавления в тройной точке по теплотам испарения и возгонки
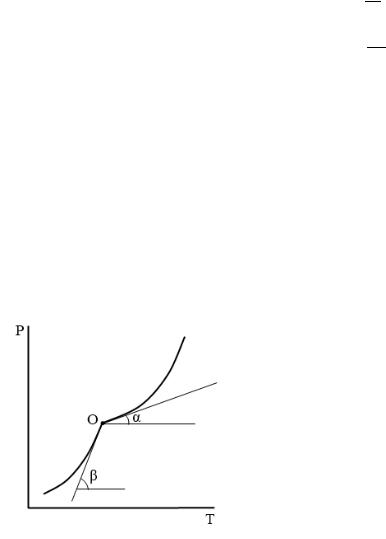
а) по графику |
− |
|
. |
|
Находим теплоты испарения и возгонки по тангенсу угла наклона соответствующих прямых:
∆исп. = − ∙
∆возг. = − ∙
Затем находим теплоту плавления по соотношению:
∆пл. = ∆возг. − ∆исп.
ОА – линия испарения, ОВ – линия возгонки, т. О – тройная точка.
8
Если известны уравнения линий испарения и возгонки:
ln |
ж = |
+ |
′ |
ln |
тв = |
+ |
′′ |
то можно найти теплоты испарения и возгонки через коэффициенты уравнений:
∆исп. = − ∙ и ∆возг. = − ∙ ′′
Теплоту плавления находим по разности теплот испарения и возгонки.
∆пл. = ( − )
Теплота плавления:
∆пл. = ∆возг. − ∆исп.
б) по графику − .
Проводим касательные к кривым испарения и возгонки в тройной точке:
|
|
|
|
|
∆исп. |
= |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
∆возг. |
= |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
В этих формулах Т и Р соответствуют температуре и |
|||||||||
|
|
давлению тройной точки. |
= ∆возг. − ∆исп. или: |
||||||||
|
|
Теплота плавления: |
∆пл. |
||||||||
∆пл. = |
|
− |
|
= |
|
( |
− |
) |
|
||
|
|
|
|
||||||||
Расчет изменения внутренней энергии и энтропии при фазовых превращениях
Расчет изменения внутренней энергии |
|
и энтропии |
|
∆ |
для фазового перехода осуще- |
|
ствляется после того, как найдено значение |
теплового эффекта |
. |
||||
|
∆ |
|
∆ |
|
|
|
Изменение внутренней энергии
Рассчитывается по соотношению:
∆ф.п. = ∆ф.п. − ∆ф.п.
а) Плавление
∆пл. = 0
Следовательно
∆пл. = ∆пл.
9

б) Испарение, возгонка
∆исп.(возг.). = 1 ∆исп.(возг.) = ∆исп.(возг.) −
Для обратного перехода (конденсации):
∆конд = −1
∆конд. = −∆исп.(возг.)
Изменение энтропии
∆ф.п. = ∆ф.п.
Для конденсации:
∆конд. = −∆исп.(возг.)
10
