
Дистанционные лекции / Фазовое равновесие - лекция 1
.pdfФазовое равновесие в однокомпонентных системах
В данной теме мы будем рассматривать равновесие фаз в системе,
образованной одним компонентом – индивидуальным чистым веществом. Для того, чтобы делать это, нам надо определить некоторые общие термины,
используемые при описании фазовых равновесий.
По числу фаз системы подразделяют на гомогенные (одна фаза) и
гетерогенные (несколько фаз). Напомним определение фазы.
Фаза – это совокупность гомогенных частей системы, обладающих одинаковыми физическими и химическими свойствами (в отсутствие внешних сил и полей) и ограниченных физической поверхностью раздела.
Число фаз в равновесной системе не может быть произвольным, при изменении термодинамических параметров число равновесных фаз может изменяться.
Число термодинамических степеней свободы (вариантность состояния системы) – количество параметров состояния равновесной системы, значения которых можно изменять в некоторых пределах без изменения числа и природы равновесных фаз.
Составляющие вещества – вещества, которые могут быть выделены из системы и существовать вне ее.
Если в системе не протекают химические реакции, то каждое из веществ,
составляющих систему, является еѐ компонентом.
Число независимых компонентов равно числу составляющих систему веществ за вычетом числа независимо протекающих реакций.
Рассматриваем равновесную систему, состоящую из К компонентов,
находящихся в Ф фазах.
Правило фаз Гиббса: Число степеней свободы f (вариантность состояния) равновесной термодинамической системы, на которую из внешних факторов влияют только р и Т, равно числу независимых компонентов минус число фаз плюс два.
1
Число степеней свободы системы в состоянии равновесия может быть равно нулю (инвариантное состояние) единице (моновариантное состояние), двум
(бивариантное состояние) или иному целому положительному числу, зависящему
от количества компонентов и числа равновесных фаз.
При наложении ограничений на параметры состояния (запрещающих их изменение) число степеней свободы уменьшается на количество ограничений.
Условная вариантность состояния системы при наличии ограничений равна:
Диаграмма состояния (фазовая диаграмма)
Диаграмма состояния или фазовая диаграмма – график, выражающий возможные фазовые состояния и условия равновесия фаз термодинамической системы в пространстве координат основных параметров или функций состояния системы.
Каждому реально существующему состоянию системы на диаграмме отвечает определенная точка, называемая фигуративной.
Размерность координатного пространства (количество независимых координат) диаграммы состояния определяется по правилу фаз как наибольшее число степеней свободы, которое достигается при наименьшем числе фаз (Ф = 1),
таким образом
Для однокомпонентной системы и диаграмма состояния
представляет собой график на плоскости двух координат, например, температуры
T и давления p.
Рассмотрим p-T-диаграмму состояния однокомпонентной системы. Каждой фазе на диаграмме соответствует свое фазовое поле: «твѐрдое», «жидкое» и «пар» или «газ». В пределах фазового поля число степеней свободы системы равно двум.
2
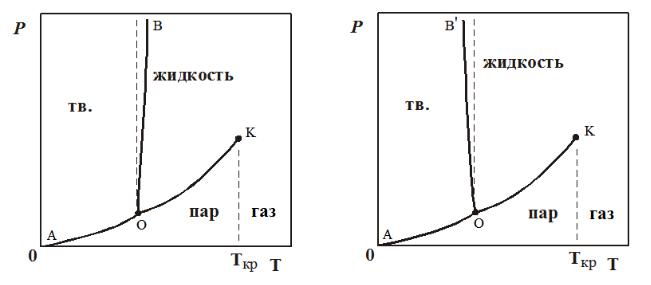
Сплошные линии на диаграмме обозначают границы однофазных областей и соответствуют равновесию двух фаз при числе степеней свободы, равном единице (линии моновариантного равновесия). Вдоль каждой линии в равновесии находятся те фазы, фазовые поля которых эта линия разделяет.
Линия возгонки ОА отвечает равновесию «твердое тело – пар». Если фигуративная точка системы лежит на линии ОА, то это значит, что в данной системе в равновесии находятся парообразная и твердая фазы. Эта линия выражает зависимость давления насыщенного пара над твѐрдой фазой от температуры. На линии ОА лежат температуры возгонки вещества при различных давлениях.
Температура возгонки – это температура, при которой давление насыщенного пара твѐрдой фазы становится равным внешнему давлению.
Давление насыщенного пара вещества – давление пара, находящегося в равновесии с жидкостью или твѐрдой фазой чистого вещества.
Линия испарения ОК выражает условия равновесия «жидкость – пар». Если фигуративная точка лежит на линии ОК, то это значит, что в данной системе в равновесии находятся парообразная и жидкая фазы. Эта линия выражает зависимость давления насыщенного пара над жидкостью от температуры. На линии ОК лежат температуры кипения вещества при различных давлениях.
Температура кипения – это температура, при которой давление насыщенного пара над жидкостью становится равным внешнему давлению. Если кипение жидкости происходит при нормальном атмосферном давлении (1 атм =
3
101325 Па), то температуру кипения называют нормальной температурой кипения (обозначение TНТК).
Таким образом, температурная зависимость давления насыщенного пара вещества определяется сочетанием линий сублимации и испарения.
С повышением температуры линия испарения обрывается в критической точке К, в которой свойства жидкости становятся равными свойствам пара,
различие жидкости и пара исчезает, энтальпия испарения становится равной нулю. В критической точке появляется дополнительное ограничение
«жидкость=пар», поэтому фазовое равновесие в этой точке инвариантно. Тем самым, критические параметры – температура и давление – являются свойствами каждого вещества. При температурах, больших критической и невысоких давлениях газ уже не называют паром. Пар – это газ, который при данной температуре путѐм сжатия может претерпевать скачкообразную конденсацию в жидкость или твѐрдую фазу.
Линия плавления OB (OBʹ) - прямая, практически вертикальная, лишь слегка отклоняется от вертикали либо влево, либо вправо. Отвечает равновесному сосуществованию твердой и жидкой фаз. Линия плавления выражает зависимость температуры плавления вещества от внешнего давления.
Температура плавления вещества – это температура, при которой твердая фаза чистого вещества находится в равновесии с жидкой при данном внешнем давлении.
Наклон линии плавления (ОВ, либо ОВʹ) вправо или влево от вертикали зависит от природы вещества, а именно от соотношения плотностей твердой и жидкой фаз. Большая часть веществ имеют линию плавления, наклоненную вправо (ОВ), а некоторые вещества, к которым относится вода при невысоких давлениях, а также галлий, германий, кремний и некоторые соединения с алмазоподобной кристаллической решѐткой (ZnS, GaAs и др.) – влево (ОВʹ).
Линию плавления, наклоненную вправо ( |
|
), имеют вещества, у которых |
|
плотность твердой фазы больше плотности жидкой фазы. Линию плавления,
4
наклоненную влево ( ), имеют вещества, у которых плотность твердой фазы
меньше плотности жидкой фазы.
Точка О на диаграмме называется тройной точкой. Она отвечает условиям
(p, T), при которых в равновесии одновременно присутствуют три фазы (в данном случае твердая, жидкая и пар).
Число степеней свободы в тройной точке: fО = 1 – 3 + 2 = 0.
Трехфазные однокомпонентные системы инвариантны, число степеней свободы равно нулю, т.е. существует только одно сочетание значений p и Т, при котором данные три фазы могут находится в равновесии. Малейшее изменение любого из этих параметров приведет к исчезновению одной или двух фаз.
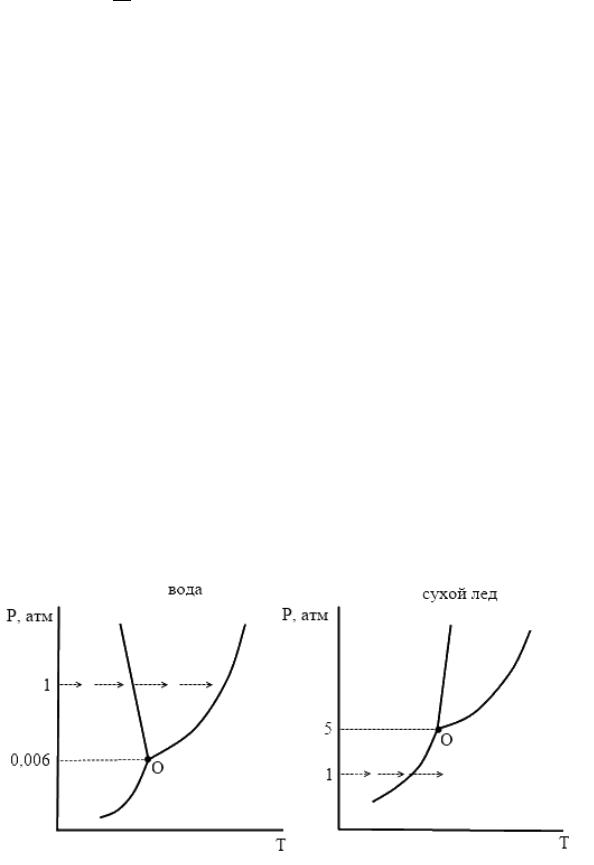
Ряд веществ (йод, нафталин, твердый СО2) при нагревании на воздухе (при атмосферном давлении), не плавясь, переходят из твердого состояния в пар. Это зависит от координат тройной точки:
Например, координаты тройной точки для воды и СО2:
Н2О: Т = 0,0098 °С, p = 0,00602 атм = 610 Па; СО2: Т = −56,6 °С, p = 5,13 атм 5 атм.
Изобразим схематически их диаграммы состояния:
У воды давление тройной точки ниже атмосферного, изобара 1 атмосферы пересекает график выше тройной точки, т.е. линию плавления, имеет место
5
переход из твердого состояние в жидкое, а потом, при дальнейшем нагревании, в
парообразное.
У СО2 изобара атмосферного давления проходит ниже тройной точки,
пересекает линию возгонки, т.е. имеет место переход сразу из твердого состояния в парообразное. Поэтому СО2 и называют «сухим льдом». Если же нагревать это вещество при давлении выше 5,13 атмосфер, то оно перестанет быть «сухим льдом», и будет сначала плавиться, а затем испаряться.
6
