
- •Програма курсу вступ
- •Тема 1. Основні поняття і закони хімії
- •Розділ 1. Будова речовини
- •Тема 2. Будова атома
- •Тема 3. Періодичний закон
- •Тема 4. Хімічний зв'язок
- •Тема 5. Основи хімічної термодинаміки
- •Тема 6. Хімічна кінетика
- •Тема 7. Хімічна рівновага
- •Розділ 3. Розчини та колоїдні системи
- •Тема 8. Розчини
- •Тема 9. Колоїдні системи
- •Розділ 4. Основи електрохімії
- •Тема 10. Окисно-відновні процеси
- •Тема 11. Електрохімічні процеси
- •Тема 12. Корозія та захист металів та сплавів
- •Розділ 5. Хімія елементів та їх сполук
- •Тема 13. Хімія металів та їх сполук
- •Тема 14. Хімія неметалічних елементів та їх сполук
- •Розділ 6. Хімія органічних сполук
- •Тема 15. Теорія хімічної будови
- •Тема 16. Вуглеводні
- •Тема 17. Оксигеновмісні органічні сполуки
- •Тема 19. Полімерні матеріали
- •Розділ 7. Тема 20. Хімія та охорона навколишнього середовища
- •Література
- •Вступ. Тема 1. Основні поняття і закони хімії
- •78 Г бензолу потребує 7,5 молей кисню
- •1000 Г бензолу потребує n молей кисню
- •Розділ 1. Будова речовини
- •Тема 2. Будова атома
- •Тема 3. Періодичний закон
- •Тема 4. Хімічний зв'язок
- •Розділ 2. Загальні закономірності хімічних процесів
- •Тема 5. Основи хімічної термодинаміки
- •Перший наслідок з закону Гесса:
- •Другий закон (постулат) термодинаміки:
- •Тема 6. Хімічна кінетика
- •Тема 7. Хімічна рівновага
- •Рівновага в гетерогенних системах
- •Розділ 3. Розчини та колоїдні системи
- •Тема 8. Розчини
- •Тема 9. Колоїдні системи
- •Тема 10. Окисно–відновні процеси
- •Тема 11. Електрохімічні процеси. Хімічні джерела струму. Електроліз
- •Тема 12 Корозія металів
- •Тема 13. Хімія металів. Класифікація та номенклатура неорганічних сполук
- •Лужні та лужно-земельні метали
- •Легкі конструкційні метали (Be, Mg, Al, Ti )
- •Важкі конструкційні метали. Хімічні властивості заліза.
- •Горіння металів
- •Тема 14. Хімія неметалів
- •1. Загальна характеристика неметалів
- •Хімічні властивості сульфуру
- •Розділ 6. Хімія органічних сполук
- •Тема 15. Теорія хімічної будови
- •Тема 16. Вуглеводні
- •Пожежна небезпека вуглеводів
- •Галогеновуглеводні вуглеводнів, їх застосування у пожежній справі
- •Номенклатура та ізомерія
- •Будова та реакційна здатність
- •Приклад 50.
- •Застосування галогенпохідних у пожежній справі
- •Тема 17. Кисневмісні органічні сполуки
- •Властивості карбонових кислот та їх похідних
- •Тема 18. Азотовмісні та елементорганічні сполуки
- •Класифікація амінів
- •Амінокислоти як мономери білків
- •Тема 19. Полімерні матеріали.
- •Середовища Роль хімії в розв'язанні екологічних проблем
- •Проблема радіоактивних відходів
- •Завдання для самостійного розв’язання
- •Додаток
- •Значення деяких фізико-хімічних констант
- •Значення електронегативностей елементів за Полингом)
- •Термодинамічні властивості деяких речовин.
- •Класифікація електролітів за їх силою
- •Добутки розчинності деяких сполук у воді при 298к
- •Стандартні електродні потенціали
- •Навчальне видання
- •Практикум
- •61023 М. Харків, вул. Чернишевського, 94
Тема 19. Полімерні матеріали.
Характерною особливістю багатьох ненасичених сполук є їх здатність вступати в реакцію полімеризації і утворювати полімери.
Полімеризацією ненасичених сполук називають хімічну реакцію утворення полімеру (високомолекулярної сполуки) за рахунок з’єднання між собою великої кількості молекул ненасичених сполук (мономерів) ковалентними зв’язками, які виникають внаслідок розриву кратних зв’язків ( - зв’язків) у молекулах мономерів.
Полімеризація, наприклад, однозаміщених похідних етилену може бути зображена загальною схемою:
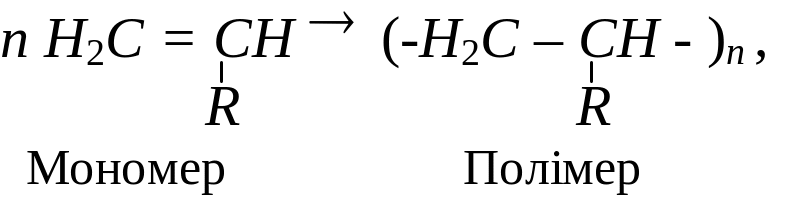
де n – ступінь полімеризації, який може мати значення до кількох сотень тисяч одиниць. При значенні n = 2,3,4… 10 сполуки називають олігомерами (від грец. “олігос” – небагато). Полімери знаходяться в генетичному (спорідненому) зв’язку з вихідними мономерами. Замісники – атоми водню, хлору (Cl) або – CH3, -CN, - С6Н5, Н2С = СН – та інш.
У хімії полімерів широко використовують також сумісну полімеризацію кількох різних мономерів, яку називають співполімеризацією.
Полімери, добуті методом полімеризації, називають переважно за назвою мономерів, до якої додають префікс полі.
Каучук має велике народногосподарське значення. З нього виготовляють гуму, а гумова промисловість виготовляє понад 70 тис. назв різноманітних виробів. Розрізняють два види каучуків: натуральний і синтетичний.
Натуральний (природний) каучук має будову:
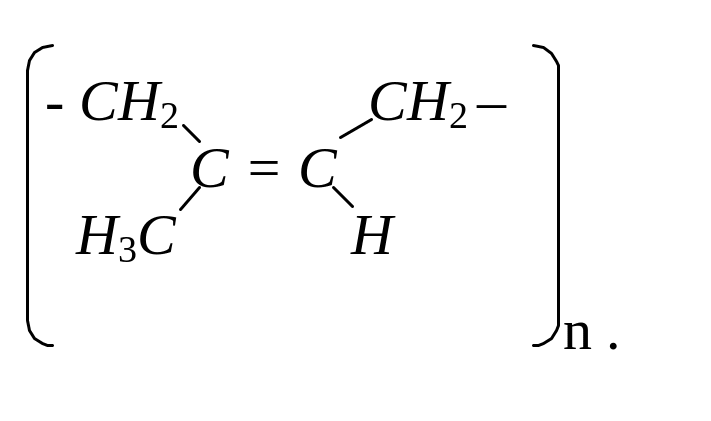
Липкий натуральний каучук при нагріванні з сіркою перетворюється на нелипкий еластичний продукт, який отримав назву вулканізованого каучуку, а процес взаємодії каучуку з сіркою назвали вулканізацією. В процесі вулканізації сірка приєднується за місцем подвійних зв’язків каучуку і утворює поперечні (місткові) зв’язки між полімерними ланцюгами. Відбувається “зшивання” лінійних макромолекул каучуку в більші, сітчасті (тримірні) полімерні молекули.
Поперечні зв’язки, які утворює при цьому сірка, надають такому каучуку еластичності, міцності і усувають липкість. Вулканізований каучук (гума) може розтягуватися до 900%.
Синтетичні каучуки (СК).
Перше в світі велике промислове виробництво СК було організовано в СРСР у 1930 р. на основі методу, розробленого С.В. Лебедєвим. Як вихідний дієн був використаний дивініл (бутадієн-1,3). Будова такого полімеру має вигляд:
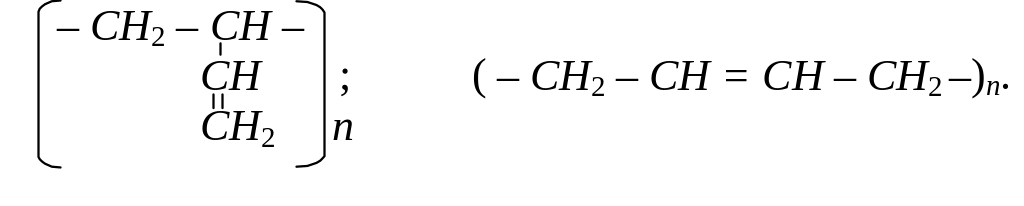
Реакції поліконденсації також дають можливість отримати високомолекулярні сполуки. Під час таких реакцій відбувається сполучення молекул мономерів з одночасним відщепленням легких молекул (Н2О, NH3, CH3OH та інш.).
Прикладом реакції поліконденсації є реакція між терефталевою кислотою і етиленгліколем:
n HOOC – C6H4 – COOH + n HO – CH2 – CH2 – OH
Терефталева кислота Етиленгліколь
2nH2O+HOO –C6H4–CO – (–O– CH2 –CH2–O–CO –C6H4CO –)n-1OCH2 –CH2OH
Кінцева група Кінцева група
Під час цієї реакції утворюється поліетилентерефталат з якого виробляють волокно “лавсан” а також різноманітний посуд.
Реакція поліконденсації лежить в основі утворення фенол-формальдегідних смол.
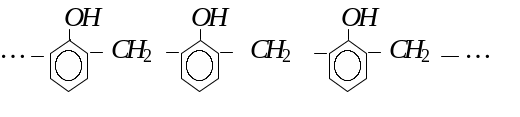
Фенолформальдегідні смоли використовують для виготовлення пресовочних порошків, шаруватих пластиків, лаків, клеїв, пінопластів.
Особливості горіння полімерів
Особливістю процесів горіння полімерів є те, що великі за розміром молекули полімерів не можуть переходити в газовий стан. Горіння їх, як і горіння більшості твердих речовин, відбувається в газоподібному стані. Тому для того, щоб полімер зайнявся, потрібно його підігріти до температури, коли починається його термічна деструкція. Продукти розкладання полімерів переходять в газоподібний стан, змішуються з повітрям та горять. Температура займання більшості пластмас вища ніж 200С.
У продуктах горіння пластмас можуть міститись токсичні речовини. Вони можуть складатися з оксидів азоту (NO, NO2), хлороводню (НCl), чадного газу (СО) та синильної кислоти (HCN). Горіння більшості полімерів лімітується процесами масотеплопередачі і визначається умовами дифузії горючих продуктів розкладу і кисню повітря та їх змішування. Тому горіння полімерів має дифузійний характер.
Приклад 57.
Яку кількість бутадієнового каучуку можна добути з 5 кг етанолу за методом Лебедєва?
Розв'язання.
1. За методом Лебедєва з етанолу отримують бутадієн:
2CH3CH2OH CH2=CH–CH=CH2 + 2H2O +H2,
а з бутадієну - каучук:
n CH2=CH–CH=CH2 (–CH2–CH=CH–CH2–)n.
З рівняння бачимо, що з 2 молів спирту утворюється 1 моль бутадієну, а маса каучуку дорівнює масі бутадієну.
2. n(C2H5OH) = m(C2H5OH)/M(C2H5OH) =5000/46 = 108,7 моль;
n(C4H6) = n(C2H5OH)/2= 108,7/2 = 54,35 моль.
3. m(каучуку)=m(C4H6)= n(C4H6)M(C4H6) = 54,35 54 = =2934,8г.
Запитання для самоконтролю.
Що таке: а) полімери, б) мономери, в) олігомери?
У чому різниця між реакціями полімеризації та поліконденсації?
Що таке елементарна ланка полімера?
Які вам відомі стадії реакцій полімеризації?
Що таке: а) гума, б) каучук, в) ебоніт?
Який процес називається вулканізацією?
У чому особливості реакцій горіння полімерів?
Що таке термодеструкція полімерів?
РОЗДІЛ 6. Тема 20. ХІМІЯ ТА ОХОРОНА НАВКОЛИШНЬОГО
