
- •Програма курсу вступ
- •Тема 1. Основні поняття і закони хімії
- •Розділ 1. Будова речовини
- •Тема 2. Будова атома
- •Тема 3. Періодичний закон
- •Тема 4. Хімічний зв'язок
- •Тема 5. Основи хімічної термодинаміки
- •Тема 6. Хімічна кінетика
- •Тема 7. Хімічна рівновага
- •Розділ 3. Розчини та колоїдні системи
- •Тема 8. Розчини
- •Тема 9. Колоїдні системи
- •Розділ 4. Основи електрохімії
- •Тема 10. Окисно-відновні процеси
- •Тема 11. Електрохімічні процеси
- •Тема 12. Корозія та захист металів та сплавів
- •Розділ 5. Хімія елементів та їх сполук
- •Тема 13. Хімія металів та їх сполук
- •Тема 14. Хімія неметалічних елементів та їх сполук
- •Розділ 6. Хімія органічних сполук
- •Тема 15. Теорія хімічної будови
- •Тема 16. Вуглеводні
- •Тема 17. Оксигеновмісні органічні сполуки
- •Тема 19. Полімерні матеріали
- •Розділ 7. Тема 20. Хімія та охорона навколишнього середовища
- •Література
- •Вступ. Тема 1. Основні поняття і закони хімії
- •78 Г бензолу потребує 7,5 молей кисню
- •1000 Г бензолу потребує n молей кисню
- •Розділ 1. Будова речовини
- •Тема 2. Будова атома
- •Тема 3. Періодичний закон
- •Тема 4. Хімічний зв'язок
- •Розділ 2. Загальні закономірності хімічних процесів
- •Тема 5. Основи хімічної термодинаміки
- •Перший наслідок з закону Гесса:
- •Другий закон (постулат) термодинаміки:
- •Тема 6. Хімічна кінетика
- •Тема 7. Хімічна рівновага
- •Рівновага в гетерогенних системах
- •Розділ 3. Розчини та колоїдні системи
- •Тема 8. Розчини
- •Тема 9. Колоїдні системи
- •Тема 10. Окисно–відновні процеси
- •Тема 11. Електрохімічні процеси. Хімічні джерела струму. Електроліз
- •Тема 12 Корозія металів
- •Тема 13. Хімія металів. Класифікація та номенклатура неорганічних сполук
- •Лужні та лужно-земельні метали
- •Легкі конструкційні метали (Be, Mg, Al, Ti )
- •Важкі конструкційні метали. Хімічні властивості заліза.
- •Горіння металів
- •Тема 14. Хімія неметалів
- •1. Загальна характеристика неметалів
- •Хімічні властивості сульфуру
- •Розділ 6. Хімія органічних сполук
- •Тема 15. Теорія хімічної будови
- •Тема 16. Вуглеводні
- •Пожежна небезпека вуглеводів
- •Галогеновуглеводні вуглеводнів, їх застосування у пожежній справі
- •Номенклатура та ізомерія
- •Будова та реакційна здатність
- •Приклад 50.
- •Застосування галогенпохідних у пожежній справі
- •Тема 17. Кисневмісні органічні сполуки
- •Властивості карбонових кислот та їх похідних
- •Тема 18. Азотовмісні та елементорганічні сполуки
- •Класифікація амінів
- •Амінокислоти як мономери білків
- •Тема 19. Полімерні матеріали.
- •Середовища Роль хімії в розв'язанні екологічних проблем
- •Проблема радіоактивних відходів
- •Завдання для самостійного розв’язання
- •Додаток
- •Значення деяких фізико-хімічних констант
- •Значення електронегативностей елементів за Полингом)
- •Термодинамічні властивості деяких речовин.
- •Класифікація електролітів за їх силою
- •Добутки розчинності деяких сполук у воді при 298к
- •Стандартні електродні потенціали
- •Навчальне видання
- •Практикум
- •61023 М. Харків, вул. Чернишевського, 94
Тема 7. Хімічна рівновага
Стан системи реагуючих речовин (оборотної реакції), за яким швидкості прямої та зворотної реакцій стають однаковими, називається хімічною рівновагою.
В стані хімічної рівноваги кількості вихідних речовин і продуктів реакції не змінюються, оскільки реакція відбувається в обох напрямках з однаковими швидкостями. Ось чому стан хімічної рівноваги має рухомий, динамічний характер.
З точки зору хімічної термодинаміки в стані хімічної рівноваги енергія Гіббса системи має найменше значення.
Кількісною характеристикою хімічної рівноваги є її константа. Для реакції:
aА + вВ = dD = fF
![]() ,
,
де [ ] позначають рівноважну концентрацію.
Для будь-якої реакції константу рівноваги можна записати:
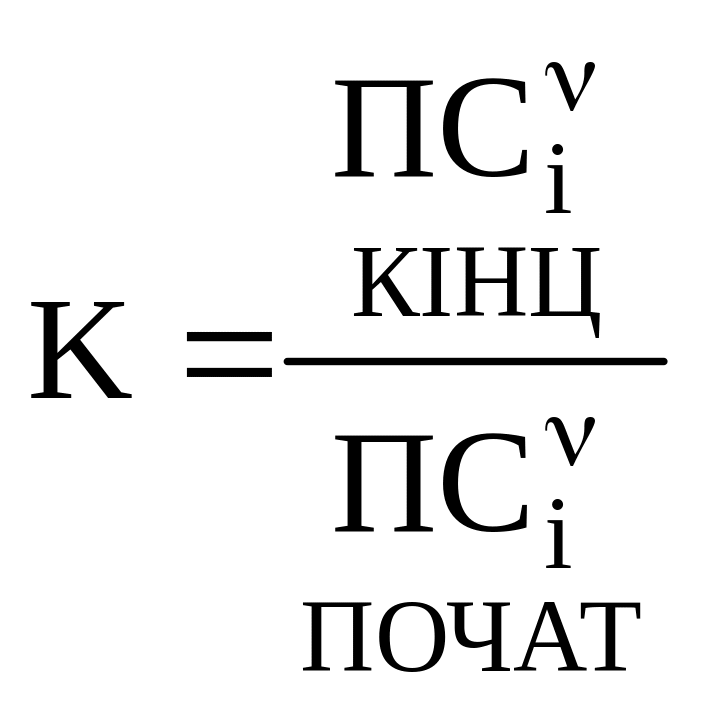
де
![]()
![]() -
добуток концентрацій кінцевих та
початкових речовин в ступенях, що
дорівнюють стехіометричним коефіцієнтам.
-
добуток концентрацій кінцевих та
початкових речовин в ступенях, що
дорівнюють стехіометричним коефіцієнтам.
Константа хімічної рівноваги визначає глибину перебігу процесу в момент досягнення стану рівноваги. За допомогою константи рівноваги можна обчислювати рівноважні концентрації речовин, що беруть участь в реакції.
Приклад 17.
Вихідні концентрації хлору та водню в реакції синтезу хлороводню складали 1 моль/л. Визначити рівноважну концентрацію хлороводню після досягнення стану рівноваги. Константа рівноваги для цієї реакції дорівнює 4.
Розв'язання.
Запишемо рівняння реакції: H2 + Cl2 = 2HCl.
Нехай до моменту встановлення рівноваги концентрація хлору зменшилась на Х моль/л, тоді концентрація водню теж зменшиться на Х моль/л (за рівнянням реакції хлор та водень реагують у співвідношенні 1:1) . Концентрація хлороводню буде складати 2Х ( з рівняння реакції бачимо, що з 1 моль Cl2 утворюється 2 моль хлороводню)
Запишемо рівноважні концентрації всіх речовин, що беруть участь в реакції:
H2 – (1–Х)
Cl2 – (1–Х)
HCl – (2Х)
Підставимо ці концентрації у вираз для константи рівноваги.
![]() ,
звідси х = 0,5, 1–х = 0,5, 2х = 1.
,
звідси х = 0,5, 1–х = 0,5, 2х = 1.
Відповідь: концентрації водню та хлору будуть 0.5 моль/л, а концентрація хлороводню буде 1 моль/л.
Приклад 18.
В посудині об'ємом 0,5 л змішали 0.5 моля водню та 1.0 моль вуглекислого газу. Обчислити константу рівноваги реакції:
CO2 + H2 = CO + H2O(г) ,
якщо відомо, що до моменту встановлення рівноваги прореагувало 50% водню.
Розв'язання.
До моменту встановлення рівноваги прореагувало (0.550)/100=0,25 моль водню. Згідно з рівнянням реакції, прореагувало вуглекислого газу 0,25 моль і утворилось води та оксиду вуглецю (ІІ) по 0,25 моль. Рівноважні кількості (CO2, H2, CO, H2O) складуть 0.75; 0,25; 0,25; 0,25 моль. Концентрації цих речовин відповідно складуть: ( С=n/V): 1,5; 0,5; 0,5; 0,5 моль/л.
![]()
Термодинаміка дає універсальне співвідношення між стандартною зміною енергії Гіббса і величиною константи хімічної рівноваги:
G0 = –RTlnK.
Приклад 19.
За допомогою таблиць стандартних термодинамічних величин визначити константу рівноваги реакції синтезу аміаку.
Розв'язання.
1. Запишемо рівняння реакції: N2 + 3H2 = 2 NH3
2. За допомогою таблиць стандартних термодинамічних величин розрахуємо зміну енергії Гіббса для цієї реакції:
G0х.р.= 2 G0f(NH3) – G0f(N2) – 3G0f(H2) = 2 (–16,7) = –33,4 кДж/моль
3. Розрахуємо константу рівноваги.
G0 = –RTlnK, lnK = – G0/RT = 33,4·103/(8.314298) =13,4; К = е13,4 =
= 6.6 105.
Принцип Ле–Шательє (принцип рухомої (динамічної)) рівноваги:
якщо на систему, що перебуває у стані рівноваги, подіяти ззовні, то в системі відбуватимуться зміни, що послаблюють або знищують цю дію.
Вплив концентрації на стан рівноваги.
Згідно з принципом Ле–Шательє, введення в систему, що перебуває в стані рівноваги, додаткової кількості будь-якої з реагуючих речовин викликає зміщення рівноваги у тому напрямку, в якому її концентрація зменшується
Вплив тиску на стан рівноваги.
Згідно з принципом ле Шательє, підвищення тиску зумовлює зміщення хімічної рівноваги в напрямку процесу, який супроводжується зменшенням об'єму, а зниження тиску — викликає зміщення рівноваги у протилежний бік.
Вплив температури на стан рівноваги.
Згідно з принципом Ле–Шательє, під час нагрівання системи, що перебуває в стані рівноваги, остання зміщується в бік того з двох протилежноспрямованих процесів, який супроводжується поглинанням теплоти.
