
- •Электрический ток в металлах
- •1 Строение металлов
- •2 Опыты л.И. Мандельштама и н.Д. Папалекси
- •3 Зависимость сопротивления металлов от температуры
- •4 Явление сверхпроводимости
- •Электрический ток в полупроводниках
- •1 Полупроводники
- •2 Чистые полупроводники
- •3 Электрическая проводимость полупроводников при наличии примесей
- •4 Электрический ток через контакт полупроводников p- и n- типов
- •5 Полупроводниковый диод
- •6 Транзистор
- •7 Термисторы и фоторезисторы
- •Электрический ток в вакууме
- •1 Модель тока в вакууме
- •2 Вакуумный диод
- •3 Основные закономерности протекания тока в вакууме
- •4 Электронно-лучевая трубка
- •5 Применение тока в вакууме
- •Электрический ток в газах
- •3 Несамостоятельный разряд
- •4 Самостоятельный разряд
- •5 Виды самостоятельного разряда
- •1 Модель раствора электролита и механизм электролиза
- •3 Закон электролиза
- •4 Применение электрического тока в растворах электролитов
- •Тема электромагнетизм Урок Магнитное поле и его характеристики
- •Характеристики магнитного поля
- •Урок явление электромагнитной индукции. Закон электромагнитной индукции
- •Явление электромагнитной индукции – это возникновение тока в замкнутом контуре, который охвачен переменным магнитным потоком.
- •Урок самоиндукция. Энергия магнитного поля
- •3 Взаимная индукция – явление возникновения индуцированного электрического поля в проводниках, находящихся вблизи других проводников, по которым протекает изменяющийся во времени электрический ток.
- •4 Энергия магнитного поля
- •Тест Электромагнитная индукция Вариант 1
- •Вариант 2
1 Модель раствора электролита и механизм электролиза
Электролиты – это растворы солей, кислот и щелочей.
Электролитическая диссоциация – распад молекул электролитов на ионы под воздействием полярных молекул воды
CuSO4 → Cu2+ + SO42-
Степень диссоциации – доля молекул растворенного вещества, которые распадаются на ионы.

Степень диссоциации зависит от:
температуры;
концентрации раствора;
диэлектрической проницаемости растворителя.
Одновременно идет обратный процесс.
Рекомбинация – образование нейтральных молекул
из ионов.
При неизменных условиях в растворе устанавливается динамическое равновесие – это число молекул, распадающихся на ионы за секунду, равное числу пар ионов, которые за то же время воссоединяются в нейтральные молекулы.
Поместим в раствор электроды, подключенные к источнику тока.
2 Под действием электрического поля
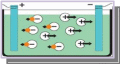
положительные ионы начнут движение к катоду,
а отрицательные ионы – к аноду, т.е. в
электролите возникнет ток.
На катоде ионы меди получат недостающие
электроны, происходит оседание меди.
Группа SO42- неустойчива и вступает в реакцию с водой:
2SO42- + 2H2O → 2H2SO4 + O2/
Кислород выделяется в виде пузырьков газа на аноде, а серная кислота остается в растворе.
Электролиз – выделение на электродах вещества при протекании тока через растворы электролитов.
Т.о., в электролитах проводимость ионная. Прохождение тока через растворы электролитов сопровождается переносом вещества.

3 Закон электролиза
Закон Фарадея: масса выделившегося вещества на электродах за время при прохождении электрического тока, пропорциональна силе тока и времени
m
=
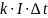 (9)
(9)
где k – электрохимический эквивалент – численно равен массе выделившегося на электродах вещества при переносе ионами заряда в 1 Кл. Зависит от природы вещества.
[k] = 1 кг/ Кл
4 Применение электрического тока в растворах электролитов
Гальваностегия
В технике для предотвращения коррозии отдельные детали различных устройств покрывают никелем, хромом, кадмием. Такие покрытия наносят гальваническим способом. Деталь очищают и помещают в электролитическую ванну, наполненную водным раствором соли соответствующего металла, и соединяют с отрицательным полюсом источника тока. Анодом служит пластинка из того же металла. В результате электролиза на поверхности детали оседает слой вещества.
Рафинирование меди
Медь, полученная из руды в плавильной печи, содержит разные примеси. Для очистки меди массивные листы металлургической меди опускают в раствор сульфата меди и соединяют с положительным полюсом источника тока. В качестве катода берут тонкие листы чистой меди. При прохождении электрического тока через электролит чистая медь выделяется на катоде, а анод постепенно растворяется. Примеси выпадают в осадок.
Электролитическая полировка
Электрометаллургия
Явление электролиза используется для получения алюминия, натрия, меди, бериллия и др. металлов из соответствующих расплавленных руд. Между дном ванны и угольными электродами зажигают электрическую дугу, в которой температура более 2500К. В пламени дуги плавится руда, и происходит электролитическая диссоциация молекул. Через расплав пропускают ток, в результате на дне ванны оседают молекулы металла. Расплавленный металл стекает по наклонному дну ванны в специальные ковши
Гальванопластика
Можно получать точные рельефные копии предметов. Для этого с предмета делают слепок из пластического материала. Затем поверхность слепка делают электропроводной, покрывая ее тонким слоем электропроводного вещества. Затем слепок помещают в электролитическую ванну в качестве катода. Пропуская ток, покрывают слепок толстым слоем металла. С помощью гальванопластики изготавливаются точные копии украшений, штампы для производства грампластинок.
Задание: После изучения темы «Электрический ток в различных средах» необходимо письменно ответить на вопросы:
1 Как зависит сила тока, проходящего через газ, от приложенного напряжения при несамостоятельном разряде?
2 Назовите условие возникновения самостоятельного разряда
3 Как происходит ионизация газов?
4 Почему при комнатной температуре свободные электроны не могут покинуть металл?
5 Что такое термоэлектронная эмиссия?
6 Какое явление называется электролизом?
7 Почему после прекращения действия ионизаторов газ снова становится диэлектриком?
8 Объясните, что происходит при введении донорной примеси в кристалл полупроводника
9 Объясните механизм собственной проводимости полупроводников
10 Объясните, как образуется электронно-дырочный переход
11 Объяснить, что происходит при введении акцепторной примеси
12 Объясните механизм диссоциации в растворах электролитов
13 Объяснить устройство электронно-лучевой трубки
14 В чем заключалась идея опыта Мандельштама и Папалекси и как она была реализована?
15 Что такое рекомбинация?
16 В чем заключается закон Фарадея?
17 Что такое электрохимический эквивалент?
18 Объясните явление ионизации электронным ударом
19 Какой разряд называется самостоятельным?
20 Что называется несамостоятельным разрядом?
21 Как объяснить насыщение тока при несамостоятельном разряде?
22 В чем заключается явление сверхпроводимости?
