
- •Органическая химия. Тема: «Углеводороды» Лекция 4. Непредельные углеводороды. Этилен. Ацетилен.
- •5. Алкины – углеводороды с одной тройной связью. Общая формула алкинов - CnH2n-2.
- •2) Особые химические свойства этих углеводородов обусловлены наличием тройной связи.
- •4. Получение.
- •Прочитайте текст, найдите ответы на вопросы.
- •Выполните упражнения.
2) Особые химические свойства этих углеводородов обусловлены наличием тройной связи.
Для них, как и для алкенов, характерны реакции электрофильного присоединения (водорода, галогеноводорода или галогенов), но только они протекают при более жестких условиях и в две стадии. Сначала рвется одна -связь, а потом вторая. Алкины взаимодействуют с галогенами. Например, они также, как и алкены, обесцвечивают бромную воду.
СН СН + Br2 => СНBr =СНBr
СНBr =СНBr + Br2 => СНBr2 –СНBr2
Гидратация
алкинов
катализируется солями ртути (II )
(реакция Кучерова), на первой стадии
реакции образуются непредельные спирты,
которые называют виниловыми спиртами
или енолами.
)
(реакция Кучерова), на первой стадии
реакции образуются непредельные спирты,
которые называют виниловыми спиртами
или енолами.
СН
СН
+ H2О
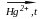 [СН2=СНOH]
=> CH3-CH=O
[СН2=СНOH]
=> CH3-CH=O
Отличительной чертой енолов является их неустойчивость (если двойная связь и гидроксогруппа оказывается у одного атома углерода, это делает молекулу неустойчивой), они изомеризуются с образованием карбонильной группы (уксусного альдегида в случае ацетилена и кетонов – во всех остальных).
3) Особенностью алкинов является способность отщеплять протон под действием сильных оснований, т.е. проявлять слабые кислотные свойства. (Повышенная электронная плотность в области тройной святи вызывает поляризацию связи С-Н и водород приобретает способность замещаться на металл). Алкины способны образовывать соли (карбид кальция, карбид серебра): СаС2 или Ag2C2. Эти соединения нестойкие и легко разлагаются водой.
4![]() )
Полимеризация алкинов в присутствии
катализаторов дает (в зависимости от
условий) различные вещества:
)
Полимеризация алкинов в присутствии
катализаторов дает (в зависимости от
условий) различные вещества:
Например: бензол.
3СН
СН
5) Алкины легко окисляются марганцовкой. Раствор марганцовки обесцвечивается, что можно использовать для обнаружения тройной связи. При окислении алкинов рвется не только -связь, но и связь, и образуются две карбоновые кислоты.
R1-C
C-R2
 R1-COOH
+ R2-COOH
R1-COOH
+ R2-COOH
4. Получение.
1) В лабораториях и промышленности ацетилен чаще всего получают из карбида кальция. Если кусочек карбида поместить в воду начинает выделяться газ.
СаС2 + H2О → С2Н2 ↑+ Са(ОН)2
Но для получения карбида кальция надо затратить много энергии (реакция идет при 2000оС)
СаО + 3С → СаС2 + СО
Поэтому в промышленности для получения ацетилена стали использовать метан (термическое разложение при 1500оС, дегидрирование, см.выше).
5. Применение. Наибольшее применение из всех алкинов имеет ацетилен
1) сварка и резка металлов;
2) органический синтез: получение винилацетилена, а из него хлоропрена (каучук); получение галогенпроизводных, например, растворителя 1,1,2-трихлорэтена или хлорэтена (винилхлорида) из которого получают полимер поливинилхлорид (искусственная кожа, клеенка, изоляция проводов); получение уксусного альдегида, а из него уксусной кислоты.
Задания для самостоятельной работы.
Прочитайте текст, найдите ответы на вопросы.
В чем особенность строения алкенов?
Как образуется двойная связь?
Какие реакции характерны для алкенов? Можно ли назвать алкены химически инертными? Почему?
Какие виды изомерии характерны для алкенов?
Что такое алкадиены? Приведите пример важнейшего природного соединения, которое относится к алкадиенам.
В чем особенность строения алкинов?
Как образуется тройная связь?
Какие реакции характерны для алкинов? Можно ли алкины назвать химически инертными? Почему?
Как часто встречаются непредельные углеводороды в природе? Почему?
Как получают непредельные углеводороды в промышленности и лаборатории?
