
- •Органическая химия. Тема: «Углеводороды» Лекция 4. Непредельные углеводороды. Этилен. Ацетилен.
- •5. Алкины – углеводороды с одной тройной связью. Общая формула алкинов - CnH2n-2.
- •2) Особые химические свойства этих углеводородов обусловлены наличием тройной связи.
- •4. Получение.
- •Прочитайте текст, найдите ответы на вопросы.
- •Выполните упражнения.
Органическая химия. Тема: «Углеводороды» Лекция 4. Непредельные углеводороды. Этилен. Ацетилен.
План.
1. Номенклатура алкенов. Изомерия двойной связи.
2. Состав и строение молекулы алкенов на примере этилена.
3. Свойства этилена и его гомологов. Понятие о полимерах.
4. Получение и применение. алкенов
5. Понятие о алкадиенах. Каучук натуральный и синтетический.
6. Номенклатура алкинов. Изомерия алкинов.
7. Состав и строение молекулы алкинов на примере ацетилена.
8. Свойства ацетилена и его гомологов.
9. Получение и применение.
1. Непредельными называют углеводороды, в которых есть хотя бы одна кратная (двойная или тройная) связь. Различают несколько гомологических рядов непредельных углеводородов: алкены, алкины, алкадиены и т.д.
Алкены – углеводороды, в молекулах которых есть одна двойная связь. Общая формула - CnH2n.
Номенклатура и изомерия алкенов.
Наличие двойной связи в молекуле указывается в названии заменой суффикса –ан в названии соответствующего алкана на суффикс –ен, после суффикса цифрой указывают номер атома углерода (меньший), около которого находится двойная связь. Например: СН3-СН2-СН=СН-СН3 –пентен-2.
Кроме изомерии углеродного скелета (см. предыдущую лекцию) для алкенов существует изомерия положения кратной связи. Например: CH3-CH2-CH=CH-CH3 u CH2=CH-CH2-CH2-CH3
Т.е. первая формула это пентен-2, а вторая – пентен-1.
Что касается непредельных радикалов, то чаще всего встречается –СН=СН2. Он называется винил.
К роме
того у
некоторых алкенов возможна и
пространственная
изомерия
(цис-транс-изомерия).
роме
того у
некоторых алкенов возможна и
пространственная
изомерия
(цис-транс-изомерия).
Т.е. порядок соединения атомов в молекуле этих изомеров одинаков (и у них одинаковые не только молекулярные, но и структурные формулы!), но в пространстве замещающие группы в молекулах изомеров располагаются по разному. В цис-изомерах заместители у разных атомов углерода находятся по одну сторону некоторой плоскости, в транс-изомерах заместители находятся по разные стороны некоторой плоскости.
Например: цис-бутен-2 и транс-бутен-2
2.Строение этена. (Традиционное название этого вещества - этилен.) Простейший алкен имеет состав С2Н4. Как же тогда сохраняется 4-валентность углерода?
А томы
углерода в молекуле этена находятся
в состоянии sp2-гибридизации.
томы
углерода в молекуле этена находятся
в состоянии sp2-гибридизации.
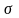 -связь
в молекуле этена образована за счет
перекрывания гибридных электронных
орбиталей на прямой соединяющей центры
атомов
-связь
в молекуле этена образована за счет
перекрывания гибридных электронных
орбиталей на прямой соединяющей центры
атомов
(С-С и С-Н). Связи направлены к вершинам правильного треугольника и угол между ними – 120о.
 Э
Э ти
треугольники образованные связями двух
атомов углерода лежат в одной плоскости.
ти
треугольники образованные связями двух
атомов углерода лежат в одной плоскости.
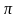 -связь
образована за счет перекрывания
негибридных р-орбиталей вне прямой
соединяющей центры атомов, перпендикулярно
плоскости в которой лежат
связи.
-связь
образована за счет перекрывания
негибридных р-орбиталей вне прямой
соединяющей центры атомов, перпендикулярно
плоскости в которой лежат
связи.
Структурную формулу этена записывают обычно СН2=СН2.
Аналогичное строение имеют все остальные члены гомологического ряда этена. У них у всех два соседних атома углерода находятся в состоянии sp2-гибридизации и между ними образуется двойная связь (остальные все атомы – в sp3). Надо помнить, что несмотря на то что в структурной формуле мы рисует одинаковые черточки, это связи разные. -связь более прочная, а -связь намного слабее и легко разрывается. Поэтому этен (и все алкены) являются химически активными веществами.
3. Характерные свойства алкенов.
По своим физическим свойствам алкены - это вещества без цвета и запаха, с низкой температурой кипения и плавления (даже более низкой, чем соответствующие алканы). Этилен (этен) – газ, пропен и бутен – тоже, но с увеличением молекулярной массы гомологов температура кипения и плавления будет повышаться, и среди алкенов появятся жидкости (С5-С15) и твердые вещества (как и у алканов). В воде алкены нерастворимы, но растворимы в органических растворителях.
Химические свойства. Алкены химически активны.
1) Легко окисляются. Горят на воздухе светящимся пламенем.
СН2=СН2 + О2 → СО2+ H2О
При мягком окислении (+ разб. раствор марганцовки при н.у.) из них образуются двухатомные спирты.
СН2=СН2 + KMnO4 + H2О => СН2OH-СН2OH + MnO2↓ +KOH , эту реакцию можно использовать как качественную реакцию на двойную связь, т.к. исчезает характерная окраска раствора марганцовки и выпадает бурый осадок оксида марганца.
2) Характерной реакцией алкенов является реакция присоединения АЕ.
А) Галогенирование
СН2=СН2 + Cl2 => CH2Сl-CН2Cl
СН2=СН-СН3 + Br2 => CH2Br-CНBr-CH3, эту реакцию можно использовать для определения двойной связи, т.к. происходит обесцвечивание бурого раствора бромной воды при н.у.
Б) Гидрирование
СН2=СН2 + Н2 => CH3-CН3
СН2=СН-СН3 + H2 => CH3-CН2-CH3
Реакция протекает по ионному механизму в несколько стадий. На первой стадии электрофильная частица (протон) взаимодействует с -электронами двойной связи и образует -комплекс, который затем превращается в карбкатион путем образования ковалентной -связи между этим водородом и одним из атомов углерода. На второй стадии карбкатион взаимодействует с анионом и образуется вторая -связь между анионом и вторым атомом углерода.
Ион водорода в реакциях электрофильного присоединения направляется к тому атому углерода при двойной связи, у которого больше отрицательный заряд. Распределение зарядов зависит от влияния заместителей. Если заместитель – углеводородный радикал, то электронная плотность смещена к более удаленному (и более гидрогенизированному) атому С. Если заместитель содержит электроотрицательный атом, то электронная плотность смещается к ближнему атому С. Этим и объясняется правило Марковникова: При присоединении полярных молекул к несимметричным алкенам водород присоединяется к более гидрогенизированному атому углерода при двойной связи. Например:
В) Гидрогалогенирование
СН2=СН2 + H/:Cl => CH3-CН2Cl
СН2=СН-СН3 + HCl => CH3-CНCl-CH3
Г) Гидратация
СН2=СН2 + H/-ОН => CH3-CН2ОН
СН2=СН-СН3 + H2О => CH3-CНОН-CH3
3) Еще одной реакцией, характерной для непредельных углеводородов, является реакция полимеризации этилена (и др. алкенов). Она протекает в присутствии ионов водорода тоже по этому механизму, просто присоединяется не молекула водорода или воды, а такая же молекула этена:
n
СН2=СН2
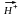 [-CH2-CH2-]n
– полиэтилен, твердое полупрозрачное
бесцветное вещество, жирное на ощупь.
[-CH2-CH2-]n
– полиэтилен, твердое полупрозрачное
бесцветное вещество, жирное на ощупь.
n СН2=СН-R [-CH2-CH(R)-]n , молекула СН2=СН-R называется мономером, -CH2-CHR- структурное звено, [-CH2-CHR-]n -полимер, n – степень полимеризации.
Нахождение в природе: Алкены в небольшом количестве входят в состав нефти.
Получение алкенов.
1) В промышленности: реакция дегидрирования этана или другого соответствующего алкана при повышенной температуре в присутствии катализатора (оксида хрома) (крекинг попутного газа). СН3-СН3 → СН2=СН2+Н2
2)В лаборатории чаще получают из этанола (реакция дегидратации при нагревании в присутствии концентрированной серной кислоты) или другого соответствующего спирта, или из дигалоидпроизводных производных путем отщепления галогенов в присутствии активных металлов (магний) или моногалоидных производных путем отщепления галогеноводородов в спиртовом растворе щелочи.
СН3-СН2ОН
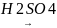 СН2=СН2+Н2О
СН2=СН2+Н2О
СН3-СН2Cl
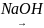 СН2=СН2+НCl
СН2=СН2+НCl
СН2Cl-СН2Cl
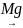 СН2=СН2+
Cl2
СН2=СН2+
Cl2
Применение. Алкены используют для получения полимеров, галогенпроизводных и спиртов.
4. Алкадиены или просто диены – это углеводороды, содержащие две двойные связи. Если эти двойные связи разделены двумя и более одинарными связями, тогда эти вещества ведут себя как обычные алкены. Если связи находятся рядом (С=С=С) – образуются т.н. аллены. Но наибольшее практическое значение имеют диены с сопряженными π-связями (разделенными одной σ-связью). В сопряженных диенах π-облака перекрываются между собой, образуя единое электронное облако на четыре атома углерода, двойные связи делокализованы. Поэтому при присоединении одной молекулы галогена реакция может проходить или с одной из двойных связей, или в крайние положения, а двойная связь образуется в центре сопряженной системы. В реакции полимеризации из таких диенов образуются полимеры, имеющие двойные связи. Они обладают повышенной эластичностью, водо- и газонепроницаемостью, называются такие полимеры - каучуки. Большую часть каучуков подвергают процессу вулканизации и превращают в резину. По своему значению для промышленности резина стоит рядом со сталью, углем, нефтью.
Первый синтетический каучук (СК-1) синтезировал Сергей Лебедев ((1932 г) из бутадиена-1,3. Сам диен синтезировали из спирта - этанола.
nСН2=СН-СН=СН2 → [-СН2-СН=СН-СН2-]n
Существуют разные синтетические каучуки. Они превосходят натуральный по механической прочности, износостойкости, устойчивости к агрессивным средам… Но самой высокой эластичностью по-прежнему обладает натуральный каучук.
Природный каучук - полимер стереорегулярного строения. Мономером является цис- 2-метилбутадиен-1,3 (изопрен), молекула полимера свернута в спираль, которая может растягиваться. Использование металлоорганических катализаторов позволило синтезировать каучук с таким же стереорегулярным расположением остатков цис- 2-метилбутадиен-1,3 как у натурального. Свойства у него такие же как у натурального, но чтобы их отличать, синтетический «натуральный» каучук называют изопреновым.
