
- •Органическая химия. Тема: «Углеводороды» Лекция 3. Предельные углеводороды. Метан.
- •Как и все органические вещества алканы горят. Например, метан горит
- •2) Как и все органические вещества метан при нагревании без доступа воздуха подвергается термическому разложению (крекингу). Крекинг – дегидрирование (отщепление водорода) при высокой температуре.
- •Классификация органических реакций
- •По электронной природе реагента: нуклеофильные электрофильные, свободнорадикальныее, протоннодонорные, окисление…
- •По механизмам элементарных стадий: нуклеофильное замещение sn, электрофильное замещение se, электрофильное присоединение ae, свободнорадикальное замещение sr…
- •4) Реакция изомеризации (возможна если в цепи 4 и более атомов углерода). Она проходит при высокой температуре, в присутствии катализатора (платина).
- •Применение алканов и их галогенопроизводных.
- •Задания для самостоятельной работы.
Органическая химия. Тема: «Углеводороды» Лекция 3. Предельные углеводороды. Метан.
1. Метан: строение, физические и химические свойства, нахождение в природе, применение.
2. Гомологический ряд алканов: особенности строения, номенклатура, свойства, закономерности в изменении свойств.
3. Понятие о циклоалканах.
Углеводороды – органические соединения, в состав которых входит только два химических элемента – углерод и водород. Как и все органические соединения их делят на алифатические и циклические. Кроме того, их делят на предельные (насыщенные) и непредельные (ненасыщенные) углеводороды. А среди циклических выделяют еще особую группу ароматических углеводородов. Изучение органической химии всегда начинается с предельных углеводородов.
Метан (СН4 ) - простейший представитель предельных углеводородов. Рассмотрим гомологический ряд метана. Гомологи метана называют алканами, а также предельными и насыщенными углеводородами, потому что все связи в них одинарные (σ-связи ) и к атомам углерода присоединено максимально возможное число атомов водорода. Общая формула алканов – СnH2n+2
Строение.
Данные
физико-химического анализа говорят о
том, что молекула метана имеет форму
тетраэдра, и все четыре связи углерода
с атомами водорода равноценны. Вы
 ше
мы рассматривали понятие гибридизации
и ее виды. Если атом углерода находится
в состоянии sp3
– гибридизации, то все четыре гибридные
орбитали могут перекрываться с орбиталями
атомов водорода на прямой, связывающей
центры атомов углерода и водорода. Они
образуют прочные
ше
мы рассматривали понятие гибридизации
и ее виды. Если атом углерода находится
в состоянии sp3
– гибридизации, то все четыре гибридные
орбитали могут перекрываться с орбиталями
атомов водорода на прямой, связывающей
центры атомов углерода и водорода. Они
образуют прочные
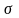 -связи
(сигма-связи).
-связи
(сигма-связи).
Е


 сли
хотя бы одна из гибридных орбиталей
углерода образует связь не с водородом,
а с гибридной орбиталью другого атома
углерода, то получается молекула очень
похожая по строению на метан, но немного
длиннее. Таким образом, может соединиться
практически любое число атомов углерода,
находящихся в sp3-гибридном
состоянии. Углы между связями 109о,
поэтому в пространстве молекулы будут
принимать зигзагообразную форму или
другую форму, т.к. вокруг одинарной
σ-связи возможно свободное вращение.
сли
хотя бы одна из гибридных орбиталей
углерода образует связь не с водородом,
а с гибридной орбиталью другого атома
углерода, то получается молекула очень
похожая по строению на метан, но немного
длиннее. Таким образом, может соединиться
практически любое число атомов углерода,
находящихся в sp3-гибридном
состоянии. Углы между связями 109о,
поэтому в пространстве молекулы будут
принимать зигзагообразную форму или
другую форму, т.к. вокруг одинарной
σ-связи возможно свободное вращение.
Но при изображении структурных формул это не учитывают, а показывают только порядок соединения атомов углерода: СН3-СН2-СН2-СН3. Каждый из последующих углеводородов будет отличаться от предыдущего на группу СН2, которую называют гомологической разностью. Связи в молекуле метана прочные, ковалентные, малополярные. И, поскольку смещение направлено от вершин тетраэдра в центр фигуры, равнодействующая будет равна 0. А это значит молекула метана неполярна, несмотря на полярность, пусть и слабую связей С-Н. Кристаллическая решетка алканов молекулярная и между молекулами очень слабое взаимодействие.
Номенклатура алканов. Названия алканов приведены в таблице в лекции №1. Если надо подчеркнуть неразветвленный характер цепи, то перед названием ставят букву n. Боковые цепи (углеводородные радикалы) называют как алканы, заменяя суффикс –ан, на -ил. Их перечисляют в алфавитном порядке, множительные приставки при этом не учитывают. Между цифрами ставят запятую, между цифрой и словом – дефис. 2,3-диметилбутан 2,4-диметил-3-этилгексан


Физические свойства. Метан – это газ, без цвета и запаха, температура кипения (-168 С0), почти в 2 раза легче воздуха. В воде не растворим, но растворим в органических растворителях. Рассмотрим таблицу, в которой приведены формулы и свойства первых десяти членов ряда алканов
формула |
СН4 |
С2Н6 |
С3Н8 |
С4Н10 |
С5Н12 |
С6Н14 |
С7Н16 |
С8Н18 |
С9Н20 |
С10Н22 |
плавление кипение |
-182 -162 |
-183 -89 |
-187 -42 |
-138 -0,5 |
-130 +36 |
-95 +69 |
-91 +98 |
-57 +126 |
-54 +151 |
-30 +174 |
По данным таблицы видно, что с увеличением молекулярной массы возрастают температуры кипения и плавления. Т.е. при обычных условиях первые четыре гомолога (С1-С4) являются газами. Нормальные алканы с С5-С17 жидкости, с более длинной углеродной цепью – твердые вещества. При одинаковом числе атомов углерода алканы с разветвленным строением имеют менее плотную упаковку и более низкие температуры кипения, чем нормальные алканы. В воде алканы не растворяются, но хорошо смешиваются друг с другом и с другими неполярными растворителями. Плотность у них меньше, чем у воды.
Химические свойства. В обычных условиях алканы инертны, не взаимодействует с концентрированными кислотами и щелочами, не окисляется сильными окислителями. Русский химик М.И.Коновалов назвал их «химическими мертвецами».
