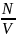- •Iі. Термодинамика негіздері
- •VI. Газдағы изопроцесстер және олардың графиктерi.
- •1.Дененің ішкі энергиясы. Жылу мөлшері.
- •Меншікті булану жылуы деп 1 кг сұйықты қайнау температурасында буға айналдыруға қажетті жылуды айтады.
- •2.Жылу процестеріндегі энергияның сақталу және айналу заңы.
- •3.Жылу берілудің түрлері. Жылуөткізгіштік.
- •4. Термодинамиканың бірінші заңы.
- •5. Термодинамиканың бірінші заңын изопроцестерге қолдану
- •1. Қаныққан және қанықпаған булар.
- •2.Ауаның ылғалдылығы және оны өлшеу.
- •3. Беттiк керiлу
- •4.Қыл түтiктiк құбылыстар.
- •5.Кристалдық және аморфтық денелердiң құрылысы. Анизотропия
- •6. Қатты денелер деформацияларының түрлерi. Механикалық кернеу. Гук заңы. Юнг модулi
Жылу құбылыстары
І. Молекулалы – кинетикалық теорияның (МКТ) негіздері.
1.МКТ-ның негізгі қағидалары.
№ |
МКТ-ның негізгі қағидалары |
1 |
барлық денелер бөлшектерден – атомдардан, молекулалардан, оң және терiс зарядталған иондардан – тұрады; |
2 |
бұл бөлшектер барлық уақытта үздiксiз және бейберекет қозғалыста болады; |
3 |
бөлшектер арасында өзара әсерлесу күштерi – тартылу және тебiлу күштерi бар. |
2. Тұрақты шамалар:
Авогадро саны: NA ≈ 6·1023 моль-1 -кез келген заттың 1 молiнде атомдар саны мен молекулалар саны бiрдей (6·1023 молекула) болады.
Больцман тұрақтысы: k = 1,38·10-23Дж/К.
Больцман тұрақтысының k Авогадро санына NA көбейтiндiсiн универсал газ тұрақтысы деп атап, R әрпiмен белгiлейдi:
R = k* NA = 8,31 Дж/(моль·К).
3. Физикалық шамалар.
Физикалық шамалар |
Анықтамалар |
1.Заттың салыстырмалы молекулалық массасы.
2.Зат мөлшері.
3.Заттың мольдік массасы.
4.Молекулалар концентрациясы. |
1. Берілген зат молекуласы массасының көміртек атомы массасының 1/12 бөлігінен қанша есе артық екенін көрсететін физикалық шама.
2. Берілген денедегі молекулалар саны 12 г көміртек атомдары санынан қанша есе артық болатынын көрсететін физикалық шама.
3. 1 мольдің мөлшерінде алынған заттың массасы.
4. Заттың бірлік көлемінде қанша микробөлшек бар екенін көрсететін физикалық шама. |
№ |
Физикалық шамалардың аталуы |
Белгіленуі |
Өлшем бірлігі |
Формуласы |
1 |
Мольдік (молярлық) масса |
М |
кг/моль. |
М = m0· NA; М = 10-3 ·Мr кг/моль. |
2 |
Салыстырмалы молекулалық масса |
МR |
г/моль. |
|
3 |
Молекула саны |
N |
- |
N = ν ·NA. |
4 |
Кез келген зат мөлшерiнiң массасы |
m |
кг |
m = m0· N |
5 |
Зат мөлшерi |
ν (ню) |
моль |
ν = m / М; ν = N / NA |
6 |
Орташа квадраттық жылдамдық |
|
м/с |
|
7 |
Молекулалар концентрациясы. |
n |
м-3 |
n
=
|
4. МКТ- ның негізгі теңдеуі.

-![]() абсолюттi
температура газ молекулаларының жылулық
қозғалысының орташа кинетикалық
энергиясының өлшемi
болып табылады.
абсолюттi
температура газ молекулаларының жылулық
қозғалысының орташа кинетикалық
энергиясының өлшемi
болып табылады.
Температураның абсолюттi нөлi (Т = 0 К) деп молекулалық қозғалыстардың тоқтаған кезiн (E = 0) айтады. Бұл табиғаттағы ең төмен температура. Абсолюттi T температура мен Цельсий шкаласы бойынша t температураның арасындағы байланыс :
Т = t+273
Идеал газ деп молекулалардың өзара әсерлесуi ескерусiз аз шама болғандағы газды айтады.
5.
Менделеев-Клапейронның
күй теңдеуi : pV
=
 pV
=
pV
=

6. Газдағы изопроцесстер және олардың графиктерi.
|
|
Газдың үшiншi параметрi тұрақты болған кездегi екi параметрi арасындағы мөлшерлiк байланысты (тәуелдiлiктi) газ заңдары деп атайды.
1).Температура тұрақты болған кезде термодинамикалық жүйе күйiнiң өзгеру процесiн изотермиялық процесс деп атайды.
Бұл процесс Бойль - Мариотт заңмен жазылады: PV = const

2). Қысым тұрақты болған кезде термодинамикалық жүйе күйiнiң өзгеру процесiн изобаралық процесс деп атайды.
Гей-Люссак заңы:V1/T1 = V2/T2 = const

3). Көлем тұрақты болған кезде термодинамикалық жүйе күйiнiң өзгеру процесiн изохоралық процессс деп атайды.
Шарль заңы: P1/T1 = p2/T2 = const
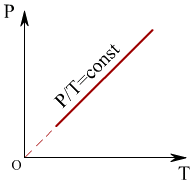
Жаттығу: Идеал газдың 1-ші күйден 4-ші күйге өтуі: 1→.... 2→.... 3→... 4→... .

|
|
Iі. Термодинамика негіздері
1.Дененің ішкі энергиясы. Жылу мөлшері.
Молекулалық-кинетикалық теория көзқарасынан макроскопиялық дененiң iшкi энергиясы барлық молекулалардың ретсiз қозғалыстарының кинетикалық энергиялары мен олардың бiр-бiрiмен өзара әсерiнiң потенциалдық энергияларының қосындысына тең.
Q-жылу мөлшері - ішкі энергияның жылу берілу кезінде өзгеруінің өлшемі.
Өзара жылулық тепе-теңдiкте тұрған жүйенiң барлық денелерiнiң температуралары бiрдей болады.
Денені қыздыру үшін қажет жылу мөлшері: Q=сm ∆t. Меншікті жылу сыйымдылық – с.
Отынның энергиясы. Меншікті жану жылуы – q. Кез-келген массасы m отын толық жанғанда бөлінетін Q жылу мөлшері: Q=qm
Балқу және қатаю кезіндегі ішкі энергияның өзгеруі. Меншікті балқу жылуы – λ.
Кез-келген массасы m затты балқыту үшін қажет болатын Q жылу мөлшері: Q=λm
Булану және конденсация. Меншікті булану жылуы – r.
Кез-келген массасы m затты буға айналдыру үшін қажет болатын Q жылу мөлшері: Q=rm
Сұйықтың газ тәрізді күйге өтуінің екі тәсілі бар: булану және қайнау
Кез келген температурада және тек сұйық бетiнен шығып бу күйiне айналуды – булану деп атайды.
Бу – буланудың әсерiнен пайда болатын газ. Сұйықтың буға айналу құбылысы булану деп аталады.
Қатты денелердің булануы сублимация деп аталады.
Булану барысында сұйық салқындайды, өйткені булану кезінде жылу жұтылады.
Сұйықтың бетінде жүретін булану кебу деп аталады. Сұйықтың барлық көлемінде және тұрақты температурада өтетін булану қайнау деп аталады.
t0C Q=rm











 t,
мин
t,
мин
2. Жылу процестеріндегі энергияның сақталу және айналу заңы.
Жылу балансының теңдеуі: Q1 + Q2 + Q3 +… = 0.
Q1 = Q2; Q1 –ыстық судың берген жылу мөлшері, Q2 – суық судың алған жылу мөлшері.
Энергияның сақталу және айналу заңы: Энергия жоғалмайды және жоқтан пайда болмайды. Ол тек бір денеден екінші денеге беріледі немесе бірдей мөлшерде бір түрден екінші түрге айналады. Жылу мөлшері бір денеден екінші денеге өткенде сақталады. Е = W + U =Eк + Eп + U, мұндағы Е– денелер жүйесінің толық энергиясы, W – механикалық энергия, U – ішкі энергия.
3.Ішкі энергия
Ішкі энергия - денені құрайтын молекулалардың ілгерілемелі және айналмалы қозғалыстарының кинетикалық энергиясы, олардыңөзара әрекеттесуі кезіндегі потенциалдық энергиясы және молекулалардағы атомдардың тербелмелі қозғалысының энергиясы және атомды түзетін бөлшектердің қозғалыс , өзара әрекеттесу энергиясы.
4. Жылу берілудің түрлері.
Жылу берілудің үш түрі бар: жылуөткізгіштік, конвекция, сәуле шығару.
Қатты денелерде және вакуумда конвекция болмайды
5. Термодинамиканың бірінші заңы.
Термодинамиканың бірінші заңы: Q=∆U+A.
Мұндағы Q - жылу мөлшері, ∆U – ішкі энергия өзгерісі, A – жұмыс
Термодинамикадағы жұмыс: А= p·(V2-V1) = p·ΔV.
Бiр
атомды газдың iшкi энергиясы:
U
=

6. Термодинамиканың бірінші заңын изопроцестерге қолдану
Процестің аталуы |
Процесс кезінде өзгермейтін шама |
Термодинамиканың бірінші заңының қолданылуы |
Процестің сипаты |
Изобаралық |
Қысым (Р) |
Q=∆U+A
|
Газдың қысымы өзгермейді.Газға берілген жылу мөлшері осы газдың жұмыс атқаруы мен ішкі энергиясының өзгерісіне жұмсалады |
Изохоралық |
Көлем (V)
|
Q=∆U
|
Газға берілген жылу мөлшері газдың ішкі энергиясының өзгерісіне жұмсалады |
Изотермияллық |
Температура (Т)
|
Q=A
|
Газға берілген жылу мөлшері газдың жұмыс атқаруына жұмсалады |
Адиабаталық |
Жылу мөлшері: Q=O |
∆U = -A
|
Жылу алмасусыз өтеді |
7. Жылу машиналарының пайдалы әсер коэффициенті ( ПӘК- ή -эта):
ή=
 ,
A=Q1
-
Q2
, ή =
,
A=Q1
-
Q2
, ή =

мұндағы Q1 – қыздырғыштан алынған жылу мөлшері, Q2 – тоңазытқышқа берілген жылу мөлшері
|
|
ή=
 ,
,
мұндағы Т1 – қыздырғыштың температурасы, Т2 – тоңазытқыштың температурасы .
ή<1 немесе ή<100 0/0 болады.
ІІІ. Газ тектес, сұйық және қатты денелердiң қасиеттерi
1. Қаныққан және қанықпаған булар.
Өз сұйығымен динамикалық тепе-теңдікте болатын буды қаныққан бу деп атайды. Басқаша айтқанда, булану конденсацияға тең болған жағдайдағы бу қаныққан бу деп аталады. Өз сұйығымен динамикалық тепе-теңдікте болмайтын буды қанықпаған бу деп атайды.
Температура өзгермеген жағдайда сұйықтың қаныққан буының қысымы өзгермейді.
Температура жоғарылаған сайын сұйықтың қаныққан буының қысымы мен тығыздығы артады.
2.Ауаның ылғалдылығы.
Ауадағы су мөлшері ауаның ылғалдылығы деп аталады. Салыстырмалы ылғалдықты өлшеу үшiн арнайы психрометр деп аталатын прибор қолданылады. Ауадағы су буы р қысымының берілген температурадағы қаныққан бу рқ қысымына қатынасы және пайызбен өрнектелетін шаманы ауаның φ (фи) салыстырмалы ылғалдылығы деп атайды.
Ауаның
салыстырмалы ылғалдылығын есептейтін
формула:
φ
=
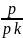 ·
100 %
·
100 %
3. Кристалдық және аморфтық денелер. Анизотропия. Кристалдар дегеніміз атомдары немесе молекулалары кеңістікте белгілі орын алып, реттеліп орналасқан заттың күйі. Атомдары немесе молекулалары реттелiп орналасқан және периодты түрде қайталанып тұратын iшкi структурасын түзетiн қатты денелер кристаллдар деп аталады. |
Кристалдардың ең басты ерекшелiгi кристалдың физикалық қасиеттерiнiң ондағы таңдалған бағытына байланыстылығында. Кристалдардың бұл қасиетi анизотропия деп аталады. Барлық кристалды денелер анизотропты болып келедi. Көптеген кiшкентай кристаликтерден тұратын қатты дене поликристалдық дене деп аталады.
Аморфтық денелер де қатты денелер қатарына жатады, бiрақ оларда кристалдарға тән, стуктураның сол фрагментiндегi барлық бағыттар бойынша қайталанушылық жоқ. Аморфтық денелерге шыны, пластмасса, шайыр, смола және т.б. жатады. Барлық аморфты денелер изотропты болып келедi, яғни олардың физикалық қасиеттерi барлық бағытта бiрдей деген сөз. Аморфтық денелердiң кристалдық денелерге қарағандағы бiр ерекшелiгi сонда, олардың белгiлi бiр балқу температурасы болмайды.
І. Молекулалы – кинетикалық теорияның (МКТ) негіздері.
1.МКТ-ның негізгі қағидалары.
№ |
МКТ-ның негізгі қағидалары |
МКТ-ның осы қағидаларын дәлелдейтін деректер. |
1 |
барлық денелер бөлшектерден – атомдардан, молекулалардан, оң және терiс зарядталған иондардан – тұрады; |
қазiргi заманғы приборлар көмегiмен алынған жеке атомдар мен молекулалар кескiнi
|
2 |
бұл бөлшектер барлық уақытта үздiксiз және бейберекет қозғалыста болады; |
броундық қозғалыс құбылысы , диффузия құбылысы;
|
3 |
бөлшектер арасында өзара әсерлесу күштерi – тартылу және тебiлу күштерi бар. |
денелердің беріктігі, денелердің серпімді деформациялық қасиеттерінің байқалуы, беттері тегістеліп, бір-біріне түйістірілген қорғасын цилиндрлердің бір-біріне жабысып қалуы
|
ІІ. Тұрақты шамалар:
Авогадро саны: NA ≈ 6·1023 моль-1
-кез келген заттың 1 молiнде атомдар саны мен молекулалар саны бiрдей (6·1023 молекула) болады.
Больцман тұрақтысы: k = 1,38·10-23Дж/К.
Больцман тұрақтысының k Авогадро санына NA көбейтiндiсiн универсал газ тұрақтысы деп атап, R әрпiмен белгiлейдi:
R = k* NA = 8,31 Дж/(моль·К).
ІІІ. Физикалық шамалар.
Физикалық шамалар |
Анықтамалар |
1.Заттың салыстырмалы молекулалық массасы.
2.Зат мөлшері.
3.Заттың мольдік массасы.
4.Молекулалар концентрациясы. |
1. Берілген зат молекуласы массасының көміртек атомы массасының 1/12 бөлігінен қанша есе артық екенін көрсететін физикалық шама. 2. Берілген денедегі молекулалар саны 12 г көміртек атомдары санынан қанша есе артық болатынын көрсететін физикалық шама. 3. 1 мольдің мөлшерінде алынған заттың массасы. 4. Заттың бірлік көлемінде қанша микробөлшек бар екенін көрсететін физикалық шама. |
№ |
Физикалық шамалардың аталуы |
Белгіленуі |
Өлшем бірлігі |
Формуласы |
1 |
Мольдік (молярлық) масса |
М |
кг/моль. |
М = m0· NA М = 10-3 ·Мr кг/моль. |
2 |
Салыстырмалы молекулалық масса |
МR |
г/моль. |
|
3 |
Молекула саны |
N |
- |
N = ν ·NA. |
4 |
Кез келген зат мөлшерiнiң массасы |
m |
кг |
m = m0· N |
5 |
Зат мөлшерi |
ν (ню) |
моль |
ν = m / М, ν = N / NA |
6 |
Орташа квадраттық жылдамдық |
|
м/с |
|
7 |
Молекулалар концентрациясы. |
n |
м-3 |
n = |
IV. МКТ- ның негізгі теңдеуі.
-абсолюттi температура газ молекулаларының жылулық қозғалысының орташа кинетикалық энергиясының өлшемi болып табылады.
Температураның абсолюттi нөлi (Т = 0 К) деп молекулалық қозғалыстардың тоқтаған кезiн (E = 0) айтады. Бұл табиғаттағы ең төмен температура. Абсолюттi T температура мен Цельсий шкаласы бойынша t температураның арасындағы байланыс Т = t+273 теңдiгiмен берiледi.
Идеал газ деп молекулалардың өзара әсерлесуi ескерусiз аз шама болғандағы газды айтады.
V. Менделеев-Клапейронның күй теңдеуi
pV = mkNAT/M.
pV = mRT/M.
P1V1/T1 = p2V2/T2 = const,