
§ 5. Гидролиз
Аналитику необходимо иметь представление о качественной и количественной характеристике гидролиза солей для каждого отдельного случая, а именно:
1) о константе гидролиза Кгидр,
2) о степени гидролиза,
3) о значении рН среды при гидролизе солей.
Гидролиз по катиону
Константа гидролиза.
Рассмотрим гидролиз бинарной соли NH4Cl.
В ионной форме уравнение гидролиза имеет вид
![]()
Применив закон действующих масс, получим выражение константы гидролиза:
![]()
Подставляем
в уравнение
![]() ,
где
,
где
![]() —ионное
произведение воды.
—ионное
произведение воды.
![]()
(Ko – константа электролитической диссоциации слабого основания)
![]()
Константа гидролиза бинарных солей, образованных катионами слабых оснований и анионами сильных кислот, представляет отношение ионного произведения воды к константе электролитической диссоциации слабых оснований, образующихся в процессе гидролиза.
Степень гидролиза h.
Степень гидролиза соли, гидролизующейся по катиону, выражается отношением концентрации гидролизированной части соли к ее общей концентрации. Степень гидролиза пропорциональна корню квадратному из константы гидролиза и обратно пропорциональна корню квадратному из молярной концентрации соли:
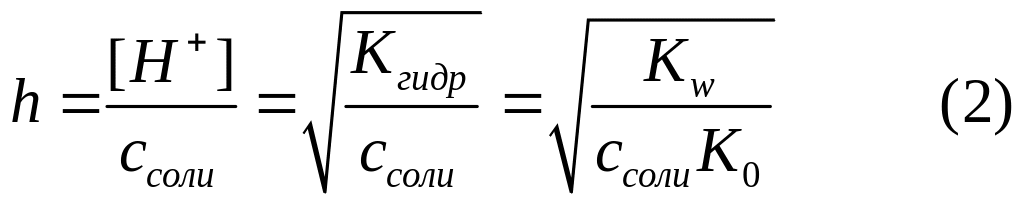
Это равенство легче понять после следующего пояснения.
Поскольку в уравнении реакции гидролиза NH4Cl концентрация NH4OH и ионов Н+ совпадают, степень гидролиза можно выразить отношением
![]()
Но так как концентрация ионов Н+ определяется формулой
![]()
то, следовательно,
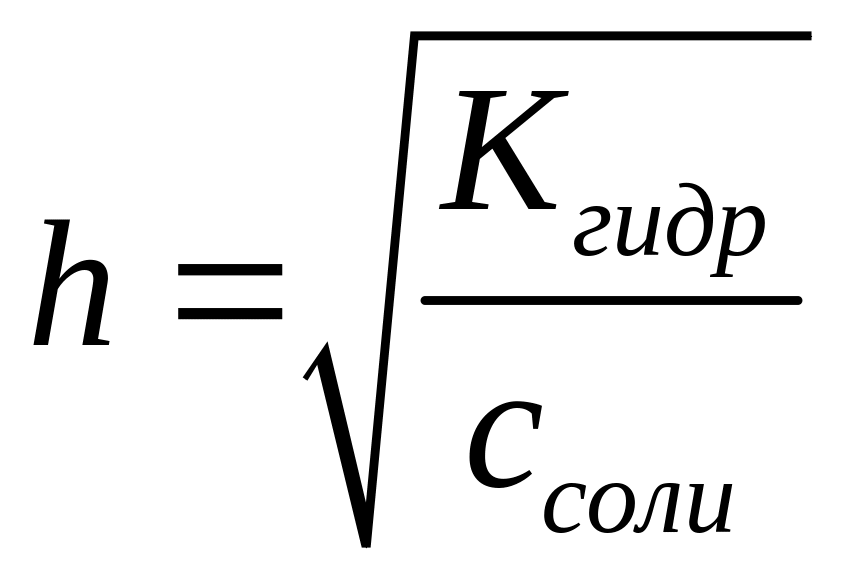
В свою очередь,
![]()
поэтому
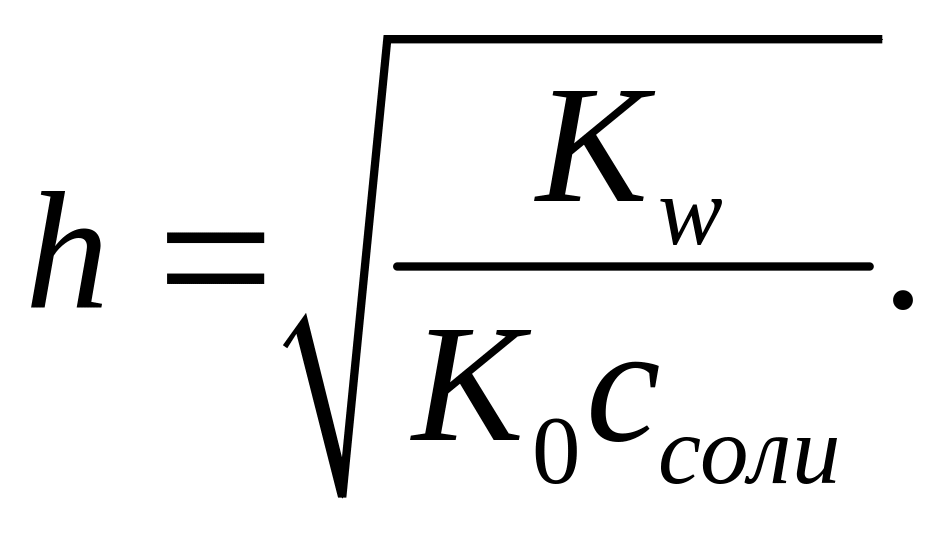
Степень гидролиза в процентах вычисляют по уравнению
![]()
Вычисление Н+ и рН в солях, образованных катионами слабых оснований и анионами сильных кислот.
Реакцию гидролиза NH4Cl выразим уравнениями:
NH4Cl+H20 ⇄ NH40H + HCl
NH4+ + Н20 ⇄ NH4OH + Н+
В уравнении имеются два слабодиссоциирующих соединения: Н20 и NH4OH. По закону действующих масс можно написать для этих соединений два уравнения:

Разделим второе уравнение на первое:
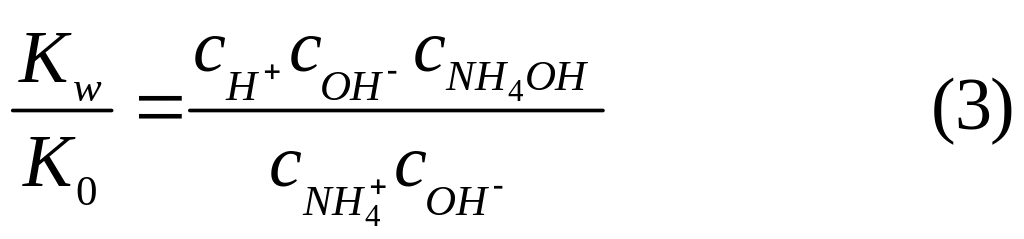
Преобразуем
уравнение. По стехиометрическому
уравнению 1 моль NH4OH
соответствует 1 моль Н+
, т.е. вместо
![]() подставим концентрацию ионов Н+
. Величина
подставим концентрацию ионов Н+
. Величина
![]() при диссоциации NH4OH
незначительна, ею можно пренебречь и
заменить ее концентрацией взятой соли
(ссоли),
тогда
при диссоциации NH4OH
незначительна, ею можно пренебречь и
заменить ее концентрацией взятой соли
(ссоли),
тогда
![]()
Но
так как
![]() имеем
имеем
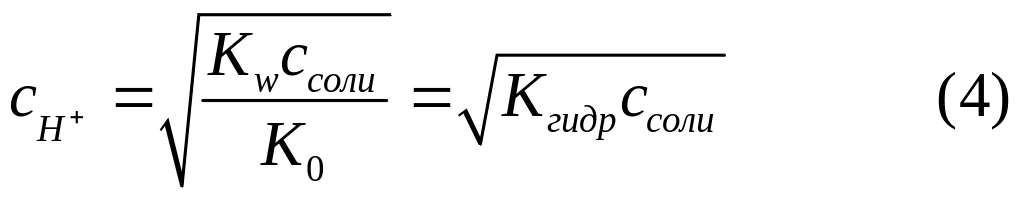
Таким образом, получили формулу для определения [Н+] в водных растворах солей, гидролизующихся по катиону.
По ней концентрация ионов водорода в водном растворе солей, образованных слабыми основаниями и сильными кислотами, равна корню квадратному из произведения константы гидролиза на молярную концентрацию соли.
рН таких солей вычисляют по формуле
![]()
При гидролизе солей, образованных многозарядными катионами, например FeCl3, Cr2(S04)3 и другими, происходит ступенчатый гидролиз с образованием основных солей.
FeCl3 + HOH ⇄ Fe(OH)Cl2 + HCl (I ступень)
Fe(OH)Cl2 + HOH ⇄ Fe(OH)2Cl + HCl (II ступень)
Fe(OH)2CI + НОН ⇄ Fe(OH)3 + HC1 (III ступень)
В основном он протекает по первой и второй ступеням.
Гидролиз по аниону
Константа гидролиза.
Рассмотрим гидролиз бинарной соли:
KCN+Н20 ⇄ КОН + HCN
CN-+Н20 ⇄ ОН- + HCN
. В соответствии с законом действующих масс напишем константу гидролиза:
![]()
Подставляем
в уравнение
![]() и учитывая, что
и учитывая, что
![]() получим уравнение
константы гидролиза:
получим уравнение
константы гидролиза:
![]()
Константа гидролиза бинарных солей, образованных катионами сильного основания и анионами слабых кислот, равна отношению ионного произведения воды к константе электролитической диссоциации слабой кислоты, образующейся в процессе гидролиза.
Степень гидролиза.
Степень гидролиза соли, гидролизующейся по аниону, выражается отношением концентрации гидролизиро-ванной части соли к общей ее концентрации. Степень гидролиза пропорциональна корню квадратному из константы гидролиза и обратно пропорциональна корню квадратному из молярной концентрации соли:
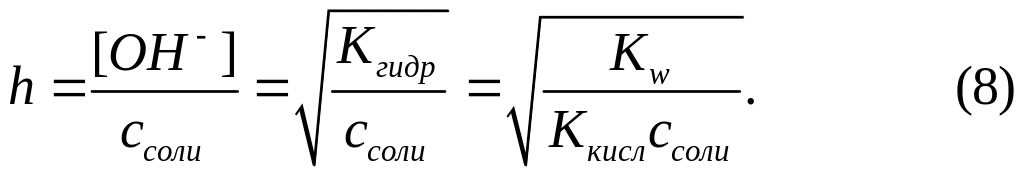
Вычисление [H+], [OH-] и рН в солях, образованных катионами сильных оснований и анионами слабых кислот.
Реакцию гидролиза KCN выразим уравнениями:
KCN+Н20 ⇄ КОН + HCN
CN-+Н20 ⇄ ОН + HCN
По закону действующих масс напишем уравнения констант для слабых электролитов:

Разделим второе уравнение на первое:

Преобразуем
уравнение. Заменим 1 моль HCN
на 1 моль ОН-,
a
![]() обозначим через концентрацию соли
обозначим через концентрацию соли
![]() (по аналогии с гидролизом NH4Cl):
(по аналогии с гидролизом NH4Cl):
![]()
Отсюда

Зная,
что
![]() получим уравнение
для расчета
получим уравнение
для расчета
![]() в солях, гидролизуемых по аниону:
в солях, гидролизуемых по аниону:
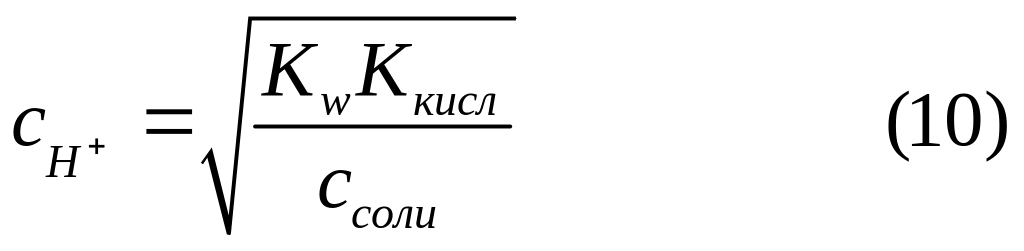
Значение рН для таких солей находим по формуле
![]()
При гидролизе солей типа Na2C03 происходит ступенчатый гидролиз с образованием кислых солей:
Na2C03 + HOH ⇄ NaHC03 + NaOH (I ступень) NaHC03 + HOH ⇄ H2C03+NaOH (II ступень)
