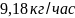Практическое занятие № 3
Тема: Производство азотной кислоты.
Цель: Выполнить расчеты, связанные с процессом контактного окисления аммиака.
Задание: Произвести материальные и тепловые расчеты, связанные с процессом контактного окисления аммиака и составить таблицы материального и теплового балансов.
Данные для расчета:
1. Производственная мощность цеха и степень контактирования взяты из таблицы:
Данные |
Вариант |
||||
1 |
2 |
3 |
4 |
5 |
|
Производственная мощность цеха 240000 245000 25000 255000 260000 265000 |
|
245000 |
|
|
|
Степень контактирования (%) |
96 |
96,5 |
97 |
97,5 |
98 |
2. Степень кислой абсорбции 0,98.
3. Эффективное время работы аппарата Тзф = 8496 часов.
4. Содержание аммиака в АВС - 11%
Расчет.
1.Определим часовую производительность цеха по кислоте:
g=Gц/Тэф, т/час;
g=
2. Рассчитаем число аппаратов, необходимых для обеспечения заданной производительности. Принимаем к установке контактный аппарат производительностью 65- 72 м/сутки по кислоте. Тогда количество аппаратов:
 ;
;
n= =9,6
=9,6
Округлим полученное значение n1 до ближайшего целого, получим число аппаратов n.
3.Определим фактическую производительность одного аппарата:
 ,
кг/час
,
кг/час
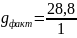 =28,8
кг/час
=28,8
кг/час
На эту величину выполняем расчет.
4.Определим расход аммиака на обеспечение фактической производительности аппарата:
NH3 -------- HNO3
17 -------- 63
V
NH3* *0.98
--------
*0.98
--------
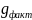

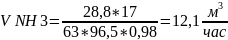
где
 - заданная степень контактирования, в
долях единицы;
- заданная степень контактирования, в
долях единицы;
- часовая производительность аппарата по кислоте, кг/час;
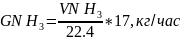

где 17 - молярная масса аммиака;
5.Определим объем воздуха, необходимого для окисления аммиака:
V NH3 -------- 11%
Vвозд -------- 89%

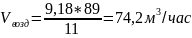
Заполнить таблицу по варианту и сделать вывод
Вариант |
1 |
2 |
3 |
4 |
5 |
Расход аммиака (кг/час) |
|
|
|
|
|
Расход воздуха (м3/час) |
|
|
|
|
|
От каких показателей зависит расход NH3 |
|
|
|
|
|
6.Рассчитаем содержание водяного пара, кислорода и азота в воздухе. Содержание кислорода в воздухе 21% (объем), азота 79% (об.), давление насыщенного воздуха пара в воздухе 31,82 мм/рт. ст. при З00оС
6.1.Содержание водяного пара в воздухе:
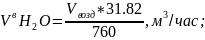


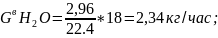
где 18 - молярная масса воды.
6.2.Объем сухого воздуха:
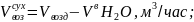
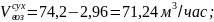
6.3.Объем кислорода в поступающем воздухе:
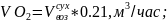

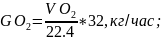
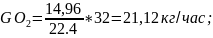
где 32 - молярная масса кислорода.
6.4.Содержание азота в поступающем воздухе: -


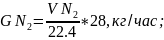

где 28 - молярная масса азота.
6.5.Заполнить таблицу приходной части баланса окисления аммиака по варианту.
Данные |
1 |
2 |
3 |
4 |
||||||
кг/ч |
м3/ч |
кг/ч |
м3/ч |
кг/ч |
м3/ч |
кг/ч |
м3/ч |
|||
Аммиак Кислород Азот Водные пары |
|
|
|
|
|
|
|
|
||
Итого |
|
|
|
|
|
|
|
|
||
7.Процесс окисления аммиака идет по двум реакциям
4 NH3 + 5 O2 = 4 NO + 6 H2O
4 NH3 + 3 O2 = 4 N2 + 6 H2O
Рассчитаем по этим реакциям образование азота и водяного пара, а так же расход кислорода на окисление аммиака.
7.1.По реакции (1) определим образование окиси азота:
V NO = V NH3 * , м3/час;
V
NO
= 12,1*
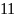 =133,1
м3/час;
=133,1
м3/час;
где - степень окисления аммиака (по заданию).
7.1.2.Вес окиси азота:

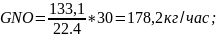
где 30 – молярная масса окиси азота.
7.1.3.Объем водяного пара:


где 6,4 - коэффициенты в уравнении реакции (1);
7.1.4.Расход кислорода:


где 5,4 - коэффициенты в уравнении реакции (1);
7.2.По реакции (2) определяем:
7.2.1 .Объем образовавшегося азота:


7.2.2.Объем водяного пара:

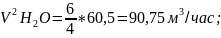
7.2.3.Объем расходуемого кислорода:


где 3,4 - коэффициенты в уравнении реакции (2);
8.Вычисляем находящиеся в газе после окисления объемы и весовые
количества (входящие в расходную часть баланса) кислорода:
VpO2 = VO2 – V1O2 – V2O2, м3/час;
VpO2
= 14,96 ––
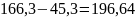 м3/час;
м3/час;
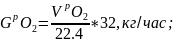

VpN2 = VN2 + V1N2, м3/час;
VpN2 = 11,81+ 60,5=72,31 м3/час;


Vp H2O = V3 H2O + V1 H2O + V2 H2O, м3/час;
Vp H2O = 139,4+ 199,65+90,75=399,8 м3/час;

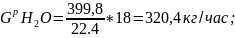
9.Составляем таблицу расхода, т.е. количества и состава компонентов, уходящих из контактного аппарата. Выбираем все значения с индексом «Р». Расход в весовых единицах (кг/г) должен сходится с приходом.
Статьи |
1 |
2 |
3 |
4 |
5 |
|||||||||
кг/ч |
м3/ч |
кг/ч |
м3/ч |
кг/ч |
м3/ч |
кг/ч |
м3/ч |
кг/ч |
м3/ч |
|||||
Окись азота |
|
|
|
|
|
|
|
|
|
|
||||
Кислород |
|
|
|
|
|
|
|
|
|
|
||||
Азот |
|
|
|
|
|
|
|
|
|
|
||||
Водяные пары |
|
|
|
|
|
|
|
|
|
|
||||
Итого |
|
|
|
|
|
|
|
|
|
|
||||
После проверки правильности полученных результатов каждый учащийся для своего варианта заполняет таблицу баланса по форме. Таблица на следующей странице.
Приход |
Расход |
||||
статьи |
кг |
М3 |
Статьи |
кг |
М3 |
Аммиак Воздух: Кислород Азот Водяные пары |
|
|
Окись азота Кислород Азот Водяные пары |
|
|
Итого |
|
|
Итого |
|
|
В балансе должен только сходиться вес поступающих и выходящих продуктов, объем же их разный.
Тепловой баланс контактного окисления аммиака.
Все расчеты ведутся с использованием данных последней таблицы материального баланса.
Приход тепла.
1.Тепло, приносимое АВС.
Принимаем среднюю теплоемкость АВС равной 29,74 кДж/кМоль*К

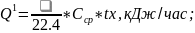
где х - температура, до которой должна быть подогрета АВС перед подачей на контактирование, оС;
2.Тепло выделяемое при протекании реакции окисления аммиака:
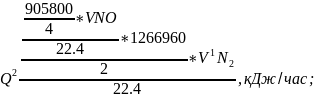
где 905800 и 1266960 - тепловые эффекты соответственно первой и второй реакции;
Расход тепла.
1.Тепло, уносимое нитрозными газами, поступающими в котел- утилизатор:
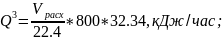
где 32,34 - средняя теплоемкость нитрозного газа кДж/кМолъК;
800 - температура контактирования,
2.Определим теплопотери в окружающую среду:
Qпот = K4(Q1+Q2) = K(Vприх/22.4*Ccp*tx+Q2)
где К - теплопотери составляют 4% от прихода тепла.
Приравниваем приход и расход тепла и составляем уравнение теплового баланса.
Q1 + Q2 = Q3 + Qпот

Или
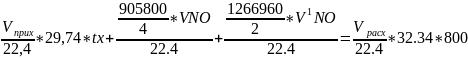
и решаем его относительно tх.
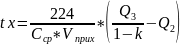 ,
оС;
,
оС;
Вариант |
1 |
2 |
3 |
4 |
5 |
Величина tx |
|
|
|
|
|
От чего зависит величина tx |
|
|
|
|
|
Далее подставляем значение tх в формулу для расчета и находим
величину Q1.
Затем рассчитаем значение Qпот. На основании проведенных расчетов
заполняем таблицу теплового баланса.
Приход |
Расход |
|||
Статьи |
кДж/час |
Статьи |
кДж/час |
|
1.Тепло, приходящее с аммиачно-воздушной смесью. 2.Тепло реакции. |
|
1.Тепло, приносимое с нитрозными газами. 2.Теплопотери в окружающую среду. |
|
|
Итого |
|
Итого |
|
|