
- •Процесс отстаивания сточной воды
- •Нейтрализация сточных вод
- •11.1. Коагуляция и флокуляция загрязнений сточных вод
- •Недостатки
- •Лотация с выделением воздуха из раствора
- •Флотация с механическим диспергированием воздуха
- •Флотация с подачей воздуха через пористые материалы
- •Электрофлотация
- •Биологическая и химическая флотация
11.1. Коагуляция и флокуляция загрязнений сточных вод
Использование физико-химических методов для очистки сточных вод по сравнению с биохимическими имеет ряд преимуществ: возможность удаления из сточных вод токсичных, биохимически неокисляемых органических загрязнений; достижение более глубокой и стабильной степени очистки; меньшие размеры сооружений; меньшая чувствительность к изменениям нагрузок; возможность полной автоматизации; более глубокая изученность кинетики некоторых процессов, а также вопросов моделирования, математического описания и оптимизации, что важно для правильного выбора и расчета аппаратуры; методы не связаны с контролем за деятельностью живых организмов; возможность рекуперации различных веществ.
Выбор того или иного метода очистки (или совокупности методов) производят с учетом санитарных и технологических требований, предъявляемых к очищенным сточным водам с целью дальнейшего их использования, а также с учетом количества сточных вод и концентрации загрязнений в них.
В процессе механической очистки из сточных вод достаточно легко удаляются частицы размером 10 мкм и более, мелкодисперсные и коллоидные частицы практически не удаляются. Таким образом, сточные воды после сооружений механической очистки представляют собой агрегативно устойчивую систему. Для их очистки применяют методы коагуляции; агрегативная устойчивость при этом нарушается, образуются более крупные агрегаты частиц, которые могут удаляться из сточных вод механическими способами.
Коагуляция - это процесс слипания частиц коллоидной системы в результате их взаимодействия под действием молекулярных сил сцепления при перемешивании или направленном перемещении во внешнем силовом поле. В результате коагуляции образуются агрегаты - более крупные (вторичные) частицы, состоящие из скопления мелких (первичных). Первичные частицы в таких агрегатах соединены силами межмолекулярного взаимодействия непосредственно или через прослойку окружающей (дисперсионной) среды. Коагуляция сопровождается прогрессирующим укрупнением частиц и уменьшением их общего числа в объеме сточной воды. Слипание однородных частиц называется гомокоагуляцией, а разнородных - гетерокоагуляцией.
В очистке сточных вод коагуляцию применяют для ускорения процесса осаждения тонкодисперсных примесей и эмульгированных веществ. Она наиболее эффективна для удаления из воды коллоидно-дисперсных частиц, т.е. частиц размером 1...100 мкм. Коагуляция может происходить самопроизвольно или под влиянием химических и физических процессов. В процессе очистки сточных вод коагуляция происходит под влиянием добавляемых к ним специальных веществ - коагулянтов.
Коагулянты в воде образуют хлопья гидроксидов металлов, которые быстро оседают под действием силы тяжести. Хлопья обладают способностью улавливать коллоидные и взвешенные частицы и агрегировать их. Так как коллоидные частицы имеют слабый отрицательный заряд, а хлопья коагулянтов - слабый положительный заряд, то между ними возникает взаимное притяжение.
Основным процессом коагуляционной очистки сточных вод является гетерокоагуляция - взаимодействие коллоидных и мелкодисперсных частиц сточных вод с агрегатами, образующимися при введении в сточную воду коагулянтов.
Для коллоидных частиц характерно образование на поверхности частиц двойного электрического слоя. Одна часть двойного слоя фиксирована на поверхности раздела фаз, а другая создает облако ионов, т.е. одна часть двойного слоя является неподвижной, а другая подвижной (диффузионный слой).
Частица вместе с диффузионным слоем называется мицеллой. Изменение напряженности электрического поля мицеллы показано на рис. 11.1. Разность потенциалов, возникающая между неподвижной и подвижной частями слоя (в объеме жидкости), называется ξ-потенциалом или электрокинетическим потенциалом, отличным от термодинамического потенциала E, который представляет собой разность потенциалов между поверхностью частиц и жидкостью. Дзета-потенциал зависит как от E, так и от толщины двойного слоя. Его значение определяет величину электростатических сил отталкивания частиц, которые предохраняют частицы от слипания друг с другом. Малый размер коллоидных частиц загрязнений и отрицательный заряд, распределенный на их поверхности, обуславливает высокую стабильность коллоидной системы.

Рис. 11.1. Строение мицеллы: а - ξ > 0,03; б - ξ ~ 0; А - адсорбционный слои; Б - диффузионный слой; I - ядро
При снижении электрического заряда частиц, т.е. при уменьшении ξ-потенциала, силы отталкивания уменьшаются и становится возможным слипание частиц - процесс коагуляции коллоида. Чтобы вызвать коагуляцию коллоидных частиц, необходимо снизить величину их ξ-потенциала до критического значения добавлением ионов, имеющих положительный заряд. Таким образом, при коагуляции происходит дестабилизация коллоидных частиц вследствие нейтрализации их электрического заряда. Силы взаимного притяжения между коллоидными частицами начинают преобладать над электрическими силами отталкивания при ξ-потенциале системы менее 0,03 В. При потенциале, равном нулю, коагуляция проходите максимальной интенсивностью.
При коагуляции хлопья образуются сначала за счет части взвешенных частиц и коагулянта или только коагулянта. Образовавшиеся хлопья последнего сорбируют вещества, загрязняющие сточные воды и, осаждаясь вместе с ними, очищают воду.
Один из методов снижения ξ-потенциала коллоидной системы - увеличение концентрации в воде электролитов. Способность электролита вызывать коагуляцию коллоидной системы возрастает с увеличением валентности коагулирующего иона, обладающего зарядом, который противоположен заряду коллоидных частиц.
Для начала коагуляции частицы должны приблизиться друг к другу на расстояние, при котором между ними действуют силы притяжения и химического сродства. Сближение частиц происходит в результате броуновского движения, а также при ламинарном или турбулентном движении потока воды.
В качестве коагулянтов используют бентонит, электролиты, растворимые в воде соли алюминия Al2(SO4)3, соли железа FeCl3 или их смеси, полиакриламид, которые, гидролизуясь, образуют хлопьевидные гидраты окислов металлов. Для обработки сточных вод также могут быть использованы различные глины, алюминийсодержащие отходы производства, травильные растворы, пасты, смеси, шлаки, содержащие диоксид кремния.
При использовании в качестве коагулянтов солей алюминия и железа в результате реакции гидролиза образуются малорастворимые в воде гидроксиды железа и алюминия, которые сорбируют на развитой хлопьевидной поверхности взвешенные, мелкодисперсные и коллоидные вещества и при благоприятных гидродинамических условиях оседают на дно отстойника, образуя осадок:

Образующиеся в процессе гидролиза серную и соляную кислоты следует нейтрализовать известью или другими щелочами. Нейтрализация образующихся при гидролизе коагулянтов кислот может также протекать за счет щелочного резерва сточной жидкости:
![]()
При использовании смесей сульфата алюминия A12(SO4)3 и хлорного железа FeCl3 в соотношениях от 1:1 до 1:2 достигается лучший результат коагулирования, чем при раздельном использовании реагентов.
Скорость коагуляции зависит от концентрации электролита (рис. 11.2).

Рис. 11.2. Зависимость относительной скорости коагуляции от концентрации электролита
При малых концентрациях электролита эффективность соударения частиц ψ, т.е. отношение числа столкновений, окончившихся слипанием, к общему числу столкновений, близка к нулю (ψ = 0). По мере роста концентрации скорость коагуляции увеличивается, но не все столкновения оканчиваются слипанием частиц - такую коагуляцию называют медленной. При ψ = 1 наступает быстрая коагуляция, при которой все столкновения частиц заканчиваются образованием агрегатов.
Скорость быстрой коагуляции для неподвижной среды при броуновском движении частиц по теории Смолуховского равна:
 (11.1)
(11.1)
Количество частиц в единице объема воды за время /для быстрой и медленной коагуляции определяется по формулам:
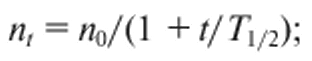 (11.2)
(11.2)
![]() (11.3)
(11.3)
где k - константа коагуляции; nх - число агрегатов частиц; n0 - начальная концентрация частиц; Т1/2 - время коагуляции, в течение которого количество частиц в единице объема уменьшается вдвое; ψ - коэффициент эффективности столкновений частиц.
В полидисперсных системах коагуляция происходит быстрее, чем в монодисперсных, так как крупные частицы при оседании увлекают за собой более мелкие. Форма частиц также влияет на скорость коагуляции. Например, удлиненные частицы коагулируют быстрее, чем шарообразные.
Размер хлопьев (в пределах 0,5...3 мм) определяется соотношением между молекулярными силами, удерживающими частицы вместе, и гидродинамическими силами отрыва, стремящимися разрушить агрегаты.
Плотность хлопьев рх определяется с учетом плотностей воды р0 и твердой фазы рт, а также объема твердого вещества в единице объема хлопьев δr:
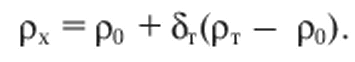 (11.4)
(11.4)
Прочность хлопьев зависит от гранулометрического состава образующихся агрегатов частиц и пластичности. Агломераты частиц, неоднородных по размеру, прочнее, чем однородных. Вследствие выделения газа из воды, а также в результате аэрации и флотации происходит газонасыщение хлопьев, которое сопровождается уменьшением плотности хлопьев и уменьшением скорости осаждения.
Отношение скорости стесненного осаждения к скорости свободного осаждения частиц равно
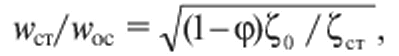 (11.5)
(11.5)
где φ - объемная концентрация частиц; ζ0 и ζст - коэффициенты сопротивления частицы при свободном и стесненном осаждении.
Коагуляция вод, содержащих мелкодисперсные и коллоидные частицы, может происходить при пропуске сточных вод через электролизер с анодом, изготовленным из алюминия или железа. Металл анода под действием постоянного тока ионизируется и переходит в сточную воду, частицы загрязнений которой коагулируются образовавшимися труднорастворимыми гидроксидами алюминия или железа.
Метод электрохимического коагулирования может быть применен для обработки сточных вод, содержащих эмульгированные частицы масел, жиров и нефтепродуктов, хроматы, фосфаты.
Флокуляция - один из видов коагуляции, при которой мелкие частицы, находящиеся во взвешенном состоянии, под влиянием специально добавляемых веществ (флокулянтов) образуют интенсивно оседающие рыхлые хлопьевидные скопления. В отличие от коагуляции при флокуляции агрегация происходит не только при непосредственном контакте частиц, но и в результате взаимодействия молекул адсорбированного на частицах флокулянта.
Механизм действия флокулянтов основан на явлении адсорбции молекул флокулянта на поверхности коллоидных частиц, на образовании сетчатой структуры молекул флокулянта, на слипании коллоидных частиц за счет сил Ван-дер-Ваальса. При действии флокулянтов между коллоидными частицами образуются трехмерные структуры, способные к более быстрому и полному отделению от жидкой фазы.
Флокуляцию проводят для интенсификации процесса образования хлопьев гидроксидов алюминия и железа с целью повышения скорости их осаждения. Использование флокулянтов позволяет снизить дозы коагулянтов, уменьшить продолжительность процесса коагуляции и повысить скорость осаждения образующихся хлопьев.
Для очистки сточных вод используют природные и синтетические флокулянты. К природным флокулянтам относятся крахмал, декстрин, эфиры целлюлозы и др. Активный диоксид кремния (xSiO2 · уН2O) является наиболее распространенным неорганическим флокулянтом. Из синтетических органических флокулянтов наибольшее применение получил полиакриламид (ПАА). При выборе состава и дозы флокулянта учитывают свойства его макромолекул и природу дисперсионных частиц. Оптимальная доза ПАА для очистки промышленных сточных вод колеблется в пределах 0,4...1 г/м3.
При растворении в сточных водах флокулянта могут находиться в неионизированном и ионизированном состоянии. Во втором случае они носят название растворимых полиэлектролитов. В зависимости от состава полярных групп флокулянта бывают:
неионогенные - полимеры, содержащие неионогенные группы: -ОН, -СО (крахмал, оксиэтилцеллюлоза, поливиниловый спирт, полиакрило нитрил и др.);
анионные - полимеры, содержащие анионные группы: -СООН, -SO3H, - OSO3H (активная кремневая кислота, полиакрилат натрия, альгинат натрия, лигносульфонаты и др.);
катионные - полимеры, содержащие катионные группы: -NH2, -ΝΗ (полиэтиленимин, сополимеры винилпиридина и др.);
амфотерные - полимеры, содержащие одновременно анионные и катионные группы: полиакриламид, белки и др.
Скорость и эффективность процесса флокуляции зависят от состава сточных вод, их температуры, интенсивности перемешивания и последовательности введения коагулянтов и флокулянтов. Дозы флокулянтов принимаются обычно 0,1...10 г/м3, а в среднем 0,5...1 г/м3.
15
СОРБЦИЯ
И ЕЁ ВИДЫ
Сорбция
- это поглощение одного вещества
другим.
Поглотитель
- сорбент,
поглощаемое
вещество - сорбат.
Если
поглощение происходит только в
поверхностном слое сорбента, т.е.
происходит поверхностная сорбция, она
называется адсорбцией.
Если
же сорбат продиффундировал по всему
объёму сорбента, т.е. если произошла
объёмная сорбция, она называется абсорбцией.
По
механизму протекания процесса сорбция
подразделяется на:
физическую
и химическую.
При
химической сорбции (хемосорбции) между
сорбентом и сорбатом возникает химическое
взаимодействие, в результате чего между
ними образуется третье вещество,
(рис.2.)
 Рис.2
Химическая
сорбция намного прочнее физической,
десорбция самопроизвольно практически
не происходит.
Ещё
одно отличие между физической и химической
сорбцией заключается в том, что при
повышении температуры физическая
сорбция уменьшается, а химическая
увеличивается.
В
чистом виде физическая и химическая
сорбция встречаются редко, чаще всего
сорбция включает элементы их
обеих.
Адсорбция
(лат. ad — на, при; sorbeo — поглощаю) — это,
в широком смысле, процесс изменения
концентрации у поверхности раздела
двух фаз, а в более узком и употребительном
— это повышение концентрации одного
вещества (газ, жидкость) у поверхности
другого вещества (жидкость, твердое
тело).
Основные
понятия
Поглощаемое
вещество, ещё находящееся в объёме фазы,
называют адсорбтив, поглощённое —
адсорбат. В более узком смысле под
адсорбцией часто понимают поглощение
примеси из газа или жидкости твёрдым
веществом (в случае газа и жидкости) или
жидкостью (в случае газа) — адсорбентом.
При этом, как и в общем случае адсорбции,
происходит концентрирование примеси
на границе раздела адсорбент-жидкость
либо адсорбент-газ. Процесс, обратный
адсорбции, то есть перенос вещества с
поверхности раздела фаз в объём фазы,
называется десорбция.
Адсорбция
происходит на границе раздела следующих
фаз:
Рис.2
Химическая
сорбция намного прочнее физической,
десорбция самопроизвольно практически
не происходит.
Ещё
одно отличие между физической и химической
сорбцией заключается в том, что при
повышении температуры физическая
сорбция уменьшается, а химическая
увеличивается.
В
чистом виде физическая и химическая
сорбция встречаются редко, чаще всего
сорбция включает элементы их
обеих.
Адсорбция
(лат. ad — на, при; sorbeo — поглощаю) — это,
в широком смысле, процесс изменения
концентрации у поверхности раздела
двух фаз, а в более узком и употребительном
— это повышение концентрации одного
вещества (газ, жидкость) у поверхности
другого вещества (жидкость, твердое
тело).
Основные
понятия
Поглощаемое
вещество, ещё находящееся в объёме фазы,
называют адсорбтив, поглощённое —
адсорбат. В более узком смысле под
адсорбцией часто понимают поглощение
примеси из газа или жидкости твёрдым
веществом (в случае газа и жидкости) или
жидкостью (в случае газа) — адсорбентом.
При этом, как и в общем случае адсорбции,
происходит концентрирование примеси
на границе раздела адсорбент-жидкость
либо адсорбент-газ. Процесс, обратный
адсорбции, то есть перенос вещества с
поверхности раздела фаз в объём фазы,
называется десорбция.
Адсорбция
происходит на границе раздела следующих
фаз:
твёрдое тело – газ;
твёрдое тело – раствор;
раствор – газ.
Физическая
адсорбция
При
физической сорбции между сорбентом и
сорбатом происходит только межмолекулярное
взаимодействие, т.е. сцепление достаточно
непрочное, и со временем начинается
обратный процесс - процесс отдачи
поглощённого вещества, и в конце концов
устанавливается равенство скоростей
обоих процессов:
Vадсорбции
== Vдесорбции
Модели
физической адсорбции
Образование
монослоя

Абсо́рбция (лат. absorptio от absorbere — поглощать) — поглощение сорбата всем объёмом сорбента. Является частным случаем сорбции. В технике и химической технологии чаще всего встречается абсорбция (поглощение, растворение) газов жидкостями. Но известны и процессы абсорбции газов и жидкостей кристаллическими и аморфными телами (например, абсорбция водорода металлами, абсорбция низкомолекулярных жидкостей и газов цеолитами, абсорбция нефтепродуктов резинотехническими изделиями и т.п.). Часто в процессе абсорбции происходит не только увеличение массы абсорбирующего материала, но и существенное увеличение его объема (набухание), а также его физических характеристик – вплоть до агрегатного состояния. На практике абсорбция чаще всего применяется для разделения смесей, состоящих из веществ, имеющих различную способность к поглощению подходящими абсорбентами. При этом целевыми продуктами могут быть как абсорбировавшиеся, так и не абсорбировавшиеся компоненты смесей. Обычно в случае физической абсорбции абсорбировавшиеся вещества могут быть вновь извлечены из абсорбента посредством его нагревания, разбавления неабсорбирущей жидкостью или иными подходящими способами. Регенерация химически абсорбированных веществ также иногда возможна. Она может быть основана на химическом или термическом разложении продуктов химической абсорбции с высвобождением всех или некоторых из абсорбированных веществ. Но во многих случаях регенерация химически абсорбированных веществ и химических абсорбентов бывает невозможной или технологически/экономически нецелесообразной. Явления абсорбции широко распространены не только в промышленности, но и в природе (пример - набухание семян), а также в быту. При этом они могут приносить как пользу, так и вред (например, физическая абсорбция атмосферной влаги приводит к набуханию и последующему расслоению деревянных изделий, химическая абсорбция кислорода резиной - к потере ею эластичности и растрескиванию). Из-за фонетической и физической близости обозначаемых понятий абсорбцию часто неправильно называют адсорбцией и наоборот. Различают физическую абсорбцию и хемосорбцию. При физической абсорбции процесс поглощения не сопровождается химической реакцией. При хемосорбции абсорбируемый компонент вступает в химическую реакцию с веществом абсорбента. Согласно закону Генри растворимость газа в жидкости пропорциональна давлению, под которым газ находится, но при условии, что газ при растворении не образует новых соединений и молекулы его не полимеризуются[1]. Всякое плотное тело сгущает довольно значительно прилегающие непосредственно к его поверхности частицы окружающего его газообразного вещества. Если такое тело пористо, как, например, древесный уголь или губчатая платина, то это уплотнение газов имеет место и по всей внутренней поверхности его пор, а тем самым, следовательно, и в гораздо более высокой степени. Вот наглядный пример этого: если взять кусок свежепрокалённого древесного угля, бросить его в бутылку, содержащую углекислый или другой газ, и закрыв её сейчас же пальцем, опустить отверстием вниз в ртутную ванну, то мы вскоре увидим, что ртуть поднимается и входит в бутылку; это прямо доказывает, что уголь поглотил углекислоту или иначе наступило уплотнение, абсорбция газа.
Сорбционный метод очистки сточных вод имеет ряд существенных преимуществ перед другими методами: 1) высокая глубина очистки; 2) небольшая площадь, занимаемая установкой сорбционных фильтров; 3) надежность в работе, простота в эксплуатации, возможность полной автоматизации работы установки; 4) устойчивость к концентрационным и гидравлическим флуктуациям; 5) неподверженность воздействию токсичных и других вредных веществ, содержащихся в сточных водах.
Сорбционный метод выделения паров хлорируемого сырья из хлористоводородных газов с точки зрения аппаратурного оформления и методики работы представляет некоторые преимущества. При применении этого метода вся установка имеет лишь два скруббера, орошаемых охлажденной жидкостью, способной растворять хлорируемое сырье и имеющей весьма незначительную упругость паров при температуре поглощения. При прохождении через эти два скруббера хлористоводородные газы исчерпывающе освобождаются от паров хлорируемого сырья и могут быть переданы на абсорбцию без всякой предварительной обработки; при этом соляная кислота, полученная в результате абсорбции, обладает значительной чистотой.
Сорбционным методом на окиси алюминия можно отделить основную массу примесей от хлортетрациклина. Однако для практического использования этого процесса необходимо освободить хлортетрациклин от алюминия. Это было осуществлено с помощью экстракции хлортетрациклина бутиловым спиртом и последующим выделением хлортетрациклина из бутилового спирта при добавлении гексана. В соответствии с изложенными здесь результатами выделение и очистка хлортетрациклина из культуральной жидкости сводится к следующему
Использование сорбционных методов позволит резко сократить объемы растворов на первой стадии очистки различных ферментов и проводить концентрирование разбавленных растворов.
Недостатки сорбционных методов заключаются в относительно малой сорбционной емкости активированных углей ( 4 - 6 %) и трудности их регенерации.
Недостатками сорбционных методов являются относительно малая сорбционная емкость активированных углей ( в пределах 4 - 6 %), трудность регенерации.
Достоинства сорбционных методов могут быть использованы при проведении не только ионообменных, но и окислительно-восстановительных реакций.
Рентабельность сорбционных методов, как упоминалось выше, определяется в основном двумя факторами: 1) стоимостью сорбента, 2) характером и стоимостью регенерации.
Применение сорбционных методов для исследования коллоидной структуры углей представляется весьма перспективным.
Достоинствами сорбционного метода являются его универсальность в отношении самых различных жидкостей по химическому составу и степени агрессивности, возможность получать суммарный коэффициент сорбции для смеси жидкостей и паров, использование полимерных образцов различной массы и размеров.
Лаборатория сорбционных методов ( руководитель лаборатории М. М. Се-нявин) нацелена на разработку сорбционных методов очистки воды. Она развивает и методы анализа, главным образом поверхностных пресных вод. Проводятся работы по изучению состояния растворенных в воде веществ, в частности ионов металлов. Для решения указанных задач привлекается широкий набор методов. Лаборатория имеет обширные связи с научными учреждениями и промышленными предприятиями, в частности с тепловыми электростанциями.
Достоинства сорбционных методов могут быть использованы при проведении не только ионообменных, но и окислительно-восстановительных реакций
16
Ионообменная очистка применяется для извлечения и утилизации из сточных вод тяжелых металлов (цинка, меди, хрома, никеля, свинца, ртути, кадмия, ванадия, марганца), а также соединений мышьяка, фосфора, цианистых соединений и радиоактивных веществ. Метод позволяет очищать сточную воду до предельно допустимых концентраций с последующим ее использованием в технологических процессах или в системах оборотного водоснабжения.
Гетерогенный ионный обмен, или ионообменная сорбция, - процесс обмена между ионами, находящимися в растворе, и ионами, присутствующими на поверхности твердой фазы - ионита.
Иониты практически не растворимы в воде. Те из них, которые способны поглощать из растворов электролитов положительные ионы, являются катионитами, поглощать отрицательные ионы - анионитами. Катиониты обладают кислотными свойствами, а аниониты - основными свойствами. Если иониты обменивают и катионы, и анионы, их называют амфотерными.
Иониты. Иониты подразделяются на природные и искусственные, или синтетические. По своей природе они бывают неорганические (минеральные) и органические.
Различают следующие виды ионитов:
сильнокислотные катиониты, содержащие сульфогруппы SO3H и сильноосновные анионы, содержащие четвертичные аммониевые основания;
слабо кислотные катиониты, содержащие карбоксильные СООН и фенольные группы, диссоциирующие при pH > 7, а также слабоосновные аниониты, содержащие первичные NH2 и вторичные NH аминогруппы, диссоциирующие при pH < 7;
иониты смешанного типа, проявляющие свойства смеси сильных и слабых кислот или оснований.
К неорганическим природным ионитам относятся цеолиты, глинистые минералы, полевые шпаты, различные слюды. Их катионообменные свойства обусловлены содержанием алюмосиликатов типа Na2O Аl2O3 nSiO2·Н2O. Ионообменными свойствами обладают также фторапатит [Са5(РO4)3]F и гидроксида-патит. К неорганическим синтетическим ионитам относятся силикагели, пермутиты, труднорастворимые оксиды и гидроксиды некоторых металлов (алюминия, хрома, циркония). Катионообменные свойства, например силикагеля, обусловлены обменом ионов водорода гидроксидных групп на катионы металлов, проявляющиеся в щелочной среде. Катионообменными свойствами обладают и пермутиты, получаемые сплавлением соединений, содержащих алюминий и кремний.
Органические природные иониты - это гуминовые кислоты почв и углей. Они проявляют слабокислотные свойства. Для усиления кислотных свойств и обменной емкости угли измельчают и сульфируют в избытке олеума. Сульфоугли являются дешевыми полиэлектролитами, содержащими сильно- и слабокислотные группы. К недостаткам таких ионитов относятся их малая химическая стойкость и низкая механическая прочность зерен, а также небольшая обменная емкость, особенно в нейтральных средах.
Ионный обмен является одним из эффективных методов удаления из воды анионов и катионов. Это одна из важнейших стадий очистки, используемая как этап предварительной очистки, так и для получения воды очищенной.
Ионный обмен основан на использовании ионитов – сетчатых полимеров разной степени сшивки, гелевой микро- или макропористой структуры, ковалентно связанных с ионогенными группами (рис.1):
Рис. 1. Общий вид ионитов, используемых в ионообменных смолах.
Диссоциация этих групп в воде или в растворах дает ионную пару – фиксированный на полимере ион и подвижный противоион, который обменивается на ионы одноименного заряда (катионы или анионы) из раствора. При химическом обессоливании обмен ионов является обратимым процессом между твердой и жидкой фазами. Включение в состав смол различных функциональных групп приводит к образованию смол избирательного действия.
Ионообменные смолы делятся на анионообменные и катионообменные. Катионообменные смолы содержат функциональные группы, способные к обмену положительных ионов, анионообменные – к обмену отрицательных (рис. 2):

Рис.2. Принцип ионного обмена
Смолы могут быть дополнительно разделены на 4 основные группы: сильнокислотные, слабокислотные катионообменные смолы и сильноосновные и слабоосновные анионообменные смолы.
Существует два типа ионообменных аппаратов, как правило, колоночных:
С раздельным слоем катионита и анионита;
Со смешанным слоем.
Аппараты первого типа состоят из двух последовательно расположенных колонн, первая из которых по ходу обрабатываемой воды заполнена катионитом, а вторая – анионитом (рис.3). Аппараты второго типа состоят из одной колонны, заполненной смесью этих ионообменных смол.
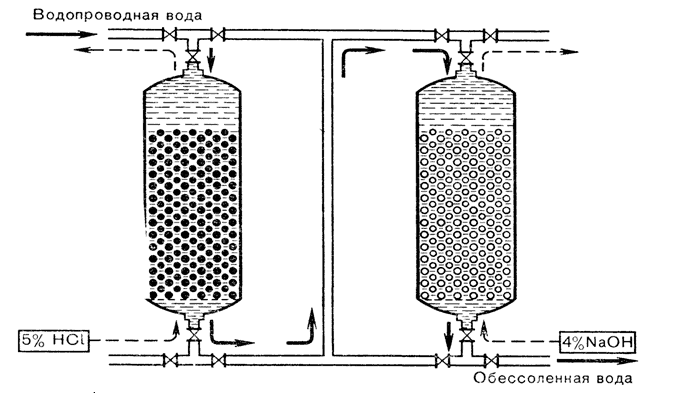
рис. 3. Принцип работы ионообменной установки
Примечание: катионит регенерируется хлористоводородной кислотой; анионит – гидроксидом натрия.
Преимуществами ионного обмена являются малые капитальные затраты, простота, отсутствие принципиальных ограничений для достижения больших производительностей.
Использование
метода ионного обмена целесообразно в
технологиях водоподготовки при
слабой минерализации воды: ниже 100 ![]() 200
мг/л солей, т.к. уже при умеренной (около
1 г/л содержании солей) для очистки 1
м3 воды
будет необходимо затратить 5 л 30% раствора
соляной кислоты и 4 л 50% раствора щелочи.
200
мг/л солей, т.к. уже при умеренной (около
1 г/л содержании солей) для очистки 1
м3 воды
будет необходимо затратить 5 л 30% раствора
соляной кислоты и 4 л 50% раствора щелочи.
Смолы обладают рядом существенных недостатков, которые затрудняют их использование:
Большинство ионообменных смол обладает низкой гидрофильностью, что обуславливает малую скорость диффузии ионов внутрь гранул смолы и низкую скорость сорбции и десорбции;
На практике ионообменные смолы применяются в виде гранул, слеживание которых в колонке во время процесса сорбции вызывает необходимость проведения принудительного взрыхления приводящего к постепенному механическому разрушению гранул в процессе эксплуатации;
Ионообменные смолы требуют частой регенерации для восстановления обменной способности.
Регенерация ионообменных смол производится как правило растворами кислоты хлористоводородной (для Н+ формы) и натрия гидроксида (для ОН- формы). На качество регенерации влияет выбор регенерирующего раствора, тип ионообменной смолы, скорость, температура, чистота, тип и концентрация регенерирующего раствора, время его контакта с ионитами.
Для приготовления растворов кислоты хлористоводородной и натрия гидроксида, их хранения и защиты персонала от возможных утечек, необходимы специальные емкости.
В процессе регенерации образуется большое количество сильно кислых и сильно щелочных промывочных вод, которые должныподвергаться нейтрализации перед сбросом в систему сточных вод.
Системы ионного обмена требуют предварительной очистки от нерастворимых твердых частиц, химически активных реагентов (хлора в потоке воды во избежание загрязнения смолы и ухудшения ее качества.
Ионообменная технология обеспечивает классическое обессоливание воды и являетсяэкономичной системой при получении воды очищенной. Данная технология позволяет получать воду с очень низким показателем удельной электропроводности. Однако при длительном использовании ионообменников может спонтанно возникнуть проблема роста микроорганизмов. Для снижения микробной контаминации используются УФ-лампы, постоянная рециркуляция воды в петле распределения, сведение к минимуму или вообще исключение перерывов в работе оборудования. Поскольку данный метод не обеспечивает микробиологической чистоты из-за использования ионообменных смол, поэтому его использование для получения воды очищенной целесообразно в сочетании со стерилизующей (0,22 мкм) микрофильтрацией.
Преимущества ионного обмена: - Минимальные капитальные и энергозатраты - Возможность получения сверхчистой воды, максимальная степень обессоливания - Надежность - Способность работать при резко меняющихся параметрах питающей воды - Минимальный объем вторичных отходов, обеспечивающий возможность их переработки
