
- •Молекулярная физика и термодинамика
- •1. Молекулярно-кинетическая теория газов Тема 1. Предварительные сведения
- •1.1. Статистический и термодинамический методы исследования
- •1.2. Характеристики атомов и молекул
- •1.3. Состояние системы. Параметры состояния
- •1.4.Термодинамический процесс
- •Тема 2. Молекулярно-кинетическая теория идеального газа
- •1.5. Идеальный газ как модель газообразного состояния
- •1.6. Уравнение состояния идеального газа
- •1.7. Распределение Максвелла
- •1.8. Барометрическая формула
- •1.9. Распределение Больцмана
- •Тема 3. Реальные газы
- •1.10. Отклонение газов от идеальности.
- •1.11. Потенциальная энергия взаимодействия молекул
- •1.12. Уравнение Ван-дер-Ваальса
- •1.13. Экспериментальные изотермы
- •Тема 4. Жидкое состояние
- •1.14. Строение жидкостей
- •1.15. Поверхностное натяжение
- •1.16. Давление под изогнутой поверхностью жидкости
- •1.17. Капиллярные явления
- •Тема 5. Явления переноса
- •1.18. Средняя длина свободного пробега
- •1.19. Вязкость газов
- •1.20. Теплопроводность газов
- •1.21. Диффузия в газах
- •2. Основы термодинамики Тема 6. Теплота и работа. Первое начало термодинамики
- •2.1. Внутренняя энергия термодинамической системы
- •2.2. Внутренняя энергия идеального газа
- •2.3. Понятие теплоты
- •2.4. Первое начало термодинамики
- •2.5.Работа, совершаемая газом при расширении
- •2.6. Понятие теплоемкости
- •2.7.Теплоемкость при постоянном объеме и теплоемкость при постоянном давлении
- •2.8. Теорема о равномерном распределении энергии по степеням свободы
- •2.9. Теплоемкость многоатомных газов
- •Тема 7. Термодинамическое описание процессов в идеальных газах
- •2.10. Графическое изображение термодинамических процессов.
- •2.11. Изохорический процесс
- •2.12. Изобарический процесс
- •2.13. Изотермический процесс
- •2.14. Адиабатический процесс
- •2.15. Политропические процессы
- •Тема 8. Циклические процессы. Тепловые машины
- •2.16. Обратимые и необратимые процессы.
- •2.17. Циклические процессы. Тепловая машина
- •2.18. Принцип Кельвина
- •2.19. Цикл Карно
- •Тема 9. Второе начало термодинамики
- •2.19. Приведенная теплота
- •2.20. Энтропия как функция состояния
- •2.21. Принцип возрастания энтропии
- •2.22. Термодинамические формулировки второго начала термодинамики
- •2.23. Свободная энергия
- •Тема 10. Тепловая теорема Нернста. Третье начало термодинамики
- •2.24. Тепловая теорема Нернста
- •2.25. Термодинамическая вероятность
- •2.26. Флуктуации
- •Тема 11. Фазовые равновесия и фазовые переходы
- •2.27. Понятие фазы в термодинамике.
- •2.28.Диаграммы равновесия фаз
- •2.29. Испарение и конденсация
- •2.30. Плавление и кристаллизация
- •2.31. Уравнение Клапейрона — Клаузиуса
- •2.32. Тройная точка
Тема 3. Реальные газы
1.10. Отклонение газов от идеальности.
Как уже отмечалось, поведение реальных газов довольно хорошо описывается уравнением (5)
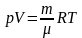
только при не слишком высоких давлениях и достаточно высоких температурах. С повышением давления и уменьшением температуры наблюдаются значительные отступления от уравнения. Во втором столбце таблицы 1 приведены значения произведения pV для массы азота, занимающей при нормальных условиях объем, равный одному литру. Указанные значения даны для различных давлений и одной и той же температуры 0°С. В соответствии с уравнением (5) произведение pV при неизменной температуре должно оставаться постоянным. В действительности, как видно из таблицы, при давлениях порядка 200 ат наблюдаются заметные отклонения, которые, непрерывно возрастая с увеличением давления, достигают при 1000 ат более 100%. Эти отклонения не представляются удивительными, поскольку в модели идеального газа не учитываются размеры молекул и их взаимодействие друг с другом на расстоянии. Вместе с тем при повышении давления возрастает плотность газа, что приводит к уменьшению среднего расстояния между молекулами; поэтому объем молекул и взаимодействие между ними начинают играть существенную роль.

1.11. Потенциальная энергия взаимодействия молекул
Характер взаимодействия между молекулами лучше всего показать с помощью приведенной на рис. 6 кривой, изображающей взаимную потенциальную энергию двух молекул как функцию расстояния r между их центрами. При построении этой кривой потенциальная энергия молекул, находящихся на бесконечно большом расcтоянии друг от друга (т. е. когда они не взаимодействуют), положена равной нулю. Следовательно, кривая идет так, что при r, стремящемся к бесконечности, асимптотически приближается к оси r.

Рис.6. Зависимость потенциальной энергии взаимодействия молекул от расстояния между молекулами
Зная потенциальную энергию как функцию r, можно определить силу, с которой взаимодействуют молекулы на разных расстояниях друг от друга. Для этого нужно воспользоваться известным из механики соотношением
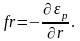
Знак «–» здесь отражает то обстоятельство, что силы, с которыми взаимодействуют молекулы, стремятся перевести их в состояние с наименьшей потенциальной энергией. Следовательно, на расстояниях, превышающих r0, между молекулами действуют силы взаимного притяжения, а на расстояниях, меньших r0, – силы отталкивания. Крутизна хода кривой в соответствующем месте дает величину силы.
Рассмотрим с помощью кривой εР процесс сближения (соударения) молекул. Поместим мысленно центр одной из молекул в начало координат, а центр второй молекулы представим перемещающимся по оси r. Пусть вторая молекула летит по направлению к первой из бесконечности, имея начальный запас кинетической энергии εk = ε1. Приближаясь к первой молекуле, вторая под действием силы притяжения движется со все возрастающей скоростью. В результате кинетическая энергия молекулы ей также растет. Однако полная энергия системы, равная ε = εk + εр, остается неизменной (система двух молекул замкнута) и равной ε1 так как одновременно уменьшается потенциальная энергия εр. При прохождении молекулой точки с координатой r0 силы притяжения сменяются силами отталкивания, вследствие чего молекула начинает быстро терять скорость (в области отталкивания кривая εр идет очень круто). В момент, когда потенциальная энергия εр становится равной полной энергии системы ε1, скорость молекулы обращается в нуль. В этот момент имеет место наибольшее сближение молекул друг с другом. Минимальное расстояние d1, на которое могут сблизиться центры молекул, представляет собой эффективный диаметр молекулы. После остановки молекулы все явления протекают в обратной последовательности: сначала молекула движется со все возрастающей скоростью под действием силы отталкивания; миновав расстояние r0, молекула попадает под действие замедляющей ее движение силы притяжения и, наконец, удаляется на бесконечность, имея первоначальный запас кинетической энергии ε1.
Из рис. 6 видно, что в случае, когда молекула начинает свое движение из бесконечности с большим запасом энергии ε2, минимальное расстояние d2, на которое сближаются центры молекул, оказывается меньшим. Таким образом, эффективный диаметр молекул зависит от их средней энергии, а следовательно, и от температуры. С повышением температуры эффективный диаметр молекул d уменьшается, вследствие чего средняя длина свободного пробега λ растет.

Рис.7. Зависимость потенциальной энергии взаимодействия молекул от расстояния между молекулами в модели идеального газа
Характер
взаимодействия между молекулами,
предполагавшийся
при выводе уравнения состояния идеального
газа, соответствует потенциальной
кривой, изображенной
на рис. 7. На расстояниях, превышающих
r0,
εр
постоянна,
вследствие чего сила равна нулю. При r
= r0
εр
обращается
в бесконечность, образуя потенциальный
барьер, препятствующий сближению центров
молекул
на расстояния, меньшие r0.
Такое упрощенное рассмотрение
допустимо, если средние расстояния
между
молекулами в газе достаточно велики:
при больших r
кривая
εр
на
рис. 6 идет очень полого, вследствие чего
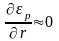 .
По мере же уменьшения среднего расстояния
между молекулами, т. е. при увеличении
плотности газа,
роль сил притяжения между молекулами
все больше растет. Одновременно,
как мы видели выше, сокращается
та часть занимаемого газом объема, в
пределах которой может происходить
движение молекул.
.
По мере же уменьшения среднего расстояния
между молекулами, т. е. при увеличении
плотности газа,
роль сил притяжения между молекулами
все больше растет. Одновременно,
как мы видели выше, сокращается
та часть занимаемого газом объема, в
пределах которой может происходить
движение молекул.
