
- •Молекулярная физика и термодинамика
- •1. Молекулярно-кинетическая теория газов Тема 1. Предварительные сведения
- •1.1. Статистический и термодинамический методы исследования
- •1.2. Характеристики атомов и молекул
- •1.3. Состояние системы. Параметры состояния
- •1.4.Термодинамический процесс
- •Тема 2. Молекулярно-кинетическая теория идеального газа
- •1.5. Идеальный газ как модель газообразного состояния
- •1.6. Уравнение состояния идеального газа
- •1.7. Распределение Максвелла
- •1.8. Барометрическая формула
- •1.9. Распределение Больцмана
- •Тема 3. Реальные газы
- •1.10. Отклонение газов от идеальности.
- •1.11. Потенциальная энергия взаимодействия молекул
- •1.12. Уравнение Ван-дер-Ваальса
- •1.13. Экспериментальные изотермы
- •Тема 4. Жидкое состояние
- •1.14. Строение жидкостей
- •1.15. Поверхностное натяжение
- •1.16. Давление под изогнутой поверхностью жидкости
- •1.17. Капиллярные явления
- •Тема 5. Явления переноса
- •1.18. Средняя длина свободного пробега
- •1.19. Вязкость газов
- •1.20. Теплопроводность газов
- •1.21. Диффузия в газах
- •2. Основы термодинамики Тема 6. Теплота и работа. Первое начало термодинамики
- •2.1. Внутренняя энергия термодинамической системы
- •2.2. Внутренняя энергия идеального газа
- •2.3. Понятие теплоты
- •2.4. Первое начало термодинамики
- •2.5.Работа, совершаемая газом при расширении
- •2.6. Понятие теплоемкости
- •2.7.Теплоемкость при постоянном объеме и теплоемкость при постоянном давлении
- •2.8. Теорема о равномерном распределении энергии по степеням свободы
- •2.9. Теплоемкость многоатомных газов
- •Тема 7. Термодинамическое описание процессов в идеальных газах
- •2.10. Графическое изображение термодинамических процессов.
- •2.11. Изохорический процесс
- •2.12. Изобарический процесс
- •2.13. Изотермический процесс
- •2.14. Адиабатический процесс
- •2.15. Политропические процессы
- •Тема 8. Циклические процессы. Тепловые машины
- •2.16. Обратимые и необратимые процессы.
- •2.17. Циклические процессы. Тепловая машина
- •2.18. Принцип Кельвина
- •2.19. Цикл Карно
- •Тема 9. Второе начало термодинамики
- •2.19. Приведенная теплота
- •2.20. Энтропия как функция состояния
- •2.21. Принцип возрастания энтропии
- •2.22. Термодинамические формулировки второго начала термодинамики
- •2.23. Свободная энергия
- •Тема 10. Тепловая теорема Нернста. Третье начало термодинамики
- •2.24. Тепловая теорема Нернста
- •2.25. Термодинамическая вероятность
- •2.26. Флуктуации
- •Тема 11. Фазовые равновесия и фазовые переходы
- •2.27. Понятие фазы в термодинамике.
- •2.28.Диаграммы равновесия фаз
- •2.29. Испарение и конденсация
- •2.30. Плавление и кристаллизация
- •2.31. Уравнение Клапейрона — Клаузиуса
- •2.32. Тройная точка
1.4.Термодинамический процесс
Если параметры системы изменяются, то в системе идет термодинамический процесс.
Термодинамический процесс – изменение макроскопического состояния системы.
Всякий процесс, т. е. переход системы из одного макроскопического состояния в другое, связан с нарушением равновесия системы. Следовательно, при протекании в системе какого-либо процесса она проходит через последовательность неравновесных состояний. Обращаясь к уже рассмотренному процессу сжатия газа в сосуде, закрытом поршнем, можно заключить, что нарушение равновесия при вдвигании поршня тем значительнее, чем быстрее производится сжатие газа. Если вдвигать поршень очень медленно, то равновесие нарушается незначительно и давление в разных точках мало отличается от некоторого среднего значения р. В пределе, если сжатие газа происходит бесконечно медленно, газ в каждый момент времени будет характеризоваться определенным значением давления. Следовательно, в этом случае состояние газа в каждый момент времени является равновесным и бесконечно медленный процесс будет состоять из последовательности равновесных состояний.
Процесс, состоящий из непрерывной последовательности равновесных состояний, называется равновесным (или квазистатическим). Из сказанного следует, что равновесным может быть только бесконечно медленный процесс, поэтому равновесный процесс является абстракцией, моделью, которая используется для построения математической теории реальных процессов.
Равновесный процесс может быть изображен на графике соответствующей кривой (рис. 1). Неравновесные процессы мы будем условно изображать пунктирными кривыми.
Понятия равновесного состояния и равновесного процесса играют большую роль в термодинамике. Все количественные выводы термодинамики строго применимы только к равновесным процессам.
Основными параметрами, при помощи которых описывается состояние системы, являются давление (p), объем (V), температура (T). Эти параметры являются макроскопическими параметрами, в отличие от параметров, характеризующих атомы и молекулы, которые являются микроскопическими параметрами.
Давление - скалярная физическая величина, равная отношению нормальной составляющей силы давления Fn к площади поверхности S:
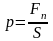 .
(4)
.
(4)
За единицу давления принимается такое давление, при котором на 1м2 действует сила 1Н. Называется эта единица давления паскаль (Па):
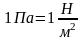 .
.
В технике широко используется внесистемная единица измерения давления – техническая атмосфера (ат):
1 ат = 98066,5 Па ≈ 9,81*104 Па.
Для практических целей используют так же миллиметры ртутного столба (мм рт. ст.):
1 мм рт. ст. = 133,322 Па
И физическую атмосферу, которая отличается от технической атмосферы:
1 атм = 760 мм рт. ст. = 1,01325*105Па.
Объем – область пространства, занимаемая системой. Размерность объема – м3.
Понятие температуры имеет смысл для равновесных состояний системы. Равновесным состоянием (состоянием термодинамического равновесия) называется состояние системы, не изменяющееся с течением времени.
Температура равновесного состояния — это мера интенсивности теплового движения ее частиц (атомов, ионов). В термодинамике температура – это физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы.
Температурные шкалы устанавливаются опытным путем. В международной стоградусной шкале температура измеряется в градусах Цельсия (°С) и обозначается t. Считается, что при нормальном давлении в 1,01325*105Па температура плавления льда равна 0°С, кипения воды — 100°С.
В термодинамической шкале температур температура измеряется в кельвинах (К) и обозначается Т.
Абсолютная температура Т и температура t по стоградусной шкале связаны соотношением:
T = t + 273,15.
Температура Т = 0 (t = -273,15°С) называется абсолютным нулем температуры. За абсолютный нуль температуры принимается температура, при которой прекращается тепловое движение молекул.
Параметры состояния равновесной системы зависят друг от друга. Соотношение, устанавливающее зависимость давления р в системе от объема V и температуры Т, называется уравнением состояния.
