
- •Примеры решения задач Гравиметрический анализ
- •Растворимость осадка в отсутствие избытка одноименного иона будет равна
- •Кислотно-основное титрование
- •Титрование по методу осаждения и по методу комплексообразования
- •Титрование по методу окисления восстановления
- •Физико-химические методы анализа Электрохимические методы
- •Оптические методы
Титрование по методу окисления восстановления
Пример 1. Рассчитайте концентрации реагентов и продуктов реакции в точке эквивалентности при титровании 0,100 н. раствора Fe2+ 0,100 н. раствором Се4+ при 25 °С, если оба раствора являются 1,0 М по H2SO4.
Решение. В данном случае для вычисления потенциала в точке эквивалентности удобно воспользоваться формальными потенциалами:
E=(1,44+0.68)/2=1,06 B.
Молярное отношение Fe2+ и Fe3+ в точке эквивалентности можно найти по уравнению Нернста:
![]()
![]()
Ясно, что в точке эквивалентности большая часть Fe2+ превращена в Fe3+. С учетом разбавления можно сказать, что концентрация Fe3+ практически равна половине исходной концентрации Fe2+:
[Fe3+]=0,050 М.
Таким образом,
[Fe2+]=41070,050=2108 М.
Аналогичные результаты были бы получены, если уравнение Нернста применить для системы церий(IV) церий(III).
Пример 2. Выведите уравнение для расчета потенциала в точке эквивалентности несколько более сложной реакции:
5Fe2++MnO4+8H+5Fe3++Mn2++4Н2О.
Решение. Соответствующие полуреакции можно представить в виде
Fe3++eFe2+,
MnO7+8H++5еМп2++4Н2О.
Потенциал этой системы можно вычислить по уравнению
![]()
или
![]()
Для того чтобы при объединении выражений, стоящих под знаком логарифма, концентрации различных частиц сократились, уравнение полуреакции для перманганата необходимо умножить на 5 и сложить:
![]()
Стехиометрия реакции в точке эквивалентности требует, чтобы
[Fe2+]=5[Mn2+]
[Fe3+]=5[MnO4]
Подстановка найденных соотношений и преобразование дают
![]()
Обратите внимание на то, что для данного титрования потенциал в точке эквивалентности зависит от рН.
Пример 3. Выведите уравнение для расчета потенциала в точке эквивалентности реакции
6Fe2++Cr2O72+14Н+6Fe3++2Cr3++7H2O.
Решение. Поступая, как и в предыдущем примере, мы приходим к выражению
![]()
В точке эквивалентности
[Fe2+]=3[Cr3+]
[Fe3+]=6[Cr2O72]
Подстановка этих соотношений в предыдущее выражение дает
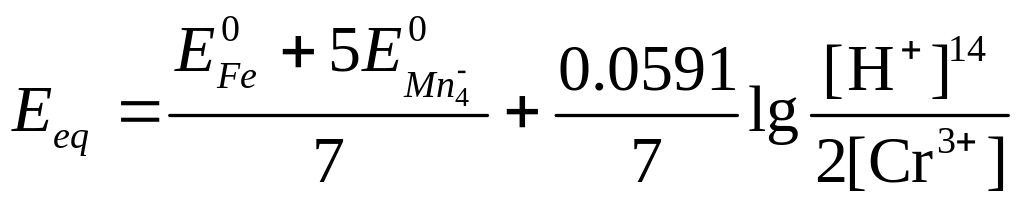
Пример 4. Постройте кривую титрования 50,00 мл 0,0500 н. раствора железа (II) 0,1000 н. раствором церия (IV), полагая, что оба раствора являются 1,0 М по H2SO4.
Решение. В данном случае мы будем пользоваться формальными, а не стандартными потенциалами.
Исходное значение потенциала. Раствор не содержит ионов церия. Вследствие окисления железа(П) кислородом воздуха в растворе содержится небольшое неизвестное количество железа (III), поэтому, не зная этой величины, мы не можем рассчитать исходное значение потенциала.
После добавления 5,00 мл церия(IV). После добавления данного объема окислителя в растворе появляются в ощутимых количествах три участника реакции; концентрация четвертого церия (IV) очень низка.
Равновесная концентрация церия(III) равна общей его концентрации за вычетом концентрации непрореагировавшего церия (IV):
![]()
Такое приближение вполне допустимо, поскольку константа равновесия реакции имеет большую величину. Аналогично
![]()
![]()
Как мы уже видели, потенциал системы можно рассчитать с помощью любого из двух уравнений:
![]()
Второе уравнение в данном случае более удобно, поскольку входящие в него концентрации с приемлемым приближением известны. Подставляя в это уравнение равновесные концентрации железа (II) и железа(III), получаем
![]()
При использовании формального потенциала системы церий(IV) церий(Ш) и равновесных концентраций этих ионов мы получили бы то же значение потенциала.
Таким же образом можно получить значения потенциалов, необходимые для построения кривой вплоть до точки эквивалентности.
Потенциал в точке эквивалентности. Мы уже видели, что для данного титрования потенциал в точке эквивалентности равен 1,06 В.
После добавления 25,10 мл реагента. Теперь раствор кроме эквивалентных количеств железа (III) и церия(III) содержит избыток церия(IV). Концентрация железа(II) будет очень мала, поэтому
![]() ,
,
![]() ,
,
![]()
С точки зрения величины константы равновесия эти приближения вполне допустимы. Как и прежде, значение потенциала можно рассчитать по уравнению для системы железо (III) железо (II). Однако на этой стадии удобнее использовать потенциал системы церий(IV) церий(III), поскольку известны равновесные концентрации этих ионов. Поэтому
![]()
Аналогично можно рассчитать значения потенциалов после точки эквивалентности.
Пример 5. Постройте кривую титрования 50,00 мл 0,0500 н. раствора железа (П) 0,1000 н. раствором КМпО4. Для удобства предположим, что оба раствора являются 1,0 М по H2SO4.
Решение. Поскольку формальный потенциал системы Mn(VII) Mn(II) неизвестен, будем использовать стандартный потенциал, равный 1,51 В.
При титровании протекает реакция
5Fe2++MnO4+8H+5Fe3++Mn2++4H2O.
Следует заметить, что в уравнение Нернста входят молярные концентрации, а не нормальности растворов. В рассматриваемой реакции для частиц, содержащих марганец, молярность равна одной пятой нормальности раствора.
Потенциалы до точки эквивалентности. До точки эквивалентности потенциалы легко рассчитать, зная равновесные концентрации железа (II) и железа (III) в растворе.
Потенциал в точке эквивалентности. В точке эквивалентности потенциал для данной реакции рассчитывают по уравнению
![]()
В 1 М H2SO4 [H+]=1,0 M, следовательно, Eeq=1.37 B.
Потенциалы за точкой эквивалентности. Если добавлено 25,10 мл 0,1000 н. раствора KMnO4, то равновесные концентрации с учетом стехиометрии реакции равны:
![]()
![]()
Теперь целесообразно рассчитать электродный потенциал по стандартному потенциалу системы марганец (VII)—марганец (II):
![]()
Пример 6. На титрование 2,025 г Nа2С2О4 идет 24,10 мл раствора КMnО4. Рассчитать: а) титр раствора КМпО4; б) титр КMnО4 по Nа2С2О4.
Решение. Вычисления целесообразно вести в следующей последовательности:

Согласно уравнению реакции
5C2O42+2MnO4+16H+10CO2+2Mn2++8H2O
в конечной точке nC2O4/nKMnO4=5/2 или nKMnO4=2/5nC2O4
Отсюда

Пример 7. Навеску 1,80 г сплава, содержащего 1,5% хрома растворили в Н2SО4 и окислили ионы Сг3+ до Сr2О72. К раствору добавили 25,00 мл раствора FeSО4; на титрование избытка последнего израсходовали 5,00 мл раствора КМnО4. Предварительно определили, что на титрование 25,00 мл раствора FeSО4 расходуется 24,80 мл раствора КМnО4. Рассчитать: а) T(KMnO4/Cr); б) T(FeSO4).
Решение. Для определения условного титра обходимо вычислить массу хрома,
![]()
а также объем раствора КМnО4, соответствующий содержанию хрома в образце:
VКМnО4=24,805,00=19,80 мл,
следовательно,
![]()
Из условия задачи следует, что объем раствора железа, соответствующий содержанию хрома в образце, будет равен
![]()
Согласно уравнению реакции
6Fe2++Cr2O72+14H+6Fe3++2Cr3++7H2O,
nFeSO4/nCr=nFe/nCr=3.
Отсюда масса железа в 19,96 мл его раствора будет равна
![]() и
и
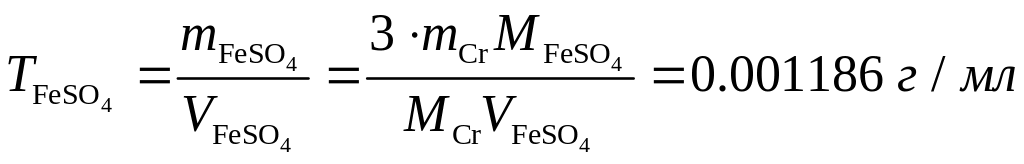
Пример 8. Рассчитать индикаторную ошибку титрования 20мл 0,1 н. VОSO4 0,1 н. раствором КMnО4 при рН=0 с N-фенилантраниловой кислотой в качестве индикатора (ннтервал перехода равен Eинд0,03 В)
Решение. При расчете необходимо использовать следующие полуреакции:
VО++2Н++eVO2++Н2О, Е1=0,9994В, z1=1
MnO4+8Н++5eMn2++4Н2О, E2=-1,51 В, z2=5
Отсюда в точке эквивалентности
![]()
Eинд=1,08 В, поэтому интервал перехода будет равен 1,08±0,03=1,111,05 В. Следовательно, при использовании этого индикатора раствор будет недотитрован и потенциал будет контролироваться сопряженной парой VO2+/VO+:
![]() .
.
Отсюда для индикаторной погрешности титрования с N-фенилантраниловой кислотой получим

Для интервала перехода 1,111,05 В относительная погрешность титрования будет находиться в пределах (1,321,22)102 или 1,321,22%.
Следовательно, при титровании с N-фенилантраниловой кислотой раствор VO2+ будет недотитрован. Для точных титрований этот индикатор рекомендовать нельзя.
Задачи
Хром, содержащийся в 1,87 г хромита FeOCr2O3, окислили до состояния +6 сплавлением с перекисью натрия. Плав обработали водой и прокипятили для разрушения избытка перекиси. После подкисления к раствору прибавили 50,0 мл 0,160 М раствора Fe2+. На титрование избытка железа (II) израсходовали 2,97 мл 0,0500 н. раствора К2С2О7.
Каково процентное содержание хрома в образце?
Каково процентное содержание хромита в образце?
Сколько граммов Na2S2O3.5H2O следует взять для приготовления 200 мл раствора с титром по йоду 0,01500 г/мл?
После растворения навески 0,1000 г неизвестного окисла железа и восстановления металла до Fe2+ на титрование израсходовано 12,61 мл 0,09930 н K2Cr2O7. Определить какую формулу имел анализируемый окисел: FeO, Fe2O3 или Fe3O4?
Вычислите индикаторную ошибку титрования 0,1 М раствора Fe(II) перманганатом в 2 М H2SO4 с дифениламином.
Сколько граммов K2Cr2O7 следует взять для приготовления 2 л раствора с титром по йоду 0,002792? Какова нормальность раствора K2Cr2O7?
К 25,00 мл раствора H2S прибавили 50,00 мл 0,01960 н I2, избыток I2 оттитровали 11,00 мл 0,02040 н Na2S2O3. Сколько граммов H2S содержалось в 1 л исследуемого раствора?
До какого объема следует разбавить 500,0 мл 0,1000 н K2Cr2O7 для получения раствора с титром по железу 0,005000 г/мл.
Навеску 0,2000 г руды, содержащей MnO2, обработали 24,00 мл H2C2O4 в присутствии H2SO4 и на титрование не вошедшего в реакцию избытка H2C2O4 израсходовали 20,00 мл 0,004000 М KMnO4. Найти процентное содержание Mn в руде, если на 25,00 мл H2C2O4 израсходовали 45,00 мл KMnO4.
Сколько миллилитров 1,000 н K2Cr2O7 надо прибавить к 1 л раствора K2Cr2O7 с титром по железу 0,003500 г/мл, чтобы получить раствор с титром по железу 0,004500 г/мл?
Найдено, что молярность раствора перманганата по оксалату натрия в кислом растворе равна 0,0913/5. Затем перманганат применили в качестве окислителя для определения марганца по методу Фольгарда:
3Mn2++2MnO4+4ОН5MnО2(тв.)+2Н2О.
Рассчитайте процентное содержание марганца в минерале, если на титрование образца массой 0,467 г потребовалось 36,2 мл раствора перманганата.
2. Чему равен титр раствора I2 по As2O3, если 1,00 мл его эквивалентен 0,03000 г Na2S2O3?
Из 3,2057 г сплава осадили свинец в виде PbCrO4. Действием на осадок кислоты и KI выделили I2, на титрование которого израсходовали 9,15 мл 0,1028/2 М Na2S2O3. Рассчитать процентное содержание Pb в сплаве.
Определить процентное содержание хрома в стали, если навеска в 1,0100 г была растворена и окислена так, что имевшийся в стали хром перешел в ион Cr2O72-. Затем к полученному раствору добавили 50,00 мл 0,03 М раствора соли Мора. Избыток соли Мора оттитровали 5,50 мл 0,03105 М раствором KMnO4.
Рассчитать молярность раствора KMnO4, если 40,00 мл его окислили такую навеску KHC2O4H2C2O42H2O, какая потребует для своей нейтрализации 30,00 мл 0,5000 н NaOH.
Навеску 0,2600 г технического CuCl растворили в избытке солянокислого раствора NH4Fe(SO4)2. На титрование образовавшегося Fe2+ израсходовали 20,18 мл 0,1200/6 М K2Cr2O7. Найти процентное содержание CuCl в образце.
Какую навеску руды, содержащей 70 % Fe2O3, надо взять для анализа, чтобы после соответствующей ее обработки на титрование полученного раствора Fe(II) потребовалось 30,00 мл 0,1/5 М раствора KMnO4.
Анализ показал, что 1,00 мл раствора KHC2O4H2C2O42H2O эквивалентен 0,20 мл раствора KMnO4, а 1,00 мл раствора KMnO4 эквивалентен 0,1117 г Fe. Какова молярность раствора KHC2O4.H2C2O4.2H2O?
В мерную колбу вместимостью 250 мл поместили навеску 3,3590 г белильной извести и добавили воды до метки. Для титрования 25,00 мл полученной суспензии после соответствующей обработки потребовалось 18,29 мл раствора Na2S2O3 (T(Na2S2O35H2O)=0,02453). Вычислить процентное содержание активного хлора в белильной извести.
Навеска технического железного купороса в 5,7700 г была растворена и объем раствора доведен до 250 мл. Определить процентное содержание FeSO4 в техническом железном купоросе, если на титрование 25,00 мл этого раствора потребовалось 19,34 мл KMnO4, титр которого равен 0,003100 г/мл.
На титрование 20,00 мл H2C2O4 (Т(H2C2O42H2O)=0.006900 г/мл) израсходовали 25,00 мл раствора KMnO4. Рассчитать молярность и титр раствора KMnO4.
Из 25,00 мл раствора свинец осадили в виде PbCrO4, отфильтровали, промыли, растворили в кислоте и добавили избыток KI. На титрование выделившегося I2 израсходовали 31,50 мл 0,1010 н Na2S2O3. Рассчитать концентрацию свинца в растворе.
