
- •Примеры решения задач Гравиметрический анализ
- •Растворимость осадка в отсутствие избытка одноименного иона будет равна
- •Кислотно-основное титрование
- •Титрование по методу осаждения и по методу комплексообразования
- •Титрование по методу окисления восстановления
- •Физико-химические методы анализа Электрохимические методы
- •Оптические методы
Титрование по методу осаждения и по методу комплексообразования
Пример 1. Экспериментально найдено, что в среднем наблюдатель может обнаружить красную окраску Fe(SCN)2+ при концентрации 6,4106 М. Какую концентрацию Fe3+ следует создать при титровании 50,0 мл 0,050 М раствора Ag+ 0,100 М раствором KSCN, чтобы свести ошибку титрования к нулю?
Решение. Чтобы ошибка титрования была равна нулю, окраска FeSCN2+ должна появиться при концентрации Ag+, остающегося в растворе, равной суммарной концентрации роданида:
[Ag+]=[SCN]+[Fe(SCN)2+]=[SCN]+6,4106
или
![]()
Преобразуем
[SCN]2+6,4106[SCN]1,11012 =0, [SCN]=1,7107 M
Константа устойчивости FeSCN2+ равна
![]()
Подставим теперь в выражение для константы устойчивости концентрацию [SCN], обеспечивающую образование заметного для глаза количества FeSCN2+ в точке эквивалентности:
![]()
[Fe3+]=27 M.
Пример 2. Какую навеску вещества, содержащего 60% NaCl и 37% КСl (остальное индифферентные примеси), следует взять для анализа, чтобы расход 0,1 М АgNO3 на титрование не превышал 20,00 мл?
Решение, Если для анализа взято х г вещества, то число молей NаСl и КСl, содержащееся в навеске, равно
![]()
![]()
Кроме того,
nNaCl+nKCl=nAgNO3,
где nAgNO3=с AgNO3V AgNO3 число молей AgNO3, затраченное на титрование.
Сочетание этих соотношений дает уравнение, решением которого является х=0,1313 г.
Пример 3. В мерной колбе емкостью 500 мл растворили г КСl. К 25,00 мл раствора прибавили 50,00 мл 0,08470 M АgNО3. На титрование избытка Аg+ расходуется 23,88 мл раствора роданида аммония (ТNH4SCN/Ag=0,01068). Вычислить процентное содержание КСl образце.
Решение. Число молей АgNО3 (n1), введенное с раствором АgNО3 будет равно n1=cAgNO3VAgNO3
Число молей (n2) NH4SCN, израсходованное на титрование избытка иона Аg+, еоставит
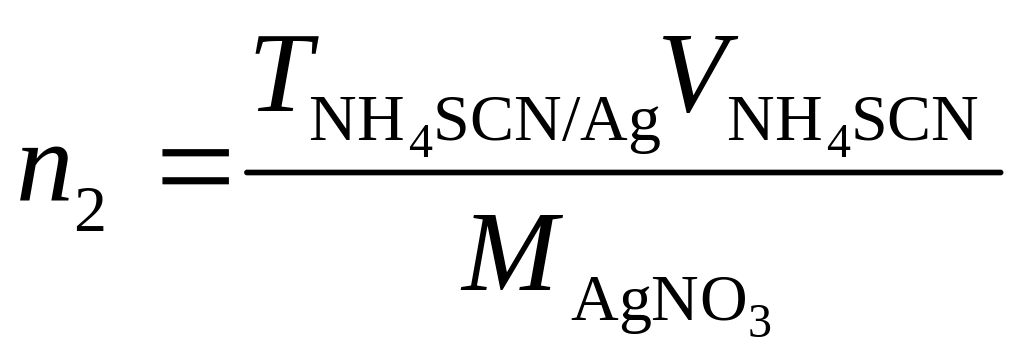
Тогда число молей (n3) КСl определится как разность: n3=n2n1
Процентное содержание КСl в образце вычислим по формуле
![]()
Пример 4. Постройте кривую титрования 50,0 мл 0,0100 М Са2+ 0,0100 М раствором ЭДТА в буферном растворе с рН 10,0.
Решение. Расчет условной константы. Величину условной константы устойчивости комплекса кальция с ЭДТА при рН 10 можно получить из константы устойчивости комплекса и величины и 4 для ЭДТА при рН 10:
KCaY=4 KCaY=0.3551010=1.751010
Вычисление рСа до точки эквивалентности. До достижения точки эквивалентности общая концентрация Са2+ равна сумме концентраций неоттитрованного избытка ионов Са2+ и ионов Са2+, образующихся за счет диссоциации комплекса; концентрация комплекса будет равна общей концентрации ЭДТА, т.е,
![]() .
.
Обычно вполне логично предположить, что величина второго члена в приведенном выше уравнении мала по сравнению с концентрацией незакомплексованного иона Са2+. Поэтому, например, после добавления 25,0 мл титранта
![]()
и
pCa=2.48
Значение рСа в точке эквивалентности. В этот момент концентрация CaY2 в растворе равна 0,00500 М, и диссоциация этого комплекса служит единственяым источником ионов Са2+. Очевидно, что концентрация ионов Са2+ будет также равна общей концентрации незакомплексованной ЭДТА, т.е.
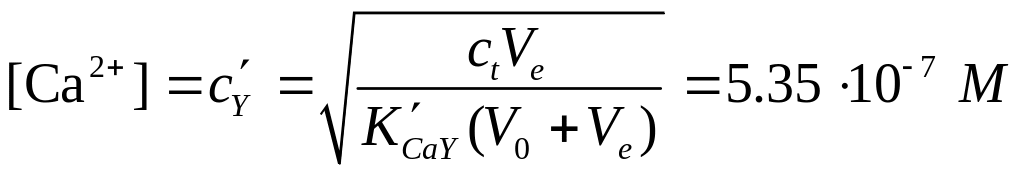 ,
рСа=6,27.
,
рСа=6,27.
Вычисление рСа за точкой эквивалентности. За точкой эквивалентности общие концентрации CaY2 и ЭДТА вычислить легко. Например, после добавления 60,0 мл титранта
![]() ,
,
![]() ,
,
рСа = 9,54.
Пример 5. Рассчитайте pZn в растворах, полученных при смешивании 40,0; 50,0 и 60,0 мл 0,00100 М раствора ЭДТА с 50,0 мл 0,00100 М раствора Zn2+. Полагаем, что и раствор Zn2+, и раствор ЭДТА содержат 0,100 М NH3 и 0,176 М NH4C1, и при этом создается постоянное значение рН, равное 9,0. Константы устойчивости аммиачных комплексов Zn2+ следующие: 1=1,9102, 2=4,4104, 3=1,04107 и 4=l.14109.
Решение. Расчет условной константы. Чтобы найти , примем [NН3]=cNн3 и подставим в уравнение для значения cNH3 и ступенчатых констант устойчивости i
=1/(1+19+420+1,04104+1,14105)=8.0106
Подставляя в уравнение для KZnY значения KZnY и 4 при рН 9,0, находим
KZnY= 5,21028,01063,21016=1,331010.
Расчет pZn после добавления 40,0 мл ЭДТА. Концентрация непрореагировавшего Zn2+ в этот момент с хорошим приближением равна
![]()
Вычислим равновесную концентрацию иона цинка:
[Zn2+]=сZn=81061,11104=8,91010 M, pZn=9.05.
Расчет pZn после добавления 50,0 мл ЭДТА. В точке эквивалентности концентрация cумма равновесных концентраций различных комплексов цинка, не содержащих ЭДТА, равна сумме равновесных концентраций незакомплексованных форм ЭДТА:

[Zn2+]=сZn=81061,94107=1,551012 M, pZn=11.81.
Расчет pZn после добавления 60,0 мл ЭДТА. В этом случае в растворе содержится избыток ЭДТА:
![]() ,
,
![]() ,
,
pZn=14,52.
Задачи
Сульфат, содержащийся в 1,515 г пробы, осадили методом гомогенного осаждения, добавив 50,0 мл 0,0264 М раствора BaЭДТА, и медленно подкислили для освобождения ионов Ba2+. По окончании осаждения раствор забуферили до рН=10 и разбавили точно до 250 мл. На титрование 25,0 мл прозрачного раствора потребовалось 28,7 мл стандартного 0,0154 М раствора Mg2+. Рассчитайте содержание Na2SO410H2O в пробе.
Раствор ЭДТА приготовили растворением 8,64 г чистой H4Y (мол, масса 292) в небольшом объеме гидроксида натрия и разбавлением точно до 500 мл. Рассчитайте для этого раствора а) титр по Са2+, мг/мл, б) титр по MgCO3, мг/мл.
В 550 мл раствора цианида калия содержится 1,62 г KCN. Найдите для этого раствора а) молярную концентрацию, б) в соответствии с реакцией
Cu2++4CNCu(CN)4,
титр по Cu2O, мг/мл.
На титрование 50,0 мл раствора, содержащего железо (II) и железо (Ш), потребовалось 13,7 мл 0,0120 М раствора ЭДТА при рН 2,0 и 29,6 мл при рН 6,0. Выразите концентрацию раствора каждого из растворенных веществ в г/мл.
Какую навеску смеси с массовой долей NaBr 15 % и NaCl 75 % нужно взять для анализа, чтобы на ее титрование расходовалось 15 мл 0,15 М раствора Hg(NO3)2?
Хром (=7,10 г/см3), выделенный на поверхности площадью 9,75 см2, растворили в соляной кислоте; раствор затем разбавили точно до 100 мл. 25,0 мл раствора забуферили до рН=5 и добавили 50,0 мл 0,00862 М раствора ЭДТА. На титрование избытка ЭДТА потребовалось 7,36 мл 0,01044 М раствора Zn2+. Рассчитайте среднюю толщину хромового покрытия.
Какую навеску смеси, содержащей по массе 36 % NaBr и 46 % KBr, следует взять при меркуриметрическом титровании бромидов 0,050 М раствором Hg(NO3)2 из бюретки номинальной вместимости 25 мл?
Ионы серебра, содержащиеся в 25,0 мл пробы, превратили в цианидный комплекс, добавив 30,0 мл 0,0800 М раствора Ni(CN)42–. Реакция:
Ni(CN)42–+2Ag+2Ag(CN)2–+Ni2+.
На титрование выделившихся ионов никеля израсходовали 43,7 мл 0,0240 М раствора ЭДТА. Рассчитайте концентрацию серебра в растворе.
Какую навеску силиката с массовой долей Fe2O3 около 4 % следует взять для прямого комплексонометрического титрования железа (III), чтобы затратить около 20 мл 0,20 М раствора ЭДТА?
Ионы калия из пробы минеральной воды объемом 250 мл осадили с помощью тетрафенилбората натрия
K++(С6Р5)4B–KB(С6Р5)4(тв)
Осадок отфильтровали, промыли и растворили в органическом растворителе. Добавили избыток хелата ртути (II) с ЭДТА:
4HgY2–+(C6H5)4B–+4H2OH3BO3+4(C6H5)Hg++4HY3–+OH–.
На титрование выделившейся ЭДТА израсходовали 29,64 мл 0,0558 М раствора Mg2+. Рассчитайте содержание ионов калия в пробе, мг/л.
Титруют 25,0 мл 0,0200 М раствора Ni2+ 0,0100 М раствором Na2H2Y при рН 10,0, поддерживаемым с помощью NH3 и NH4+ (4=0.355, 0*=1.34104). Рассчитайте pNi после добавления 45,0; 50,0; 55,0 мл титранта.
Какую массу минерала, содержащего около 75 % KCl, следует взять для приготовления 200,0 мл раствора, чтобы на титрование 250 мл его расходовалось 20,0 мл 0,1 М раствора Hg(NO3)2?
