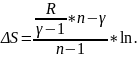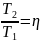- •Общие методические указания к решению задач
- •1 Физические основы механики
- •1.1 Основные формулы
- •1.2 Примеры решения задач
- •2 Основы термодинамики
- •2.1 Основные формулы
- •2.2 Примеры решения задач
- •3 Электростатика
- •3.1 Основные формулы
- •3.2 Примеры решения задач
- •4 Постоянный ток
- •4.1 Основные формулы
- •4.2 Примеры решения задач
- •5 Электромагнетизм
- •5.1 Основные формулы
- •5.2 Примеры решения задач
- •6 Задачи для самостоятельного решения
- •Список использованных источников
- •Приложение а (обязательное)
2 Основы термодинамики
2.1 Основные формулы
Количество вещества тела (системы):
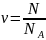
где N – число структур элементов (молекул, атомов, ионов и т.п.), составляющих тело (систему);
NA – постоянная Авогадро (NA = 6.02 *1023 моль-1).
Молярная масса вещества:
M = m/
где m – масса однородного тела (системы);
– количество вещества этого тела.
Уравнение Менделеева – Клапейрона ( уравнение состояния идеального газа):
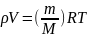
где m – масса газ;
М – молярная масса газа;
R – молярная газовая постоянная;
V – объем газа;
Т – термодинамическая температура.
Объединенный газовый закон (m = const):
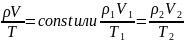
где ρ1, V1, T1 – давление, объем и температура газа в начальном состоянии;
ρ2, V2, T2 – те же величины в конечном состоянии.
Концентрация молекул:
n = N/V
где N – число молекул, содержащихся в данной системе;
 – плотность
вещества;
– плотность
вещества;
V – объем системы.
Формула справедлива не только для газов, но и для любого агрегатного состояния вещества.
Основное уравнение кинетической теории газов:
ρ=3/2 n<εn>
где <εn> - средняя кинетическая энергия поступательного движения молекулы.
Средняя кинетическая энергия поступательного движения молекулы:
<εn> = 3/2 kТ
где k – постоянная Больцмана.
Средняя полная кинетическая энергия молекулы:
<εn> = i/2 kТ
где i – число степеней свободы молекулы.
Зависимость давления газа от концентрации молекул и температуры:
p = nkT.
Скорости молекул:
 -
средняя квадратичная
-
средняя квадратичная
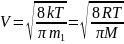 – средняя
арифметическая
– средняя
арифметическая
 -
наиболее вероятная
-
наиболее вероятная
где m1 - масса одной молекулы.
Удельные теплоемкости газа при постоянном объеме (Сv) и постоянном давлении (Cp):
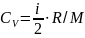
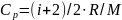
Связь между удельной с и молярной C теплоемкостями:
с = С/M
С = сМ
Уравнение Майера:
Сp + Cv = R
Внутренняя энергия газа:
U
= i/2RT(m/M) = m/M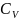 T
T
Первое начало термодинамики:
Q = △U+A
где Q – теплота, сообщенная системе (газу);
△U – изменение внутренней энергии системы;
A – работа, совершенная системой против внешних сил.
Работа расширения газа:
А
= в
общем случае
в
общем случае
А
= p(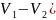 при изобарном процессе
при изобарном процессе
А
= m/ при изотермическом процессе
при изотермическом процессе
A
= - △U
= - m/M
при
адиабатном процессе, где γ =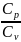 - показатель адиабаты.
- показатель адиабаты.
Уравнение Пуассона, связывающее параметры идеального газа при адиабатном процессе:
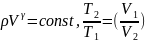 γ-1
γ-1
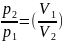 γ
,
γ
,
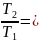
Термический КПД цикла:
η
=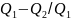
где
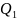 -
теплота, полученная рабочим телом от
теплоотдатчика;
-
теплота, полученная рабочим телом от
теплоотдатчика;
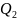 – теплота,
переданная рабочим телом теплоприемнику.
– теплота,
переданная рабочим телом теплоприемнику.
Термический КПД цикла Карно:
η
=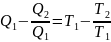
где
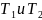 – термодинамические температуры
теплоотдатчика и теплоприемника.
– термодинамические температуры
теплоотдатчика и теплоприемника.
Коэффициент поверхностного натяжения:
α = F/l или α = △Е/△S
где F – сила поверхностного натяжения, действующая на контур l, ограничивающий поверхность жидкости;
△E – изменение свободной энергии поверхностной пленки жидкости, связанное с изменением площади △S поверхности этой пленки.
2.2 Примеры решения задач
Пример 1.
 Азот
массой m=0,1
кг был изобарно нагрет от температуры
Т1=200
К до температуры Т2
= 400 К. Определить работу А, совершенную
газом, полученную им теплоту и изменение
внутренней энергии азота.
Азот
массой m=0,1
кг был изобарно нагрет от температуры
Т1=200
К до температуры Т2
= 400 К. Определить работу А, совершенную
газом, полученную им теплоту и изменение
внутренней энергии азота.
Рисунок 5
Дано: m=0,1 кг Т1=200 К Т2 = 400 К µ=28*10-3 кг |
A=? ,Q=? , ΔU=? |
Решение:
Изобразим процесс на PV - диаграмме (рисунок 5). Работа газа при изобарическом расширении:
A = p(V2-V1).
Из уравнения Менделеева- Клапейрона:
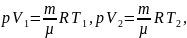
поэтому:

Размерность:
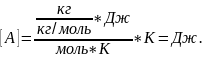
Изменение внутренней энергии газа определяется изменением его температуры:
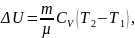
где
 -
молярная теплоемкость газа при постоянном
объеме;
-
молярная теплоемкость газа при постоянном
объеме;
i - число степеней свободы молекулы (азот - двухатомный газ, поэтому i = 5).
Тогда:
 Дж.
Дж.
Размерность:
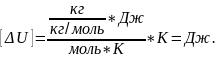
На основании первого начала термодинамики определим теплоту, полученную газом:
 Дж.
Дж.
Ответ: A=5,9*103 Дж, ΔU=14.8*103 Дж, Q=20,7*103 Дж.
Пример 2.
В сосуде находится водород массой m = 10 г. При изотермическом расширении объем водорода увеличивается в два раза. Считая водород идеальным газом, найти приращение его энтропии.
Дано: m = 10 г=10-2кг V2=2V1 µ=2*10-3 кг |
ΔS=? |
Согласно второму началу термодинамики изменение энтропии определяется начальным и конечным состоянием системы. Если процесс перехода системы из начального состояния в конечное обратимый, то:
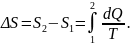
По первому началу термодинамики:
dQ=dU+dA .
При изотермическом процессе (Т = const) изменение внутренней энергии равно нулю (dU= 0), поэтому:
dQ=dA=p*dV ,

Из уравнения Менделеева - Клапейрона:
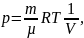
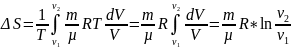 ,
,
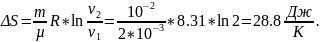
Размерность:
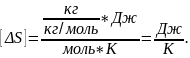
Ответ:
ΔS=28.8
 .
.
Пример 3.
Один моль идеального газа с показателем адиабаты γ совершает политропический процесс, в результате которого абсолютная температура газа Т возрастает в η раз. Показатель политропы равен η. Найти приращение энтропии газа ΔS.
Дано:
η,γ |
ΔS=? |
Приращение энтропии при обратимом процессе:
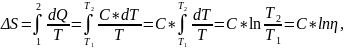
где С - молярная теплоемкость идеального газа в этом процессе.
Политропический процесс описывается уравнением:
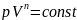
где n-показатель палитры;
p-давление газа;
V-объем, занимаемый газом.
Определим С из выражения для показателя палитры:
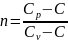 ,
,
где Cp, Сv - молярные теплоемкости при постоянном давлении и постоянном объеме соответственно.
Тогда:
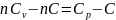
Отсюда:

Так как
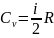 и
и
 , то
, то
 ,
,
где i - число степеней свободы;
R - универсальная газовая постоянная.
Определим i:
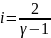
Тогда:

Следовательно, молярная теплоемкость С идеального газа в этом процессе:

Приращение энтропии:

Размерность:
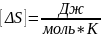
Ответ: