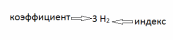Глава 1. Основные химические понятия
Атом – мельчайшая, химически неделимая частица.
Молекулы состоят из атомов. Н2 – молекула водорода, состоящая из 2 атомов Н – водорода.
ma(C) = Ar(C)∙ u
|
где ma(С) – масса атома углерода Ar(C ) – относительная атомная масса (см.таблицу Менделеева) u - атомная единица массы (а.е.м.) = 1,66∙10-27 кг = 1,66∙10-24 г |
Вещества |
|
|
|
Вещества характеризуются: |
|
Качественный состав (из каких элементом состоит) |
Количественный состав (число атомов каждого элемента) |
В молекуле: H3PO4 H, P, O |
В молекуле: H3PO4 H -3 шт, P- 1 шт, O – 4 шт |
Химическая формула:
Коэффициент показывает количество молекул, Индекс – количество атомов в одной молекуле. Большинство неметаллов (газы) имеют индекс 2 (H2, O2, CI2, N2, Br2, I2). Молекулы металлов содержат только 1 атом (Na, K, Al, Zn и т.д). |
3 O2 - три молекулы кислорода 2 О - два атома кислорода |
Составление химических формул по валентности |
Определение валентности элементов в соединениях |
VII II CI O
|
х II Cl2O7
|
Элементы с постоянной валентностью |
|
H, Li, Na, K, F |
I |
O, Mg, Ca, Ba, Zn |
II |
Al, B |
III |
|
|
Относительная молекулярная и молярная масса.
M(H3PO4) = Mr(H3PO4)= Ar(H)∙3+ Ar(P)∙1+ Ar(O)∙4
Где M(H3PO4) – молярная масса
Mr(H3PO4) – относительная молекулярная масса
Ar – относительная атомная масса (см. табл.Менделеева)
Массовая доля элемента в соединении (w)
w(A)AxBy
=

Химическое количество вещества (n) - моль
n= |
|
Через массу |
Через объем (только для газов) |
Через количество… (атомов, молекул, ФЕ) |
|||||
Числитель |
m |
Масса вещества (г) |
V |
Объем |
N |
Количество… |
|||
Знаменатель |
M |
Молярная масса (г/моль) |
Vm |
Молярный объем 22,4 дм3/моль |
Na |
Постоянная Авогадро 6,02∙1023 моль-1 |
|||